Bài 22. Hydrogen halide. Muối halide trang 112, 113, 114, 115, 116 Hóa 10 Kết nối tri thức
Hydrochloric acid được sử dụng rộng rãi trong sản xuất, điển hình là dùng để đánh sạch bề mặt kim loại trước khi gia công, sơn, hàn, mạ điện 1. Nêu xu hướng biến đổi độ dài liên kết trong dãy HX 2. Từ Bảng 22.2, hãy nhận xét xu hướng biến đổi nhiệt độ sôi của các hydrogen halide. Giải thích
CH tr 112 MĐ
|
Hydrochloric acid được sử dụng rộng rãi trong sản xuất, điển hình là dùng để đánh sạch bề mặt kim loại trước khi gia công, sơn, hàn, mạ điện,… Trong công đoạn này, thép được đưa qua các bể chứa dung dịch HCl (được gọi là bể Picking) để tẩy bỏ lớp rỉ sét, sau đó rửa sạch bằng nước trước khi qua các công đoạn tiếp theo. Vậy các ứng dụng trên dựa vào tính chất quan trọng nào của hydrochloric acid? |
Phương pháp giải:
Acid tác dụng với kim loại
Lời giải chi tiết:
- Khi thép được đưa qua các bể chứa dung dịch HCl để tẩy bỏ lớp rỉ sét
=> Thể hiện tính chất tác dụng với kim loại của hydrochloric acid, cụ thể là tác dụng với kim loại sắt
Fe + 2HCl → FeCl 2 + H 2
CH tr 113 CH
|
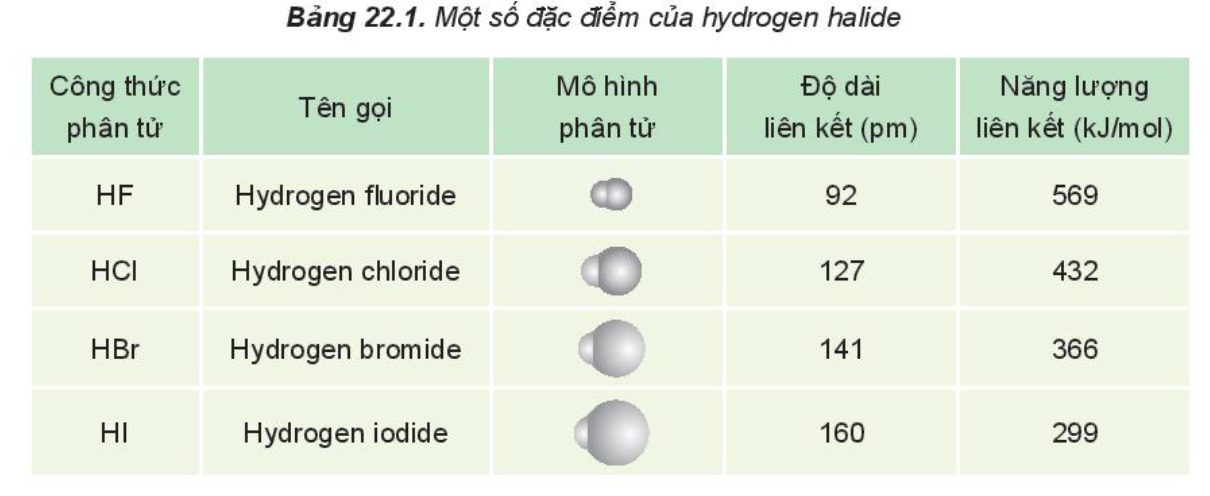
1. Nêu xu hướng biến đổi độ dài liên kết trong dãy HX |
Phương pháp giải:
Quan sát bảng 22.1
Lời giải chi tiết:
Quan sát Bảng 22.1 nhận thấy từ HF đến HI, độ dài liên kết HX tăng dần
CH tr 113 CH
|
2.
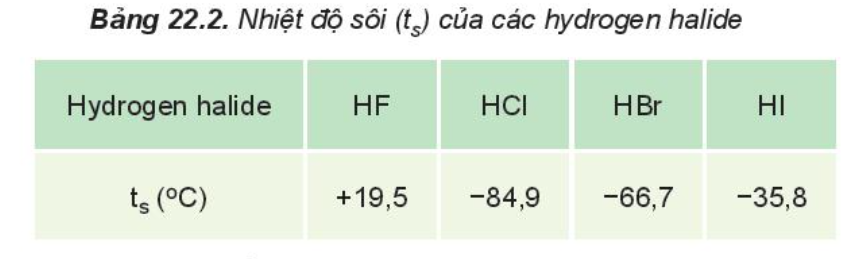
Từ Bảng 22.2, hãy nhận xét xu hướng biến đổi nhiệt độ sôi của các hydrogen halide. Giải thích
|
Phương pháp giải:
Nhiệt độ sôi phụ thuộc vào
+ Lực tương tác van der Waals giữa các phân tử
+ Khối lượng phân tử
Lời giải chi tiết:
Từ Bảng 22.2 nhận thấy:
- HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen: H-F…H-F…H-F
- Từ HCl đến HI, nhiệt độ sôi tăng do:
+ Lực tương tác van der Waals giữa các phân tử tăng
+ Khối lượng phân tử tăng
CH tr 113 CH
|
3. Ở một nhà máy sản xuất vàng từ quặng, sau khi cho dung dịch chứa hợp chất tan của vàng chảy qua cột chứa kẽm hạt, thu được chất rắn gồm vàng và kẽm. Đề xuất phương pháp thu được vàng tinh khiết |
Phương pháp giải:
- Dung dịch HCl hòa tan được kẽm nhưng không hòa tan được vàng
Lời giải chi tiết:
- Để thu được vàng tinh khiết từ hỗn hợp vàng – kẽm. Ta cho hỗn hợp vào dung dịch HCl
=> Kẽm tác dụng với HCl, vàng không tác dụng với HCl
Zn + 2HCl → ZnCl 2 + H 2
CH tr 113 HĐ
|
1. Dung dịch HCl tác dụng với kim loại Chuẩn bị: 2 ống nghiệm, dung dịch HCl loãng, Zn dạng hạt, Cu dạng lá Tiến hành: - Cho vào 2 ống nghiệm, mỗi ống khoảng 2 mL dung dịch HCl loãng - Cho vài hạt Zn vào ống (1), vài lá Cu vào ống (2) Quan sát hiện tượng và viết phương trình hóa học |
Phương pháp giải:
Kim loại tan trong acid tạo khí hydrogen
Lời giải chi tiết:
- Ống (1) thấy viên Zn tan ra và xuất hiện bọt khí không màu – H 2
Zn + 2HCl → ZnCl 2 + H 2 ↑
- Ống (2) không có hiện tượng gì
CH tr 114 HĐ
|
2. Dung dịch HCl tác dụng với muối NaHCO 3 rắn Chuẩn bị: dung dịch HCl loãng, muối NaHCO 3 rắn, ống nghiệm Tiến hành: Cho thìa nhỏ NaHCO 3 vào ống nghiệm, thêm tiếp dung dịch HCl loãng Quan sát hiện tượng và trả lời câu hỏi: 1. Viết phương trình hóa học của phản ứng 2. So sánh tính acid của HCl và H 2 CO 3 |
Phương pháp giải:
Acid + Muối → Acid mới + Muối mới.
=> Acid mới yếu hơn axit phản ứng
Lời giải chi tiết:
Xuất hiện bọt khí không màu – CO 2
1) Phương trình hóa học của phản ứng:
HCl + NaHCO 3 → NaCl + CO 2 ↑ + H 2 O
2)
Khi acid tác dụng với muối tạo ra acid mới và muối mới thì acid mới yếu hơn acid phản ứng
=> Tính acid của HCl mạnh hơn H 2 CO 3
CH tr 114 CH
|
4. Viết phương trình hóa học khi cho dung dịch hydrochloric acid lần lượt tác dụng với: Fe, MgO, Cu(OH) 2 , AgNO 3 |
Phương pháp giải:
- Acid + Kim Loại → Muối + H 2
- Acid + Oxide base → Muối + H 2 O
- Acid + Base → Muối + H 2 O
- Acid + Muối → Muối mới + Acid mới
Lời giải chi tiết:
Fe + 2HCl → FeCl 2 + H 2 ↑
MgO + 2HCl → MgCl 2 + H 2 O
Cu(OH) 2 + 2HCl → CuCl 2 + H 2 O
AgNO 3 + HCl → AgCl↓ + HNO 3
CH tr 114 CH
|
5. Hydrochloric acid thường được dùng để đánh sạch lớp oxide, hydroxide, muối carbonate bám trên bề mặt kim loại trước khi sơn, hàn, mạ điện Ứng dụng này dựa trên tính chất hóa học nào của hydrochloric acid? |
Lời giải chi tiết:
- Hydrochloric acid thường được dùng để đánh sạch lớp oxide, hydroxide, muối carbonate vì
+ HCl tác dụng với oxide, hydroxide → Muối + H 2 O
+ HCl tác dụng với muối carbonate → Muối mới + CO 2 + H 2 O
CH tr 115 HĐ
|
Nhận biết ion halide Chuẩn bị: 4 ống nghiệm; các dung dịch: AgNO 3 , NaF, NaCl, NaBr, NaI Tiến hành: - Cho 2 mL mỗi dung dịch NaF, NaCl, NaBr, NaI vào từng ống nghiệm - Nhỏ vài giọt dung dịch AgNO 3 vào mỗi ống nghiệm Quan sát hiện tượng và trả lời câu hỏi: 1. Viết phương trình hóa học các phản ứng xảy ra 2 . Nêu cách nhận biết dung dịch muối halide bằng dung dịch AgNO 3 |
Phương pháp giải:
Khi 2 muối tác dụng với nhau, điều kiện để xảy ra phản ứng là sản phẩm có ít nhất 1 chất kết tủa
Lời giải chi tiết:
1.
- Dung dịch NaF: không có hiện tượng gì, không xảy ra phản ứng hóa học
- Dung dịch NaCl: xuất hiện kết tủa trắng AgCl
AgNO 3 + NaCl → AgCl↓ + NaNO 3
- Dung dịch NaBr: xuất hiện kết tủa vàng nhạt AgBr
AgNO 3 + NaBr → AgBr↓ + NaNO 3
- Dung dịch NaI: xuất hiện kết tủa vàng AgI
AgNO 3 + NaI → AgI↓ + NaNO 3
2. Cách nhận biết dung dịch muối halide
- Cho dung dịch AgNO 3 vào 4 ống nghiệm chứa 4 dung dịch muối halide (từ F đến I)
+ Ống không có hiện tượng gì thì đó là muối F -
+ Ống có kết tủa trắng thì đó là muối Cl -
+ Ống có kết tủa vàng nhạt thì đó là muối Br -
+ Ống có kết tủa vàng thì đó là muối I -
CH tr 116 CH
| 6. Cho biết vai trò của NaBr và NaI khi tham gia phản ứng với sulfuric acid đặc |
Phương pháp giải:
NaBr và NaI sẽ đóng vai trò là chất khử khi tham gia phản ứng với sulfuric acid đặc
Lời giải chi tiết:
- NaBr khử H 2 SO 4 từ S +6 xuống S +4 => NaBr đóng vai trò là chất oxi hóa
$2Na\mathop {Br}\limits^{ - 1} + 2{H_2}\mathop S\limits^{ + 6} {O_4} \to N{a_2}S{O_4} + \mathop {B{r_2}}\limits^0 + \mathop S\limits^{ + 4} {O_2} + 2{H_2}O$
- NaI khử H 2 SO 4 từ S +6 xuống S -2 => NaI đóng vai trò là chất oxi hóa
$8Na\mathop {Br}\limits^{ - 1} + 5{H_2}\mathop S\limits^{ + 6} {O_4} \to 4N{a_2}S{O_4} + \mathop {4{I_2}}\limits^0 + {H_2}\mathop S\limits^{ - 2} + 4{H_2}O$
CH tr 116 CH
|
7. Vì sao không dùng trực tiếp nước biển làm nước uống, nước tưới cây? |
Phương pháp giải:
Trong nước biển có nồng độ muối ăn cao và có nhiều tạp chất hóa học khác
Lời giải chi tiết:
- Trong nước biển có nồng độ muối ăn khá cao, từ 3,1 – 3,5% mà thận người chỉ có thể điều tiết lượng muối trong cơ thể ở mức 0,9%
=> Nước biển rất mặn. Việc uống quá nhiều muối vào cơ thể sẽ khiến cho chúng ta mất nhiều nước hơn để thải chính lượng muối đó ra ngoài
CH tr 116 CH
|
8. Nước muối sinh lí thường chia làm 2 loại: loại dùng để tiêm truyền tĩnh mạch và loại dùng để nhỏ mắt, nhỏ mũi, súc miệng, rửa vết thương a) Loại nào cần vô trùng tuyệt đối và phải dùng theo chỉ định của bác sĩ? b) Để pha 1 lít nước muối sinh lí NaCl 0,9% dùng làm nước súc miệng thì cần bao nhiêu gam muối ăn? |
Phương pháp giải:
a) Tiêm truyền tĩnh mạch là tiêm vào bên trong mạch máu, tiêm vào bên trong cơ thể => Cần phải vô trùng tuyệt đối
b) Nước muối sinh lí = Nước + Muối
- Nước: Dung mỗi hòa tan muối là nước tinh khiết
- Muối: Chỉ thành phần hòa tan trong dunng dịch là muối NaCl
Lời giải chi tiết:
a)
- Nước muối sinh lí dùng để tiêm truyền tĩnh mạch cần phải vô trùng tuyệt đối và dùng theo chỉ định của bác sĩ. Vì nước muối này được tiêm vào mạch máu, tiêm vào bên trong cơ thể người. Do đó cần phải vô trùng hết sức nghiêm ngặt
- Còn nước muối để nhỏ mắt, nhỏ mũi, súc miệng, rửa vết thương (không đưa vào bên trong cơ thể người) thường để loại bỏ chất bẩn chứ không có tác dụng sát khuẩn nên không cần vô trùng tuyệt đối
b) Nước muối sinh lí = Nước + Muối
- 1L nước cất tương đương với 1 kg
- Vì nồng độ muối thấp nên có thể coi 1L dung dịch muối = 1 kg = 1000g
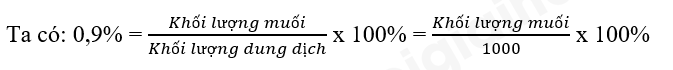
=> Khối lượng muối = 9 gam
Vậy để pha 1 lít nước muối sinh lí NaCl 0,9% dùng làm nước súc miệng thì cần 9 gam muối ăn