Bài 17: Phenol trang 108, 109, 110, 111, 112, 113, 114 Hóa học 11 Chân trời sáng tạo
Hexylresorcinol là chất có tính gây tê cục bộ, tính khử trùng và tẩy giun, dung dịch hexylresorcinol 0,1% dùng để súc miệng có tác dụng diệt khuẩn. Hexylresorcinol là hợp chất phenol, cùng với một số phenol và dẫn xuất phenol khác có tác dụng khử trùng, diệt nấm mốc. Một số phenol có khả năng chống oxi hoá, được sử dụng trong bảo quản thực phẩm, mĩ phẩm như E320, E321. Phenol là gì? Phenol có cấu tạo, tính chất và ứng dụng trong lĩnh vực nào?
CH tr 108 MĐ
Hexylresorcinol là chất có tính gây tê cục bộ, tính khử trùng và tẩy giun, dung dịch hexylresorcinol 0,1% dùng để súc miệng có tác dụng diệt khuẩn. Hexylresorcinol là hợp chất phenol, cùng với một số phenol và dẫn xuất phenol khác có tác dụng khử trùng, diệt nấm mốc. Một số phenol có khả năng chống oxi hoá, được sử dụng trong bảo quản thực phẩm, mĩ phẩm như E320, E321.
Phenol là gì? Phenol có cấu tạo, tính chất và ứng dụng trong lĩnh vực nào?
Phương pháp giải:
Trình bày khái niệm, tính chất vật lí, hóa học và ứng dụng của phenol.
Lời giải chi tiết:
- Phenol là hợp chất trong phân tử có một hoặc nhiều nhóm hydroxy liên kết trực tiếp với nguyên tử carbon của vòng benzene.
- Tính chất:
+ Tính chất vật lí: Phenol là chất rắn, không màu; phenol độc, gây bỏng cho da. Phenol ít tan trong nước lạnh, tan vô hạn trong nước ở 66 °C, tan tốt trong ethanol. Các phenol có nhiệt độ nóng chảy, nhiệt độ sôi cao hơn các hydrocarbon thơm có khối lượng phân tử tương đương.
+ Tính chất hóa học: Phenol có tính acid yếu và phản ứng thế nguyên tử hydrogen trên vòng benzene.
- Ứng dụng: Phenol được sử dụng phổ biến trong lĩnh vực sản xuất như: chất sát trùng, diệt nấm, vi khuẩn, chất bảo quản, chất dẻo, chất kết dính, dược phẩm, phẩm nhuộm,...
CH tr 108 CH 1
Quan sát các hợp chất phenol, cho biết đặc điểm của nhóm OH giống và khác nhóm OH trong phân tử alcohol như thế nào.
Phương pháp giải:
- Phenol là hợp chất trong phân tử có một hoặc nhiều nhóm hydroxy liên kết trực tiếp với nguyên tử carbon của vòng benzene.
- Alcohol là hợp chất hữu cơ có nhóm chức hydroxy (-OH) liên kết với nguyên tử carbon no.
Lời giải chi tiết:
Nhóm OH trong phenol liên kết trực tiếp với nguyên tử carbon của vòng benzene.
Nhóm OH của alcohol liên kết với nguyên tử carbon no.
CH tr 109 CH 2
Quan sát công thức cấu tạo của phenol, cho biết các vị trí giàu mật độ electron trong vòng benzene. Nhóm phenyl hút electron, làm ảnh hưởng như thế nào đến liên kết O-H?
Phương pháp giải:
Mật độ electron trên nguyên tử oxygen bị dịch chuyển một phần vào vòng benzene làm tăng sự phân cực của liên kết O-H, đồng thời mật độ electron trong vòng benzene tăng, gây ra các tính chất ở nhóm –OH và trong vòng benzene của phenol.
Lời giải chi tiết:
Nhóm phenyl hút electron, mật độ electron trên nguyên tử oxygen bị dịch chuyển một phần vào vòng benzene làm tăng sự phân cực của liên kết O-H.
CH tr 109 LT
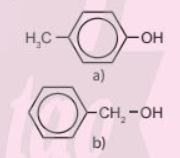
Chất nào sau đây thuộc loại phenol?
Phương pháp giải:
Phenol là hợp chất trong phân tử có một hoặc nhiều nhóm hydroxy liên kết trực tiếp với nguyên tử carbon của vòng benzene.
Lời giải chi tiết:
Chất (a) thuộc loại phenol vì có nhóm hydroxy liên kết trực tiếp với vòng benzene.
CH tr 110 CH 3
Đọc thông tin trong Bảng 17.1 và Hình 17.2, so sánh nhiệt độ nóng chảy của phenol với các hợp chất còn lại. Giải thích.
Phương pháp giải:
Các phenol có nhiệt độ nóng chảy, nhiệt độ sôi cao hơn các hydrocarbon thơm có khối lượng phân tử tương đương.
Lời giải chi tiết:
Phenol có nhiệt độ sôi cao hơn benzene và toluene, do phenol có nhóm –OH trong phân tử nên phenol tạo ra liên kết hydrogen giữa các phân tử.
CH tr 110 CH 4
So sánh khả năng phản ứng của phenol và ethanol khi tác dụng với NaOH.
Phương pháp giải:
- Phenol có tính acid yếu, phenol phản ứng được với dung dịch base như NaOH.
- Alcohol không phản ứng được với dung dịch base.
Lời giải chi tiết:
Phenol tác dụng với NaOH. Ethanol không phản ứng với NaOH.
C 6 H 5 OH + NaOH → C 6 H 5 ONa + H 2 O
CH tr 110 CH 5
Tiến hành Thí nghiệm 1, quan sát khả năng hoà tan của phenol trong nước. Nếu hiện tượng và giải thích kết quả thí nghiệm.
Phương pháp giải:
Phenol ít tan trong nước lạnh, tan vô hạn trong nước ở 66 °C, tan tốt trong ethanol.
Phenol có tính acid yếu, phenol phản ứng được với dung dịch base như NaOH.
Lời giải chi tiết:
- Phenol ít tan trong nước lạnh.
- Hiện tượng: Dung dịch ở dạng huyền phù, màu trắng đục tan thành dung dịch trong suốt.
- Giải thích: Phenol phản ứng với dung dịch sodium hydroxide tạo thành dung dịch muối tan trong suốt sodium phenolate (C 6 H 5 ONa).
C 6 H 5 OH + NaOH → C 6 H 5 ONa + H 2 O
CH tr 111 CH 6
Tiến hành Thí nghiệm 2, nêu hiện tượng thí nghiệm quan sát được.
Phương pháp giải:
Phenol có tính acid yếu, tan được trong dung dịch muối sodium carbonate.
Lời giải chi tiết:
- Hiện tượng: Dung dịch ở dạng huyền phù, màu trắng đục tan thành dung dịch trong suốt.
- Giải thích: Phenol phản ứng với dung dịch sodium carbonate tạo thành dung dịch muối tan trong suốt gồm sodium phenolate (C 6 H 5 ONa) và sodium hydrocarbonate (NaHCO 3 ).
- Phương trình: C 6 H 5 OH +Na 2 CO 3 C 6 H 5 ONa + NaHCO 3
CH tr 111 LT
Từ kết quả của Thí nghiệm 1, khi thêm tiếp khoảng 1 mL dung dịch HCl vào ống nghiệm (2), lắc đều và để ổn định. Quan sát thấy chất lỏng phân thành 2 lớp như ống nghiệm (1). Giải thích hiện tượng theo mô tả.
Phương pháp giải:
Phenol có tính acid yếu, muối của phenol phản ứng với acid mạnh hơn phenol.
Lời giải chi tiết:
Giải thích: Muối sodium phenolate phản ứng với hydrochloric acid tạo thành phenol và sodium chlordie. Phenol không tan do đó chất lỏng trong ống nghiệm phân thành 2 lớp.
Phương trình: C 6 H 5 ONa + HCl → C 6 H 5 OH + NaCl.
CH tr 111 CH 7
Tiến hành Thí nghiệm 3, nêu hiện tượng quan sát được và giải thích kết quả thí nghiệm.
Phương pháp giải:
Phenol phản ứng bromine tạo kết tủa trắng 2,4,6-tribromophenol.
Lời giải chi tiết:
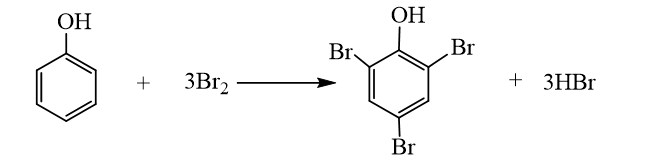
- Hiện tượng: Nước bromine mất màu và xuất hiện kết tủa trắng.
- Giải thích: Phenol phản ứng bromine, làm nước bromine mất màu, tạo kết tủa trắng 2,4,6-tribromophenol.
CH tr 112 LT
Hai chất o- nitrophenol p- nitro-phenol được và sử dụng trong sản xuất thuốc diệt trừ nấm mốc và sâu bọ. Viết phương trình hoá học của phản ứng điều chế o- nitrophenol và p- nitrophenol từ phenol và dung dịch HNO 3 loãng (phản ứng xảy ra ở nhiệt độ thường).
Phương pháp giải:
Nhóm OH làm tăng khả năng phản ứng thế nguyên tử hydrogen trong vòng benzene của phenol (dễ thế nguyên tử hydrogen hơn so với benzene). Ưu tiên thế nguyên tử hydrogen ở các vị trí ortho (o-) và para (p-) của phenol.
Lời giải chi tiết:
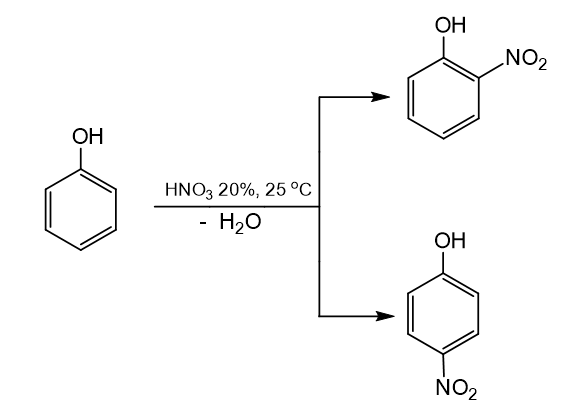
CH tr 113 CH 8
Liệt kê một số ứng dụng khác của phenol trong đời sống, sản xuất, y học.
Phương pháp giải:
Phenol được sử dụng phổ biến trong lĩnh vực sản xuất như: chất sát trùng, diệt nấm, vi khuẩn, chất bảo quản, chất dẻo, chất kết dính, dược phẩm, phẩm nhuộm,...
Lời giải chi tiết:
Phenol là nguyên liệu chính để sản xuất bisphenol A, nhựa phenol-formaldehyde hay poly(phenol-formaldehyde).
Phenol được dùng để sản xuất phẩm nhuộm, sản xuất thuốc nổ (2,4,6-trinitrophenol), chất diệt có 2,4-D (2,4-dichlorophenoxyacetic acid), chất diệt nấm mốc (các đồng phân của nitrophenol),...
Thuốc xịt chloraseptic chứa 1,4% phenol được dùng làm thuốc chữa đau họng.
CH 113 VD
Chất bảo quản thực phẩm được dùng phổ biến trong ngành thực phẩm chế biến sẵn. Các chất BHA, BHT thường dùng cho các sản phẩm đồ hộp, thực phẩm đóng gói, nước chấm, nước giải khát, ... Bên cạnh lợi ích trong bảo quản thực phẩm, các chất này cũng gây hại cho sức khoẻ con người nếu sử dụng thời gian dài. Hãy nêu quan điểm của em về vấn đề sử dụng các loại thực phẩm chế biến sẵn.
Phương pháp giải:
Nêu ưu, nhược điểm khi sử dụng các loại thực phẩm chế biến sẵn và cách sử dụng các loại thực phẩm chế biến sẵn.
Lời giải chi tiết:
- Ưu điểm: thực phẩm chế biến sẵn có thể giúp tiết kiệm thời gian trong việc chế biến và nấu nướng.
- Nhược điểm: các chất bảo quản như BHA, BHT dùng trong thực phẩm chế biến sẵn có thể gây hại đến sức khỏe nếu sử dụng thời gian dài và ở liều lượng cao.
Vậy ta nên hạn chế sử dụng thực phẩm chế biến sẵn, không sử dụng thực phẩm chế biến sẵn trong một thời gian dài.
Bài tập Bài 1
a) Viết công thức phân tử và công thức cấu tạo của phenol đơn giản nhất.
b) Phenol phản ứng với dung dịch potassium hydroxide. Tên của loại phản ứng là gì? Viết phương trình hoá học của phản ứng.
Phương pháp giải:
a) Phenol đơn giản nhất có công thức phân tử C 6 H 6 O và công thức cấu tạo C 6 H 5 -OH.
b) Phenol có tính acid yếu.
Phản ứng trung hòa là phản ứng giữa acid và base tạo muối trung hòa và nước.
Lời giải chi tiết:
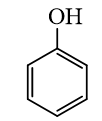
a) Phenol đơn giản nhất:
- Công thức phân tử: C 6 H 6 O
- Công thức cấu tạo:
b) Phản ứng giữa phenol và potassium hydoxide là phản ứng trung hòa.
Phương trình: C 6 H 5 OH + KOH → C 6 H 5 OK + H 2 O
Bài tập Bài 2
Viết công thức cấu tạo các đồng phân phenol có công thức phân tử C 7 H 8 O. Gọi tên các đồng phân đó.
Phương pháp giải:
Viết các công thức cấu tạo của phenol và 1 nhóm thế CH 3 .
Lời giải chi tiết:
Công thức cấu tạo các đồng phân phenol có công thức phân tử C 7 H 8 O:
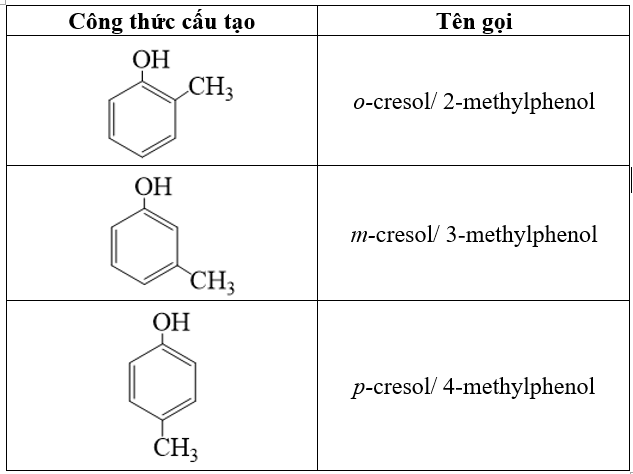
Bài tập Bài 3
Giải thích vì sao phenol có phản ứng thế với dung dịch bromine dễ dàng hơn benzene.
Phương pháp giải:
Nhóm OH làm tăng khả năng phản ứng thế nguyên tử hydrogen trong vòng benzene của phenol (dễ thế nguyên tử hydrogen hơn so với benzene). Ưu tiên thế nguyên tử hydrogen ở các vị trí ortho (o-) và para (p-) của phenol.
Lời giải chi tiết:
Trong phân tử phenol có nhóm phenyl hút electron, làm giảm mật độ electron ở nguyên tử oxygen của nhóm OH và tăng mật độ electron trong vòng benzene, nhiều nhất ở các vị trí ortho và para, do đó làm tăng khả năng thế nguyên tử hydrogen trong vòng benzene của phenol (dễ thế nguyên tử hydrogen hơn so với benzene).
Bài tập Bài 4
Aspirin được sử dụng để hạ sốt và giảm đau nhẹ đến trung bình do tình trạng đau nhức cơ, răng, cảm lạnh đau đầu và sưng tấy do viêm khớp. Phương trình hoá học điều chế aspirin từ salicylic acid được biểu diễn như sau:

a) Salicylic acid chứa những nhóm chức nào?
b) Nhóm chức nào của salicylic acid đã tham gia phản ứng trên?
Phương pháp giải:
Nhóm chức kết hợp với gốc hydrocarbon (phần còn lại của phân tử hydrocarbon sau khi mất đi một hay nhiều nguyên tử hydrogen) để tạo thành phân tử chất hữu cơ mang những tính chất hoá học đặc trưng của nhóm chức đó.
Lời giải chi tiết:
a) Salicylic acid chứa nhóm chức -OH và –COOH.
b) Nhóm chức -OH của salicylic acid đã tham gia phản ứng trên.