Bài 19: Carboxylic acid trang 124, 125, 126, 127, 128, 129, 130, 131, 132 Hóa học 11 Chân trời sáng tạo
Một số loại acid hữu cơ được dùng trong, thực phẩm như acetic acid, lactic acid. Thường gặp nhất là carboxylic acid, có nhiều trong tự nhiên như trong thành phần của các loại trái cây, chúng gây ra vị chua và một số mùi quen thuộc. Carboxylic acid là gì? Những tính chất nào đặc trưng cho carboxylic acid?
CH tr 124 MĐ
Một số loại acid hữu cơ được dùng trong, thực phẩm như acetic acid, lactic acid. Thường gặp nhất là carboxylic acid, có nhiều trong tự nhiên như trong thành phần của các loại trái cây, chúng gây ra vị chua và một số mùi quen thuộc. Carboxylic acid là gì? Những tính chất nào đặc trưng cho carboxylic acid?
Phương pháp giải:
Nêu khái niệm, tính chất hóa học của carboxylic acid.
Lời giải chi tiết:
- Carboxylic acid là những hợp chất hữu cơ mà trong phân tử chứa nhóm carboxyl (-COOH) liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydrogen.
- Tính chất đặc trưng của carboxylic acid là tính acid (làm đổi màu quỳ tím, tác dụng với kim loại, base, oxide base, muối) và phản ứng ester hóa.
CH tr 124 CH 1
Quan sát Hình 19.1 hãy nêu đặc điểm chung về cấu tạo của carboxylic acid, nêu điểm khác về cấu tạo của carboxylic acid so với cấu tạo của aldehyde và ketone.
Phương pháp giải:
Carboxylic acid có nhóm chức carboxyl.
Aldehyde, ketone có nhóm chức carbonyl.
Lời giải chi tiết:
- Phân tử carboxylic acid có chứa nhóm chức carboxyl (-COOH). Nhóm chức carboxyl gồm nhóm hydroxyl (-OH) liên kết với nhóm carbonyl (>C=O).
- Khác với cấu tạo của aldehyde và ketone, carboxylic acid có nhóm hydroxyl (-OH).
CH tr 125 LT
Hãy viết công thức cấu tạo của các carboxylic acid đơn chức có công thức phân tử C 4 H 8 O 2 .
Phương pháp giải:
- Carboxylic acid là những hợp chất hữu cơ mà trong phân tử chứa nhóm carboxyl (-COOH) liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydrogen.
- Dãy đồng đẳng carboxylic acid đơn chức, no, mạch hở có công thức chung C n H 2n+1 COOH (n ≥ 0) hoặc C n H 2n O 2 (n ≥ 1).
Lời giải chi tiết:
Công thức cấu tạo của các carboxylic acid đơn chức có công thức phân tử C 4 H 8 O 2

CH tr 125 LT 2
Hãy chỉ ra hợp chất carboxylic acid trong số các chất sau đây: CH 3 CHO (1), C 6 H 5 OH (2), CH 2 =CH-COOH (3), HOOC-COOH (4).
Phương pháp giải:
Carboxylic acid là những hợp chất hữu cơ mà trong phân tử chứa nhóm carboxyl (-COOH) liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydrogen.
Lời giải chi tiết:
Hợp chất carboxylic acid: CH 2 =CH-COOH (3), HOOC-COOH (4).
CH tr 126 CH 2
Dựa vào Bảng 19.1, rút ra cách gọi tên carboxylic acid theo danh pháp thay thế.
Phương pháp giải:
Tên theo danh pháp thay thế của carboxylic acid đơn chức, mạch hở:
Số chỉ vị trí nhánh-Tên nhánh +Tên hydrocarbon ứng với mạch chính (bỏ kí tự e ở cuối) + oic + acid
Mạch chính là mạch carbon dài nhất chứa nhóm -COOH.
Đánh số nguyên tử carbon của nhóm -COOH là 1.
Lời giải chi tiết:
Tên theo danh pháp thay thế của carboxylic acid đơn chức, mạch hở:
Số chỉ vị trí nhánh-Tên nhánh +Tên hydrocarbon ứng với mạch chính (bỏ kí tự e ở cuối) + oic + acid
CH tr 126 LT 1
Gọi tên theo danh pháp thay thế của các carboxylic acid sau:
a) (CH 3 ) 2 CH-COOH
b) (CH 3 ) 3 C-COOH
c) CH 3 CH=CH-COOH
d) CH 3 CH=C(CH 3 )-COOH
Phương pháp giải:
Tên theo danh pháp thay thế của carboxylic acid đơn chức, mạch hở:
Số chỉ vị trí nhánh-Tên nhánh +Tên hydrocarbon ứng với mạch chính (bỏ kí tự e ở cuối) + oic + acid
Mạch chính là mạch carbon dài nhất chứa nhóm -COOH.
Đánh số nguyên tử carbon của nhóm -COOH là 1.
Lời giải chi tiết:
a) 2-methylpropanoic acid.
b) 2,2-dimethylpropanoic acid.
c) but-2-enoic acid.
d) 2-methylbut-2-enoic acid.
CH tr 126 LT 2
Viết công thức cấu tạo của các carboxylic acid có tên sau:
(a) Propanoic acid
(b) Pent-3-enoic acid
Phương pháp giải:
Dựa vào quy tắc gọi tên carboxylic acid để suy ra công thức cấu tạo.
Lời giải chi tiết:
a) CH 3 -CH 2 -COOH.
b) CH 3 -CH=CH-CH 2 -COOH.
CH tr 126 LT 3
Viết công thức cấu tạo các đồng phân acid có công thức phân tử C 5 H 10 O 2 . Gọi tên theo danh pháp thay thế của các đồng phân đó.
Phương pháp giải:
- Dãy đồng đẳng carboxylic acid đơn chức, no, mạch hở có công thức chung C n H 2n+1 COOH (n ≥ 0) hoặc C n H 2n O 2 (n ≥ 1).
- Tên theo danh pháp thay thế của carboxylic acid đơn chức, mạch hở:
Số chỉ vị trí nhánh-Tên nhánh +Tên hydrocarbon ứng với mạch chính (bỏ kí tự e ở cuối) + oic + acid
Lời giải chi tiết:
Công thức cấu tạo các đồng phân acid có công thức phân tử C 5 H 10 O 2

CH tr 127 CH 3
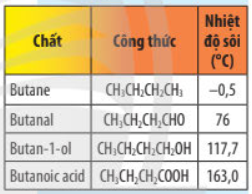
So sánh nhiệt độ sôi của butanoic acid với nhiệt độ sôi của các chất trong bảng sau. Giải thích.
Phương pháp giải:
Do cấu tạo của nhóm carboxyl nên carboxylic acid có khả năng tạo thành liên kết hydrogen bền vững hơn liên kết hydrogen giữa các phân tử alcohol, do đó ảnh hưởng lớn đến tính chất vật lí của chúng.
Nhiệt độ sôi của carboxylic acid cao hơn nhiệt độ sôi của alcohol, aldehyde, ketone tương ứng vì có liên kết hydrogen giữa 2 phân tử hoặc giữa nhiều phân tử.
Lời giải chi tiết:
Butanoic acid có nhiệt độ sôi lớn nhất. Giải thích:
+ Butanoic acid có nhiệt độ sôi cao hơn butan-1-ol vì liên kết O–H trong nhóm carboxyl phân cực hơn liên kết O-H trong alcohol, dẫn đến liên hydrogen trong các phân tử butanoic acid bền hơn liên kết hydrogen giữa các phân tử butan-1-ol.
+ Các phân tử butanal không tạo được liên kết hydrogen nên nhiệt độ sôi của butanal thấp hơn nhiệt độ sôi của butan-1-ol.
+ Phân tử butanal phân cực hơn butane, do đó nhiệt độ sôi của butanal cao hơn butane.
=> Thứ tự tăng dần về nhiệt độ sôi của các chất là: butane < butanal < butan-1-ol < butanoic acid.
CH tr 127 CH 4
Vì sao acetic acid tan vô hạn trong nước?
Phương pháp giải:
Nhờ khả năng tạo liên kết hydrogen với nước, các carboxylic acid đầu dãy tan vô hạn trong nước. Độ tan giảm dần theo độ tăng chiều dài mạch carbon.
Lời giải chi tiết:
Acetic acid có thể tan vô hạn trong nước vì:
+ Phân tử acetic acid có thể tạo liên kết hydrogen với nước.
+ Phân tử khối của acetic acid nhỏ.
CH tr 127 LT
Hãy sắp xếp theo chiều tăng dần nhiệt độ sôi của các chất sau, giải thích.
(1) C 3 H 8
(2) C 2 H 5 COOH
(3) C 2 H 5 CHO
(4) C 3 H 7 OH
Phương pháp giải:
Nhiệt độ sôi của carboxylic acid cao hơn nhiệt độ sôi của alcohol, aldehyde, ketone tương ứng vì có liên kết hydrogen giữa 2 phân tử hoặc giữa nhiều phân tử.
Lời giải chi tiết:
- Các chất trên đều có khối lượng phân tử tương đương nhau:
+ C 2 H 5 COOH có nhiệt độ sôi cao hơn C 3 H 7 OH vì liên kết O–H trong nhóm carboxyl phân cực hơn liên kết O-H trong alcohol, dẫn đến liên hydrogen trong các phân tử C 2 H 5 COOH bền hơn liên kết hydrogen giữa các phân tử C 3 H 7 OH.
+ Các phân tử C 2 H 5 CHO không tạo được liên kết hydrogen nên nhiệt độ sôi của C 2 H 5 CHO thấp hơn nhiệt độ sôi của C 3 H 7 OH.
+ Phân tử C 2 H 5 CHO phân cực hơn C 3 H 8 , do đó nhiệt độ sôi của C 2 H 5 CHO cao hơn C 3 H 8 .
=> Thứ tự theo chiều tăng dần về nhiệt độ sôi của các chất là:
(1) C 3 H 8 < (3) C 2 H 5 CHO < (4) C 3 H 7 OH < (2) C 2 H 5 COOH
CH tr 128 CH 5
Từ đặc điểm cấu tạo nhóm carboxyl dự đoán tính chất hoá học đặc trưng của hợp chất carboxylic acid.
Phương pháp giải:
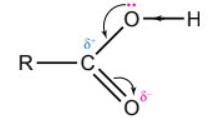
Nhóm >C=O hút electron nên liên kết O–H trong carboxylic acid phân cực hơn so với alcohol, phenol.
Lời giải chi tiết:
- Trong nhóm carboxyl, mật độ electron tại nhóm OH chuyển dịch về phía nhóm C=O nên nguyên tử hydrogen trong nhóm OH trở nên linh động hơn và mang một phần diện tích dương (δ + ), do đó các hợp chất carboxylic acid có tính acid.
- Trong nhóm carboxyl, liên kết C=O phân cực, nguyên tử carbon mang một phần diện tích dương (δ + ), khiến mật độ electron tại nhóm OH chuyển dịch về phía nhóm C=O, do đó liên kết C-OH phân cực mạnh, nhóm –OH dễ bị thay thế, nên carboxylic acid có thể tham gia phản ứng ester hoá.
CH tr 128 CH 6
Biết K a (hằng số phân li acid) của R-COOH theo biểu thức sau:
\({{\rm{K}}_{\rm{a}}}{\rm{ = }}\frac{{{\rm{(}}{{\rm{H}}^{\rm{ + }}}{\rm{)}}{\rm{.(RCO}}{{\rm{O}}^{\rm{ - }}}{\rm{)}}}}{{{\rm{(RCOOH)}}}}\)
Dựa vào Bảng 19.3, nhận xét về tính acid của carboxylic acid. Nêu tính chất hoá học đặc trưng của chúng.
Phương pháp giải:
Hằng số phân li acid nhỏ, tính acid yếu.
Lời giải chi tiết:
Carboxylic acid có tính acid yếu:
+ Làm quỳ tím hóa đỏ.
+ Tác dụng với kim loại đứng trước hydrogen trong dãy hoạt động hóa học, giải phóng khí hydrogen.
+ Tác dụng với base, oxide base.
+ Tác dụng với một số muối.
CH tr 128 CH 7
Tiến hành Thí nghiệm 1 theo hướng dẫn. Nếu hiện tượng xảy ra. Giải thích và viết phương trình hoá học của phản ứng.
Phương pháp giải:
Carboxylic acid có tính acid yếu:
+ Làm quỳ tím hóa đỏ.
+ Tác dụng với kim loại đứng trước hydrogen trong dãy hoạt động hóa học, giải phóng khí hydrogen.
+ Tác dụng với base, oxide base.
+ Tác dụng với một số muối.
Lời giải chi tiết:
- Khi nhỏ vài giọt dung dịch acetic acid lên mẩu giấy quỳ tím, mẩu quỳ tím hóa đỏ vì acetic acid có tính acid.
- Khi cho vào ống nghiệm thứ nhất chứa dung dịch acetic acid vài mẩu magnesium, mẩu magnesium tan và xuất hiện bọt khí.
→ Giải thích: Acetic acid phản ứng với magnesium, làm magnesium tan và tạo khí hydrogen.
2CH 3 COOH + Mg → 2(CH 3 COO) 2 Mg + H 2 ↑
- Khi cho vào ống nghiệm thứ hai chứa acetic acid 1 thìa sodium carbonate, sodium carbonate tan và xuất hiện bọt khí.
→ Giải thích: Acetic acid phản ứng với sodium carbonate, sinh ra khí carbon dioxide.
2CH 3 COOH + Na 2 CO 3 → 2CH 3 COONa + H 2 O + CO 2 ↑
CH tr 128 VD
Hãy lựa chọn hoá chất hợp lí để làm sạch lớp cặn trong các dụng cụ đun và chứa nước nóng. Giải thích.
Phương pháp giải:
Lớp cặn trong các dụng cụ đun và chứa nước nóng là calcium carbonate. Có thể loại bỏ muối này bằng carboxylic acid.
Lời giải chi tiết:
Trong giấm ăn có chứa acetic acid, do đó có thể sử dụng giấm ăn để hòa tan lớp cặn đó rồi vệ sinh dụng cụ đun, chứa nước nóng.
2CH 3 COOH + CaCO 3 → 2(CH 3 COO) 2 Ca + H 2 O + CO 2 ↑
CH tr 129 LT 1
Hoàn thành các phương trình hoá học của các phản ứng sau.
a) (CH 3 ) 2 CHCOOH + Ca →
b) HOOC-COOH + NaOH →
d) HCOOH + Na 2 CO 3 →
d) C 2 H 5 COOH+CuO →
Phương pháp giải:
Carboxylic acid có tính acid yếu:
+ Làm quỳ tím hóa đỏ.
+ Tác dụng với kim loại đứng trước hydrogen trong dãy hoạt động hóa học, giải phóng khí hydrogen.
+ Tác dụng với base, oxide base.
+ Tác dụng với một số muối.
Lời giải chi tiết:
a) 2(CH 3 ) 2 CHCOOH + Ca → 2((CH 3 ) 2 CHCOO) 2 Ca + H 2 ↑
b) HOOC-COOH + 2NaOH → NaOOC-COONa + 2H 2 O
d) 2HCOOH + Na 2 CO 3 → 2HCOONa + H 2 O + CO 2 ↑
d) 2C 2 H 5 COOH+CuO → (C 2 H 5 COO) 2 Cu + H 2 O
CH tr 129 LT 2
Trình bày cách phân biệt các dung dịch sau bằng phương pháp hoá học ethanol, acetaldehyde, acetic acid và acrylic acid.
Phương pháp giải:
Sử dụng quỳ tím để phân biệt carboxylic acid với aldehyde, alcohol.
Sử dụng nước bromine để phân biệt carboxylic acid no và carboxylic acid không no.
Sử dụng nước bromine để phân biệt alcohol và aldehyde.
Lời giải chi tiết:
- Đánh số thứ tự cho từng dung dịch. Trích dung dịch làm mẫu thử đánh số thứ tự tương ứng.
- Nhúng mẩu quỳ tím vào các mẫu thử:
+ Mẫu thử chứa acetaldehyde và ethanol không làm quỳ tím đổi màu.
+ Hai mẫu thử chứa acetic acid, acrylic acid làm quỳ tím hóa đỏ.
- Tiếp tục trích mẫu thử của hai dung dịch làm quỳ tím hóa đỏ. Nhỏ vài giọt nước bromine vào hai mẫu thử:
+ Mẫu thử chứa acrylic acid làm nước bromine mất màu.
CH 2 =CH–COOH + Br 2 → CH 2 Br – CHBr – COOH
+ Mẫu thử chứa acetic acid không làm nước bromine mất màu.
- Tiếp tục trích mẫu thử của hai dung dịch không làm quỳ tím hóa đỏ. Nhỏ vài giọt nước bromine vào hai mẫu thử:
+ Mẫu thử chứa acetaldehyde làm nước bromine mất màu.
\({\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{CH = O + B}}{{\rm{r}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH + 2HBr}}\)
+ Mẫu thử chứa ethanol không làm nước bromine mất màu.
CH tr 129 CH 8
Tiến hành Thí nghiệm 2 theo các bước. Quan sát, nêu hiện tượng.
Dấu hiệu nào giúp nhận biết có sản phẩm mới được tạo thành? Giải thích.
Phương pháp giải:
Alcohol phản ứng với carboxylic acid tạo ester. Ester sinh ra thường ít tan trong nước, nhẹ hơn nước, nổi lên trên và thường có mùi thơm đặc trưng.
Lời giải chi tiết:
- Hiện tượng: Dung dịch sau phản ứng phân thành 2 lớp, có mùi thơm nhẹ.
- Phương trình:
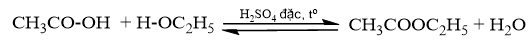
- Dấu hiệu nhận biết có sản phẩm mới được tạo thành: Dung dịch bị phân lớp, xuất hiện mùi. Vì ester sinh ra ít tan trong nước, nhẹ hơn nước, nổi lên trên và có mùi thơm đặc trưng.
CH tr 129 CH 9
Nêu vai trò của dung dịch H 2 SO 4 đặc, đá bọt và dung dịch NaCl bão hoà.
Phương pháp giải:
Phản ứng ester hóa cần xúc tác, nhiệt độ không quá sôi. Sau phản ứng cần tách lớp ester tạo thành ra khỏi dung dịch.
Lời giải chi tiết:
- Dung dịch H 2 SO 4 đặc là chất xúc tác, giúp phản ứng diễn ra nhanh hơn.
- Đá bọt giúp điều hòa quá trình sôi, vì nhiệt độ sôi của ethyl acetate thấp (77,1 o C), ethyl acetate sẽ bị bay hơi khi hỗn hợp phản ứng có nhiệt độ cao.
- Dung dịch NaCl bão hòa giúp tách ethyl acetate khỏi hỗn hợp phản ứng. Dung dịch sodium chloride bão hoà nặng hơn ethyl acetate, ethyl acetate nổi lên trên, do đó việc tách ester ra khỏi hỗn hợp sau phản ứng dễ hơn.
CH tr 129 CH 10
Nêu một số biện pháp để nâng cao hiệu suất của phản ứng.
Phương pháp giải:
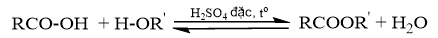
Phản ứng ester hóa là phản ứng giữa alcohol và carboxylic acid. Đây là phản ứng thuận nghịch, để nâng cao hiệu suất của phản ứng ta áp dụng nguyên lí chuyển dịch cân bằng của Le Chatelier.
Lời giải chi tiết:
Các biện pháp để nâng cao hiệu suất của phản ứng ester hoá:
- Lấy dư carboxylic hoặc alcohol.
- Thu hồi ester tạo thành khỏi khu vực phản ứng
CH tr 129 LT
Viết phản ứng tạo thành ester có công thức CH 3 -COO-CH 3 từ acid và alcohol tương ứng. Tìm hiểu ứng dụng của ester trên trong thực tiễn.
Phương pháp giải:
Phản ứng ester hóa là phản ứng giữa alcohol và carboxylic acid.
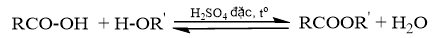
Lời giải chi tiết:
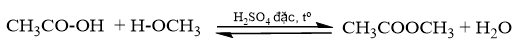
Ester CH 3 -COO-CH 3 được sử dụng làm dung môi ly trích cho các chất kháng sinh nặng, các loại dược phẩm thô, là một nguyên liệu để sản xuất và điều chế dược phẩm; được dùng trong công nghệ thực phẩm, làm chất phụ gia tạo hương, sản xuất da, chất tẩy sơn, chất hóa dẻo…
CH tr 130 CH 11
Quan sát Hình 19.5, nêu một số ứng dụng của carboxylic acid.
Phương pháp giải:
Carboxylic acid có nhiều ứng dụng trong các lĩnh vực như: thực phẩm, dược phẩm, mĩ phẩm, y tế, phẩm nhuộm,...
Lời giải chi tiết:
Carboxylic acid có nhiều ứng dụng trong các lĩnh vực như:
- Formic acid được dùng làm chất cầm màu trong công nghiệp nhuộm, da, cao su, mạ điện, sáp và làm dung môi.
- Acetic acid được dùng để sản xuất các hợp chất hoá học như vinyl acetate, acetic anhydride và acetate ester.
- Lactic acid là hợp chất có chức năng bảo vệ trạng thái cân bằng của vi sinh vật trong đường ruột và hạ độ pH. Lactic acid được dùng trong lĩnh vực thực phẩm như bảo quản rau quả, sản xuất bánh kẹo, sữa chua, bia, rượu và các đồ uống khác. Là thành phần quan trọng trong ngành công nghiệp mĩ phẩm.
- Propanoic acid được sử dụng làm chất bảo quản thực phẩm, sản xuất một số thuốc trừ sâu, dược phẩm và sản xuất các ester làm dung môi hay tạo mùi nhân tạo.
- Benzoic acid được dùng trong tổng hợp phẩm nhuộm, trong y học và công nghiệp dược phẩm.
- Acrylic acid và methacrylic acid dùng để tổng hợp polymer.
CH tr 131 CH 12
Phương pháp điều chế acetic acid bằng cách lên men giấm cần thực hiện trong những điều kiện nào? Giải thích. Nêu ứng dụng trong thực tiễn của phương pháp trên.
Phương pháp giải:
Phương pháp lên men giấm: Sử dụng men giấm để oxi hoá ethanol bằng oxygen không khí thành acetic acid.
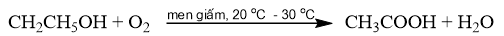
Lời giải chi tiết:
- Phương pháp lên men giấm được thực hiện trong điều kiện thoáng khí, nhiệt độ khoảng 20 o C – 30 o C.
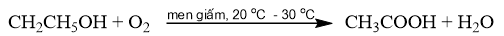
- Trong thực tiễn, phương pháp điều chế acetic acid bằng cách lên men giấm được sử dụng để sản xuất giấm ăn (chứa 2% – 5% acetic acid).
CH tr 131 VD
Tìm hiểu phương pháp lên men giấm và thực hành làm giấm ăn từ các nguồn nguyên liệu có sẵn để sử dụng trong gia đình.
Phương pháp giải:
Phương pháp lên men giấm: Sử dụng men giấm để oxi hoá ethanol bằng oxygen không khí thành acetic acid.
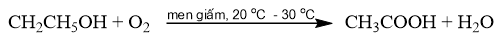
Lời giải chi tiết:
- Phương pháp lên men giấm sử dụng men giấm để oxi hoá ethanol bằng oxygen không khí thành acetic acid.

- Thực hành làm giấm ăn:
+ Chuẩn bị: 1 lít rượu vang(rượu vang đỏ hoặc rượu vang nho); 1 ly giấm nuôi; hũ thủy tinh sạch đựng giấm.
+ Cách làm
Bước 1 : Rửa sạch hũ thủy tinh rồi để khô
Bước 2 : Cho rượu vang và giấm nuôi vào hũ, chỉ đổ ngập 3/4 hũ, không đổ quá đầy. Đậy nắp và để hũ ở nơi thoáng mát, ít sáng trong vòng 1 tháng. Sau đó chắt giấm ra để dùng, giữ lại con giấm trong hũ và tiếp tục cho rượu vào để nuôi thêm mẻ giấm mới.
Bài tập Bài 1
Viết phương trình hoá học các phản ứng theo sơ đồ sau, ghi rõ điều kiện của phản ứng (nếu có):
CH 2 =CH 2 →CH 3 CH 2 OH→ CH 3 COOC 2 H 5
Phương pháp giải:
- Phản ứng cộng nước vào alkene (xúc tác H 3 PO 4 ).
- Phản ứng ester hóa (xúc tác H 2 SO 4 đặc).
Lời giải chi tiết:
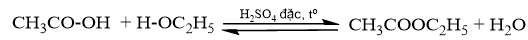
Bài tập Bài 2
Xác định các chất X, Y, Z và hoàn thành các phản ứng sau:
a) sodium hydroxide + X → sodium methanoate + nước
b) 3-methylbutanoic acid + Mg → Y + Z
Phương pháp giải:
Base + carboxylic acid → muối + nước.
Carboxylic acid + kim loại → muối + khí hydrogen.
Lời giải chi tiết:
a) NaOH + HCOOH → HCOONa + H 2 O
b) 2(CH 3 ) 2 CHCOOH + Mg → 2((CH 3 ) 2 CHCOO) 2 Mg + H 2 ↑
X là HCOOH, Y là ((CH 3 ) 2 CHCOO) 2 Mg và Z là H 2 .
Bài tập Bài 3
Bằng kiến thức hoá học, em hãy giải thích các cách làm sau đây:
a) Khi đồ dùng có đốm gỉ, sử dụng giấm để lau chùi, vết gỉ sẽ hết.
b) Khi thực hiện lên men rượu cần ủ kín, còn khi lên men giấm cần để thoáng.
Phương pháp giải:
- Đốm gỉ kim loại là các oxide của kim loại.
- Phương pháp lên men giấm: Sử dụng men giấm để oxi hoá ethanol bằng oxygen không khí thành acetic acid.
Lời giải chi tiết:
a) Các đốm gỉ là các oxide của kim loại, giấm ăn có tính acid (giấm chứa acetic acid). Do đó giấm ăn có thể phản ứng với các đốm gỉ, làm đốm gỉ hòa tan, khi lau chùi, vết gỉ sẽ hết.
b) Khi thực hiện lên men rượu cần ủ kín do lên men rượu là lên men kị khí: men rượu hoạt động không cần oxygen không khí, đường chuyển hoá thành rượu và khí carbonic.
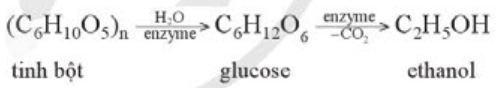
Khi thực hiện lên men giấm cần để thoáng do lên men giấm là lên men hiếu khí: rượu phản ứng với oxygen trong không khí để tạo giấm.
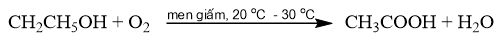
Bài tập Bài 4
Điều chế ethyl acetate bằng cách cho 6 gam acetic acid tác dụng với 5,2 gam ethanol có xúc tác là dung dịch sulfuric acid đặc và đun nóng, thu được 5,28 gam ester. Tính hiệu suất của phản ứng.
Phương pháp giải:
- Tính số mol ester từ chất phản ứng hết, khối lượng ester thu được trong ly thuyết rồi tính hiệu suất phản ứng.
- Công thức tính hiệu suất theo sản phẩm phản ứng: \({\rm{H = }}\frac{{{{\rm{m}}_{{\rm{sp(TT)}}}}}}{{{{\rm{m}}_{{\rm{sp(LT)}}}}}} \times 100\% \)
Với m sp (LT) và m sp (TT) lần lượt là khối lượng của sản phẩm tính theo lý thuyết và khối lượng của sản phẩm trên thực tế.
Lời giải chi tiết:
\({{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}}}{\rm{ = }}\frac{{\rm{6}}}{{{\rm{60}}}}{\rm{ = 0,1 (mol); }}{{\rm{n}}_{{{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}}}}{\rm{ = }}\frac{{{\rm{5,2}}}}{{46}}{\rm{ }} \approx {\rm{ 0,113 (mol)}}\)
Phương trình hóa học:
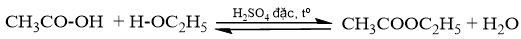
0,1 0,113
Ta có: \(\frac{{0,1}}{1} < \frac{{0,113}}{1}\) => acetic acid hết, ester tính theo acetic acid.
\(\begin{array}{l}{{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COO}}{{\rm{C}}_2}{{\rm{H}}_5}}}{\rm{ = }}{{\rm{n}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COOH}}}}{\rm{ = 0,1 (mol) }}\\ \Rightarrow {{\rm{m}}_{{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COO}}{{\rm{C}}_2}{{\rm{H}}_5}}} = {\rm{0,1}} \times {\rm{88 = 8,8 (g)}}\\ \Rightarrow {\rm{H = }}\frac{{5,28}}{{8,8}} \times 100\% = 60\% \end{array}\)