Bài 6. Một số hợp chất oxygen của nitrogen trang 22, 23, 24, 25 SBT Hóa 11 Kết nối tri thức
Oxide của nitrogen được tạo thành ở nhiệt độ rất cao, khi nitrogen có trong không khí bị oxi hoá được gọi là
6.1
Oxide của nitrogen được tạo thành ở nhiệt độ rất cao, khi nitrogen có trong không khí bị oxi hoá được gọi là
A. NO x tức thời. B. NO x nhiệt.
C. NO x nhiên liệu. D. NO x tự nhiên.
Phương pháp giải:
- NO x nhiệt (theral-NO x ) : Nhiệt độ rất cao (trên 3000 o C) hoặc tia lửa điện làm nitrogen trong không khí bị oxi hóa: \({{\rm{N}}_{\rm{2}}}\; + \;{{\rm{O}}_{\rm{2}}}{\rm{\;}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{NO}}\)
- NO x nhiên liệu (fuel-NO x ): Nitrogen trong nhiên liệu hoặc sinh khối(vật chất hữu cơ có nguồn gốc sinh vật) kết hợp với oxygen trong không khí.
- NO x tức thời (prompt- NO x ): Nitrogen trong không khí tác dụng với các gốc tự do ( là nguyên tử hoặc nhóm nguyên tử có electron tự do , chưa ghép đôi), gốc hydrocacbon, gốc hydroxyl.
Lời giải chi tiết:
Oxide của nitrogen được tạo thành ở nhiệt độ rất cao, khi nitrogen có trong không khí bị oxi hoá được gọi là NO x nhiệt.
→ Chọn B .
6.2
Oxide của nitrogen được tạo thành khi nguyên tố nitrogen trong nhiên liệu hoặc sinh khối kết hợp với oxygen dư thừa trong không khí được gọi là
A. NO x nhiên liệu. B. NO x tự nhiên.
C. NO x tức thời. D. NO x nhiệt.
Phương pháp giải:
- NO x nhiệt (theral-NO x ) : Nhiệt độ rất cao (trên 3000 o C) hoặc tia lửa điện làm nitrogen trong không khí bị oxi hóa: \({{\rm{N}}_{\rm{2}}}\; + \;{{\rm{O}}_{\rm{2}}}{\rm{\;}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{NO}}\)
- NO x nhiên liệu (fuel-NO x ): Nitrogen trong nhiên liệu hoặc sinh khối(vật chất hữu cơ có nguồn gốc sinh vật) kết hợp với oxygen trong không khí.
- NO x tức thời (prompt- NO x ): Nitrogen trong không khí tác dụng với các gốc tự do ( là nguyên tử hoặc nhóm nguyên tử có electron tự do , chưa ghép đôi), gốc hydrocacbon, gốc hydroxyl.
Lời giải chi tiết:
Oxide của nitrogen được tạo thành khi nguyên tố nitrogen trong nhiên liệu hoặc sinh khối kết hợp với oxygen dư thừa trong không khí được gọi là NO x nhiên liệu.
→ Chọn A .
6.3
Oxide của nitrogen được tạo thành khi nitrogen trong không khí tác dụng với các gốc tự do được gọi là
A. NO x nhiệt. B. NO x tức thời.
C. NO x tự nhiên. D. NO x nhiên liệu.
Phương pháp giải:
- NO x nhiệt (theral-NO x ) : Nhiệt độ rất cao (trên 3000 o C) hoặc tia lửa điện làm nitrogen trong không khí bị oxi hóa: \({{\rm{N}}_{\rm{2}}}\; + \;{{\rm{O}}_{\rm{2}}}{\rm{\;}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{NO}}\)
- NO x nhiên liệu (fuel-NO x ): Nitrogen trong nhiên liệu hoặc sinh khối(vật chất hữu cơ có nguồn gốc sinh vật) kết hợp với oxygen trong không khí.
- NO x tức thời (prompt- NO x ): Nitrogen trong không khí tác dụng với các gốc tự do ( là nguyên tử hoặc nhóm nguyên tử có electron tự do , chưa ghép đôi), gốc hydrocacbon, gốc hydroxyl.
Lời giải chi tiết:
Oxide của nitrogen được tạo thành khi nitrogen trong không khí tác dụng với các gốc tự do được gọi là NO x tức thời.
→ Chọn B .
6.4
Nitrogen monoxide được tạo thành khi mưa dông kèm theo sấm sét do phản ứng giữa nitrogen và oxygen trong không khí được gọi là
A. NO x nhiên liệu. B. NO x tức thời.
C. NO x tự nhiên. D. NO x nhiệt.
Phương pháp giải:
- NO x nhiệt (theral-NO x ) : Nhiệt độ rất cao (trên 3000 o C) hoặc tia lửa điện làm nitrogen trong không khí bị oxi hóa: \({{\rm{N}}_{\rm{2}}}\; + \;{{\rm{O}}_{\rm{2}}}{\rm{\;}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{NO}}\)
- NO x nhiên liệu (fuel-NO x ): Nitrogen trong nhiên liệu hoặc sinh khối(vật chất hữu cơ có nguồn gốc sinh vật) kết hợp với oxygen trong không khí.
- NO x tức thời (prompt- NO x ): Nitrogen trong không khí tác dụng với các gốc tự do ( là nguyên tử hoặc nhóm nguyên tử có electron tự do , chưa ghép đôi), gốc hydrocacbon, gốc hydroxyl.
Lời giải chi tiết:
Nitrogen monoxide được tạo thành khi mưa dông kèm theo sấm sét do phản ứng giữa nitrogen và oxygen trong không khí được gọi là NO x nhiệt.
→ Chọn D .
6.5
Mưa acid là hiện tượng nước mưa có pH thấp hơn 5,6 (giá trị pH của khi carbon dioxide bão hoà trong nước). Hai tác nhân chính gây mưa acid là
A. Cl 2 , HCl. B. N 2 , NH 3 . C. SO 2 , NO x . D. S, H 2 S.
Phương pháp giải:
Nước mưa thường có pH= 5,6 (chủ yếu do CO 2 tan tạo môi trường axit yếu). Khi nước mưa có pH < 5,6 gọi là hiện tượng mưa axit.
Tác nhân: do SO 2 và NO x phát thải chủ yếu do các hoạt động công nghiệp, nhiệt điện, giao thông , khai thác và chế biến dầu mỏ.
Lời giải chi tiết:
Hai tác nhân chính gây mưa acid là SO 2 , NO x .
→ Chọn C .
6.6
Số oxi hoá thấp nhất của nitrogen là
A. -3. B. 0. C. +1. D. +4.
Phương pháp giải:
Số oxi hóa của N: -3; 0; +1; +2; +3; +4; +5.
Lời giải chi tiết:
Số oxi hoá thấp nhất của nitrogen là -3.
→ Chọn A .
6.7
Phân tử nào sau đây có chứa một liên kết cho - nhận?
A. NH 3 . B. N 2 . C. HNO 3 . D. H 2 .
Phương pháp giải:
Liên kết cho – nhận:. là trường hợp đặc biệt của liên kết cộng hóa trị khi cặp electron dùng chung chỉ do một nguyên tử đóng góp. Nguyên tử đóng góp cặp electron là nguyên tử cho, nguyên tử nhận cặp electron gọi là nguyên tử nhân. Liên kết cho – nhận biển diễn bằng mũi tên “ → ”, gốc mũi tên là nguyên tử cho, đầu mũi tên là nguyên tử nhận.
Lời giải chi tiết:
Nitric acid (HNO 3 ) có công thức :
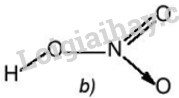
Liên kết N →O là liên kết cho nhận.
→ Chọn C .
6.8
Acid nào sau đây thể hiện tính oxi hoá mạnh khi tác dụng với chất khử?
A. HCl. B. HNO 3 . C. HBr. D. H 3 PO 4 .
Phương pháp giải:
Số oxi hóa của N: -3; 0; +1; +2; +3; +4; +5.
Nitric acid có tính oxi hóa rất mạnh do chứa nguyên tử N có số oxi hóa cao nhất (+5), nên HNO 3 có khả năng nhận electron.
Lời giải chi tiết:
Acid HNO 3 thể hiện tính oxi hoá mạnh khi tác dụng với chất khử .
→ Chọn B .
6.9
Kim loại nào sau đây không tác dụng với nitric acid?
A. Zn. B. Cu. C. Ag. D. Au.
Phương pháp giải:
HNO 3 oxi hóa hầu hết các kim loại (trừ vàng (Au) và platin(Pt)).
Lời giải chi tiết:
Au không tác dụng với nitric acid.
→ Chọn D .
6.10
Hiện tượng phú dưỡng là một biểu hiện của môi trường ao, hồ bị ô nhiễm do dư thừa các chất dinh dưỡng. Sự dư thừa dinh dưỡng chủ yếu do hàm lượng các ion nào sau đây vượt quá mức cho phép?
A. Sodium, potassium. B. Calcium, magnesium.
C. Nitrate, phosphate. D. Chloride, sulfate.
Phương pháp giải:
- Khái niệm: Là hiện tượng sinh vật phù du, rong, tảo phát triển rất mạnh.
- Nguyên nhân: Do sự dư thừa sinh dưỡng.
+) Khi làm lượng nitrogen trong nước đạt 300 μg/L và hàm lượng phosphorus đạt 20 μg/L sẽ gây hiện tượng phú dưỡng.
+) Nước thải, hay các đầm nuôi trồng thủy sản , sự dư thừa thức ăn chăn nuôi cũng gây ra sự dư thừa dinh dưỡng.
Lời giải chi tiết:
Sự dư thừa dinh dưỡng chủ yếu do hàm lượng các ion nitrate, phosphate vượt quá mức cho phép
→ Chọn C .
6.11
Cho các nhận định sau về tính chất hoá học của nitric acid: (1) có tính acid mạnh; (2) có tính acid yếu; (3) có tính oxi hoá mạnh; (4) có tính khử mạnh.
Số nhận định đúng là
A. 1. B. 2. C. 3. D. 4.
Phương pháp giải:
Nitric acid là một acid rất mạnh và có tính oxi hóa rất mạnh.
Lời giải chi tiết:
Các nhận định đúng về nitric acid là:
(1) có tính acid mạnh;
(3) có tính oxi hoá mạnh.
→ Chọn B .
6.12
Phát biểu nào sau đây không đúng?
A. NH 3 và HCl đều dễ tan trong nước.
B. HNO 3 và HCl đều là acid mạnh trong nước.
C. N 2 và Cl 2 đều có tính oxi hoá mạnh ở điều kiện thường.
D. KNO 3 và KClO 3 đều bị phân huỷ bởi nhiệt.
Phương pháp giải:
Trong phân tử nitrogen có liên kết ba bền vững với năng lượng liên kết lớn (945 kJ/mol).
Do đó ở nhiệt độ thường, phân tử nitrogen bền, khá trơ về mặt hóa học (khó phản ứng hóa học).
Lời giải chi tiết:
Ở nhiệt độ thường, phân tử nitrogen bền, khá trơ về mặt hóa học (khó phản ứng hóa học), do đó nitrogen không có tính oxi hóa mạnh.
→ Chọn C .
6.13
Phát biểu nào sau đây đúng?
A. N 2 và P đều tác dụng với oxygen ở nhiệt độ cao.
B. N 2 và P đều là chất khí ở điều kiện thường.
C. HNO 3 và H 3 PO 4 đều có tính oxi hoá mạnh.
D. HNO 3 và H 3 PO 4 đều là acid mạnh.
Phương pháp giải:
- Ở nhiệt độ cao, N 2 và P đều tác dụng với oxygen.
- N 2 là chất khí và P là chất rắn ở điều kiện thường.
- HNO 3 có tính oxi hóa mạnh, còn H 3 PO 4 không có tính oxi hoá mạnh.
- HNO 3 là acid mạnh, còn H 3 PO 4 acid trung bình.
Lời giải chi tiết:
Phát biểu đúng: N 2 và P đều tác dụng với oxygen ở nhiệt độ cao.
→ Chọn A .
6.14
Xét phản ứng trong quá trình tạo ra NO x nhiệt:
\({{\rm{N}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ }}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} \to {\rm{ 2NO}}\left( {\rm{g}} \right){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = {\rm{ }}180,6{\rm{ kJ}}\)
Nhiệt tạo thành chuẩn của NO(g) là
A. 180,6 kJ/mol. B. -180,6 kJ/mol.
C.-90,3 kJ/mol. D. 90,3 kJ/mol.
Phương pháp giải:
\[{\Delta _r}H_{298}^0 = \sum {\Delta _f}H_{298}^0(sp) - \sum {\Delta _f}H_{298}^0(tg)\]
Nhiệt tạo thành của đơn chất bằng 0.
Lời giải chi tiết:
\(\begin{array}{l}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} = 2{\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}({\rm{NO}}) - [{\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}({{\rm{N}}_{\rm{2}}}) + {\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}({{\rm{O}}_{\rm{2}}})]\\ \Leftrightarrow 180,6 = 2{\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}({\rm{NO}}) - [0 + 0]\\ \Rightarrow {\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}({\rm{NO}}) = \frac{{180,6}}{2} = 90,3{\rm{ (kJ)}}\end{array}\)
→ Chọn D .
6.15
Xét cân bằng tạo ra nitrogen(II) oxide ở nhiệt độ 2 000 °C:
\({{\rm{N}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ }}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ 2NO}}\left( {\rm{g}} \right){\rm{ }}{{\rm{K}}_{\rm{C}}} = {\rm{ }}4,{10.10^{ - 4}}\)
Ở trạng thái cân bằng, biểu thức nào sau đây có giá trị bằng K C ?
A. \(\frac{{{{[{\rm{NO}}]}^2}}}{{[{{\rm{N}}_{\rm{2}}}][{{\rm{O}}_{\rm{2}}}]}}\). B. \(\frac{{[{\rm{NO}}]}}{{[{{\rm{N}}_{\rm{2}}}][{{\rm{O}}_{\rm{2}}}]}}\).
C. \(\frac{{[{{\rm{N}}_{\rm{2}}}][{{\rm{O}}_{\rm{2}}}]}}{{{{[{\rm{NO}}]}^2}}}\). D. \(\frac{{[{\rm{NO}}]}}{{[{{\rm{N}}_{\rm{2}}}]}}\).
Phương pháp giải:
Tổng quát, nếu có phản ứng thuận nghịch sau: aA+bB \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \({{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\)
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
Trong phản ứng thuận nghịch, hằng số cân bằng K C của phản ứng xác định chỉ phụ thuộc vào nhiệt độ.
Lời giải chi tiết:
\({{\rm{N}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ }}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ 2NO}}\left( {\rm{g}} \right)\)
\({{\rm{K}}_{\rm{C}}} = \frac{{{{[{\rm{NO}}]}^2}}}{{[{{\rm{N}}_{\rm{2}}}][{{\rm{O}}_{\rm{2}}}]}}\)
→ Chọn B .
6.16
Cho các nhận định sau về cấu tạo phân tử nitric acid:
(a) Liên kết O–H phân cực về oxygen.
(b) Nguyên tử N có số oxi hoá là +5.
(c) Nguyên tử N có hoá trị bằng 4.
(d) Liên kết cho – nhận N→O kém bền.
Số nhận định đúng là
A. 1. B. 2. C. 3. D. 4.
Phương pháp giải:
Liên kết hoá học giữa các nguyên tử trong phân tử HNO 3 là liên kết cộng hóa trị và liên kết cho nhận.
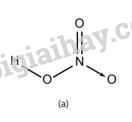
Hóa trị của một nguyên tố được xác định bằng số liên kết hóa học mà một nguyên tử của nguyên tố đó tạo nên trong phân tử.
Số oxi hóa của N trong HNO 3 là +5.
Lời giải chi tiết:
- Trong liên kết O-H, O có độ âm điện lớn hơn H nên liên kết này bị phân cực về phía oxygen.
- Số oxi hóa của N trong HNO 3 là +5.
- Nguyên tử N trong nitric acid tạo 4 liên kết, do đó nguyên tử N có hóa trị bằng 4.
- Liên kết cho – nhận N→O kém bền.
Số nhận định đúng là 4.
→ Chọn D .
6.17
Nitric acid dễ bị phân huỷ bởi ánh sáng hoặc nhiệt độ, tạo thành các sản phẩm là
A. NO 2 , H 2 O. B. NO 2 , O 2 , H 2 O. C. N 2 , O 2 , H 2 O. D. N 2 , H 2 O.
Phương pháp giải:
Dưới tác dụng của ánh sáng, nitric acid bị phân hủy tạo thành nitrogen dioxide (nhiệt độ thường)
\({\rm{4HN}}{{\rm{O}}_{\rm{3}}} \to {\rm{4N}}{{\rm{O}}_{\rm{2}}} \uparrow {\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O + }}{{\rm{O}}_{\rm{2}}} \uparrow \)
Lời giải chi tiết:
Nitric acid dễ bị phân huỷ bởi ánh sáng hoặc nhiệt độ, tạo thành các sản phẩm là NO 2 , O 2 , H 2 O.
→ Chọn B .
6.18
Để điều chế được silver nitrate từ một mẫu silver (bạc) tinh khiết, cần hoà tan mẫu silver vào dung dịch nào sau đây?
A. Cu(NO 3 ) 2 . B. HNO 3 . C. NaNO 3 . D. KNO 3 .
Phương pháp giải:
HNO 3 oxi hóa hầu hết các kim loại (trừ vàng (Au) và platin(Pt)).
Lời giải chi tiết:
Để điều chế được silver nitrate từ một mẫu silver (bạc) tinh khiết, cần hoà tan mẫu silver vào dung dịch HNO 3 .

→ Chọn B .
6.19
Trong công nghiệp, quá trình sản xuất Ca(NO 3 ) 2 dùng làm phân bón được thực hiện bằng phản ứng giữa dung dịch HNO 3 với hợp chất phổ biến, giá rẻ nào sau đây?
A. Cao. B. Ca(OH) 2 . C. CaCO 3 . D. CaSO 4 .
Phương pháp giải:
Calcium nitrate dùng làm phân bón được sản xuất từ đá vôi và nitric acid.
Lời giải chi tiết:
Trong công nghiệp, quá trình sản xuất Ca(NO 3 ) 2 dùng làm phân bón được thực hiện bằng phản ứng giữa dung dịch HNO 3 với hợp chất CaCO 3 .
\({\rm{2HN}}{{\rm{O}}_{\rm{3}}}{\rm{ + CaC}}{{\rm{O}}_{\rm{3}}} \to {\rm{Ca(N}}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O + C}}{{\rm{O}}_{\rm{2}}} \uparrow \)
→ Chọn C .
6.20
Cho dung dịch HNO 3 tác dụng với các chất sau: NH 3 , CaCO 3 , Ag, NaOH. Số phản ứng trong đó HNO 3 đóng vai trò acid Brønsted là?
A. 4. B. 1. C. 3. D. 2.
Phương pháp giải:
Theo thuyết acid, base của Bronsted – Lowry: Acid là chất cho H + (proton), base là chất nhận H + .
Lời giải chi tiết:
Phản ứng giữa Ag và HNO 3 là phản ứng oxi hóa khử.
Các phản ứng trong đó HNO 3 đóng vai trò là acid là:
\(\begin{array}{l}{\rm{2HN}}{{\rm{O}}_{\rm{3}}}{\rm{ + CaC}}{{\rm{O}}_{\rm{3}}}{\rm{ }} \to {\rm{ Ca(N}}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O + C}}{{\rm{O}}_{\rm{2}}}\\{\rm{N}}{{\rm{H}}_{\rm{3}}}{\rm{ + HN}}{{\rm{O}}_{\rm{3}}}{\rm{ }} \to {\rm{ N}}{{\rm{H}}_{\rm{4}}}{\rm{N}}{{\rm{O}}_{\rm{3}}}\\{\rm{NaOH + HN}}{{\rm{O}}_{\rm{3}}}{\rm{ }} \to {\rm{ NaN}}{{\rm{O}}_{\rm{3}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\end{array}\)
→ Chọn C .
6.21
a) Viết phương trình hoá học xảy ra khi cho dung dịch HNO 3 loãng lần lượt tác dụng với các chất: NaHCO 3 , Cu.
b) Trình bày phương pháp hoá học phân biệt ba dung dịch: HNO 3 , NaNO 3 , HCl.
Phương pháp giải:
a) Nitric acid thể hiện tính oxi hóa với các chất chứa các nguyên tố chưa có số oxi hóa cao nhất.
Nitric acid thể hiện tính acid với các chất chứa các nguyên tố có số oxi hóa cao nhất.
b) Quỳ tím làm acid hóa đỏ.
Nhận biết ion Cl - bằng ion Ag + .
Lời giải chi tiết:
a) Phương trình hóa học:
\(\begin{array}{l}{\rm{NaHC}}{{\rm{O}}_{\rm{3}}} + {\rm{HN}}{{\rm{O}}_{\rm{3}}} \to {\rm{NaN}}{{\rm{O}}_{\rm{3}}} + {\rm{C}}{{\rm{O}}_{\rm{2}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}}\\{\rm{3Cu}} + {\rm{8HN}}{{\rm{O}}_{\rm{3}}} \to {\rm{3Cu(N}}{{\rm{O}}_{\rm{3}}}{{\rm{)}}_{\rm{2}}} + 2{\rm{NO}} + 4{{\rm{H}}_{\rm{2}}}{\rm{O}}\end{array}\)
b) Sử dụng lần lượt hai thuốc thử là quỳ tím và dung dịch silver nitrate:
|
HNO 3 |
NaNO 3 |
HCl |
|
|
Quỳ tím |
Hóa đỏ |
Không hiện tượng |
Hoá đỏ |
|
AgNO 3 |
Không hiện tượng |
Kết tủa trắng |
Phương trình hóa học:
6.22
Xét các phản ứng tạo thành oxide của nitrogen:
\(\begin{array}{*{20}{l}}{{{\rm{N}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ }}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} \to {\rm{ 2NO}}\left( {\rm{g}} \right){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0{\rm{ = }}180,6{\rm{ kJ}}}\\{{\rm{2NO}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ }}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} \to {\rm{ 2NO}}\left( {\rm{g}} \right){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0{\rm{ = }} - 114,2{\rm{ kJ}}}\end{array}\)
a) Hãy cho biết phản ứng nào toả nhiệt, phản ứng nào thu nhiệt.
b) Hãy tính \({\Delta _{\rm{r}}}{\rm{H}}_{298}^0\) của phản ứng: \({{\rm{N}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ 2}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} \to {\rm{ 2N}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right)\)
Từ kết quả thu được, hãy tính \({\Delta _{\rm{f}}}{\rm{H}}_{298}^0\) của NO 2 (g).
Phương pháp giải:
a) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) > 0: Phản ứng thu nhiệt.
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) < 0: Phản ứng tỏa nhiệt.
b) Nhiệt phản ứng của \({{\rm{N}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ 2}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} \to {\rm{ 2N}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right)\) bằng tổng nhiệt phản ứng của hai phương trình trên.
Nhiệt tạo thành của đơn chất bằng 0.
Lời giải chi tiết:
a) Xét phản ứng: \({{\rm{N}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ }}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} \to {\rm{ 2NO}}\left( {\rm{g}} \right){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0{\rm{ = }}180,6{\rm{ kJ}}\)
Ta có: \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) > 0, do đó đây là phản ứng thu nhiệt.
Xét phản ứng: \({\rm{2NO}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ }}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} \to {\rm{ 2NO}}\left( {\rm{g}} \right){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0{\rm{ = }} - 114,2{\rm{ kJ}}\)
Ta có: \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) < 0, do đó đây là phản ứng tỏa nhiệt.
b) Ta thấy:
\(\begin{array}{l}{\rm{ }}{{\rm{N}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ }}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} \to {\rm{ 2NO}}\left( {\rm{g}} \right){\rm{ (1)}}\\ + \\{\rm{ }}\underline {{\rm{ 2NO}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ }}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} \to {\rm{ 2NO}}\left( {\rm{g}} \right){\rm{ (2)}}} \\{\rm{ }}{{\rm{N}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ 2}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} \to {\rm{ 2N}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ (3)}}\end{array}\)
\( \Rightarrow {\Delta _{\rm{r}}}{\rm{H}}{_{298}^0_{{\rm{ (3)}}}}{\rm{ = }}{\Delta _{\rm{r}}}{\rm{H}}{_{298}^0_{{\rm{ (1)}}}} + {\Delta _{\rm{r}}}{\rm{H}}{_{298}^0_{{\rm{ (2)}}}} = 180,6 + ( - 114,2) = 66,4{\rm{ (kJ)}}\)
Xét phản ứng (3):
\(\begin{array}{l} \Leftrightarrow 2{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(N}}{{\rm{O}}_{\rm{2}}}){\rm{ }} - [{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(}}{{\rm{N}}_{\rm{2}}}) + {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(}}{{\rm{O}}_{\rm{2}}})]{\rm{ = }}66,4\\ \Leftrightarrow 2{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(N}}{{\rm{O}}_{\rm{2}}}) - [0 + 0]{\rm{ = }}66,4\\ \Rightarrow {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(N}}{{\rm{O}}_{\rm{2}}}) = \frac{{66,4}}{2} = 33,2{\rm{ (kJ)}}\end{array}\)
6.23
Sử dụng các hoá chất, dụng cụ: dung dịch nitric acid 20%, cân, tủ hút khí độc, cốc, đũa thuỷ tinh, phễu lọc, giấy lọc. Trình bày các bước xác định gần đúng hàm lượng vàng (gold) có trong hợp kim Au-Ag, trong đó hàm lượng vàng < 30% về khối lượng. Viết các phương trình hoá học xảy ra.
Phương pháp giải:
HNO 3 oxi hóa hầu hết các kim loại (trừ vàng (Au) và platin(Pt)).
Lời giải chi tiết:
Bước 1: Cân hợp kim, ghi khối lượng m 1 .
Bước 2: Ngâm hợp kim vào cốc đựng dung dịch HNO 3 20% dư để hòa tan Ag, còn lại Au không tan (thực hiện trong tủ hút).
\(\begin{array}{l}{\rm{3Ag + 4HN}}{{\rm{O}}_{\rm{3}}}{\rm{ }} \to {\rm{ 3AgN}}{{\rm{O}}_{\rm{3}}}{\rm{ + NO + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\\{\rm{Ag + 2HN}}{{\rm{O}}_{\rm{3}}} \to {\rm{ AgN}}{{\rm{O}}_{\rm{3}}}{\rm{ + N}}{{\rm{O}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\end{array}\)
Bước 3: Lọc lấy phần chất rắn không tan, rửa và làm khô.
Bước 4: Cân khối lượng vàng thu được, ghi khối lượng m 2 , tính gần đúng hàm lượng vàng trong hợp kim theo công thức: \(\% {\rm{Au}} = \frac{{{{\rm{m}}_{\rm{2}}}}}{{{{\rm{m}}_{\rm{1}}}}} \times 100\% \)
6.24
Xét phản ứng: \({\rm{4N}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ }}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\left( {\rm{l}} \right){\rm{ }} \to {\rm{ 4HN}}{{\rm{O}}_{\rm{3}}}\left( {\rm{l}} \right)\)
Hãy tính \({\Delta _{\rm{r}}}{\rm{H}}_{298}^0\)của phản ứng và cho biết phản ứng là toả nhiệt hay thu nhiệt. (Biết nhiệt tạo thành của NO 2 (g), H 2 O(l) và HNO 3 (l) lần lượt là 33,2 kJ/mol, -285,8 kJ/mol vȧ-174,1 kJ/mol.)
Phương pháp giải:
Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo enthalpy tạo thành:
\({\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = \sum {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(sp)}} - \sum {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(tg) }}\)
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) > 0: Phản ứng thu nhiệt.
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) < 0: Phản ứng tỏa nhiệt.
Lời giải chi tiết:
\(\begin{array}{l}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = 4{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(HN}}{{\rm{O}}_{\rm{3}}}{\rm{)}} - [4{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(N}}{{\rm{O}}_{\rm{2}}}{\rm{) + }}{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(}}{{\rm{O}}_{\rm{2}}}{\rm{) + 2}}{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(}}{{\rm{H}}_{\rm{2}}}{\rm{O)]}}\\ = 4 \times ( - 174,1) - [4 \times 33,2 + 0 + 2 \times ( - 285,8)]\\ = - 257,6{\rm{ (kJ)}}\end{array}\)
Ta thấy: \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) < 0, do đó đây là phản ứng tỏa nhiệt.
6.25
Trong công nghiệp, nitric acid được sản xuất theo 3 giai đoạn của quá trình Ostwald.
Giai đoạn 1: Oxi hoá NH 3 thành NO.
Nung nóng hỗn hợp gồm 1 phần thể tích ammonia và 9 phần thể tích không khí tới nhiệt độ khoảng 900 °C (xúc tác Pt-Rh):
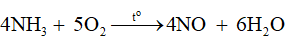
Giai đoạn 2: Oxi hoá NO thành NO 2 .
Dẫn hỗn hợp khi sau giai đoạn 1 qua hệ thống làm mát để hạ nhiệt độ: \({\rm{2NO }} + {\rm{ }}{{\rm{O}}_{\rm{2}}} \to {\rm{ 2N}}{{\rm{O}}_{\rm{2}}}\)
Giai đoạn 3: Tổng hợp nitric acid.
\({\rm{3N}}{{\rm{O}}_{\rm{2}}} + {\rm{ }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{ 2HN}}{{\rm{O}}_{\rm{3}}} + {\rm{ NO}}\)
Khí NO sinh ra ở giai đoạn 3 được dẫn quay về giai đoạn 2 của chu trình sản xuất.
a) Xác định chất khử, chất oxi hoá trong 3 giai đoạn sản xuất trên.
b) Tại sao ban đầu cần trộn ammonia với không khí theo tỉ lệ thể tích 1: 9? (Biết không khí chứa 21% thể tích oxygen.)
Phương pháp giải:
Phương pháp:
a) Trong phản ứng oxi hóa khử:
+ Chất khử là chất nhường electron, có số oxi hóa tăng sau phản ứng.
+ Chất oxi hóa là chất nhận electron, có số oxi hóa giảm sau phản ứng.
b) Viết và tìm hệ số phương trình tổ hợp chung của 3 giai đoạn (sao cho chất phản ứng chỉ còn chất phản ứng gồm NH 3 và O 2 ) để tìm tỉ lệ hệ số tỉ lượng giữa NH 3 và O 2 , từ đó suy ra được tỉ lệ giữa NH 3 và không khí.
Lời giải chi tiết:
