Bài 7. Sulfur và sulfur dioxide trang 26, 27, 28, 29, 30 SBT Hóa 11 Kết nối tri thức
Sulfur được dân gian sử dụng để pha chế vào thuốc trị các bệnh ngoài da. Tên gọi dân gian của sulfur là
7.1
Sulfur được dân gian sử dụng để pha chế vào thuốc trị các bệnh ngoài da. Tên gọi dân gian của sulfur là
A. diêm sinh. B. đá vôi. C. phèn chua. D. giấm ăn.
Phương pháp giải:
Tên gọi dân gian khác của sulfur là diêm sinh hay lưu hoàng hay lưu huỳnh.
Lời giải chi tiết:
Tên gọi dân gian khác của sulfur là diêm sinh.
→ Chọn A .
7.2
Trong tự nhiên, đồng vị của sulfur chiếm thành phần nhiều nhất là
A. 34 S. B. 32 S. C. 36 S. D. 33 S.
Phương pháp giải:
Sulfur (lưu huỳnh) là nguyên tố phổ biến thứ 17 trên vỏ Trái Đất, tồn tại ở 4 dạng đồng vị bền là 32 S, 33 S, 34 S và 36 S.
Lời giải chi tiết:
Trong tự nhiên, đồng vị của sulfur chiếm thành phần nhiều nhất là 32 S (≈ 95%).
→ Chọn B .
7.3
Thạch cao sống là một dạng tồn tại phổ biến của sulfur trong tự nhiên, được sử dụng làm nguyên liệu để sản xuất xi măng, phấn viết bảng,... Công thức của thạch cao sống là
A. BaSO 4 . B. CaSO 4 .2H 2 O.
C. MgSO 4 . D. CuSO 4 .5H 2 O.
Phương pháp giải:
Thạch cao sống có công thức CaSO 4 .2H 2 O, thạch cao nung có công thức CaSO 4 .0,5H 2 O.
Lời giải chi tiết:
Công thức của thạch cao sống là CaSO 4 .2H 2 O.
→ Chọn B .
7.4
Ở điều kiện thường, sulfur tồn tại ở dạng tinh thể, được tạo nên từ các phân tử sulfur. Số nguyên tử trong mỗi phân tử sulfur là
A.2. B. 4. C. 6. D. 8.
Phương pháp giải:
Phân tử sulfur gồm 8 nguyên tử (S 8 ) có dạng vòng khép kín, mỗi nguyên tử liên kết với 2 nguyên tử bên cạnh bằng 2 liên kết cộng hóa trị không phân cực.
Lời giải chi tiết:
Số nguyên tử trong mỗi phân tử sulfur là 8.
→ Chọn D .
7.5
Trong công nghiệp, phần lớn sulfur đơn chất sau khi khai thác ở các mỏ được dùng làm nguyên liệu để
A. lưu hoá cao su tự nhiên. B. sản xuất sulfuric acid.
C. điều chế thuốc bảo vệ thực vật. D. bảo chế thuốc đông y.
Phương pháp giải:
Ứng dụng: khoảng 90% lượng sulfur sản xuất được dùng để điều chế H 2 SO 4 còn lại được dùng để lưu hoá cao su, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo ebonit, dược phẩm, phẩm nhuộm, chất trừ sâu và chất diệt nấm trong nông nghiệp,...
Lời giải chi tiết:
Trong công nghiệp, khoảng 90% sulfur đơn chất sau khi khai thác ở các mỏ được dùng làm nguyên liệu để sản xuất sulfuric acid.
→ Chọn B .
7.6
Quá trình đốt than sinh ra nhiều loại khí thải, trong đó có khí SO 2 . Khí SO 2 mùi xốc và có khả năng gây viêm đường hô hấp. Tên gọi của SO 2 là
A. sulfur trioxide. B. sulfuric acid.
C. sulfur dioxide. D. hydrogen sulfide.
Phương pháp giải:
Quy tắc gọi tên oxide của phi kim có nhiều hóa trị:
(Tiền tố chỉ số nguyên tử của nguyên tố) Tên nguyên tố + (tiền tố chỉ số nguyên tử oxygen) oxide.
Với tiền tố mono là một, di là hai, tri là ba, tetra là bốn,…
Lời giải chi tiết:
Tên gọi của SO 2 là sulfur dioxide.
→ Chọn C .
7.7
Mưa acid tàn phá nhiều rừng cây, ăn mòn nhiều công trình kiến trúc bằng đá và kim loại. Tác nhân chính tạo ra mưa acid là
A. SO 2 . B. H 2 S. C. CO 2 . D. CO.
Phương pháp giải:
Tác nhân chính tạo ra mưa acid là các oxide của nitrogen (NO x ) và sulfur dioxide (SO 2 ).
Lời giải chi tiết:
Tác nhân chính tạo ra mưa acid là SO 2 .
→ Chọn A .
7.8
Trong số các chất khí: SO 2 , CO 2 , O 2 , N 2 khí tan tốt trong nước ở điều kiện thường là
A. O 2 . B. CO 2 . C. SO 2 . D. N 2 .
Phương pháp giải:
Sulfur dioxide là chất khí, không màu, mùi hắc, nặng hơn không khí, tan nhiều trong nước.
Lời giải chi tiết:
- Ở điều kiện thường:
+ O 2 . N 2 rất ít tan trong nước.
+ Độ tan của CO 2 là 0,15g/100 mL nước.
+ Độ tan của SO 2 là 94g/100 mL nước.
Trong số các chất khí: SO 2 , CO 2 , O 2 , N 2 khí tan tốt trong nước ở điều kiện thường là SO 2 .
→ Chọn C .
7.9
Sulfur đóng vai trò chất khử khi tác dụng với đơn chất nào sau đây?
A. Fe. B. O 2 . C. H 2 . D. Hg.
Phương pháp giải:
Sulfur đóng vai trò chất khử khi tác dụng với đơn chất có tính oxi hóa.
Lời giải chi tiết:
Vai trò của các chất trên khi phản ứng với sulfur:
+ Chất khử: Fe, H 2 , Hg.
+ Chất oxi hóa: O 2 .
Sulfur đóng vai trò chất khử khi tác dụng với đơn chất O 2 .
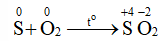
→ Chọn B .
7.10
Ở điều kiện thích hợp, sulfur dioxide đóng vai trò là chất oxi hoá khi tham gia phản ứng với chất nào sau đây?
A. NO 2 . B. H 2 S. C. NaOH. D. Ca(OH) 2 .
Phương pháp giải:
Sulfur dioxide đóng vai trò là chất oxi hoá khi tham gia phản ứng với chất khử.
Lời giải chi tiết:
Vai trò của các chất trên khi phản ứng với sulfur dioxide:
+ Chất khử: H 2 S.
+ Chất oxi hóa: NO 2 .
+ Base phản ứng với oxide acid (không thuộc phản ứng oxi hóa khử): NaOH, Ca(OH) 2 .
Sulfur dioxide đóng vai trò là chất oxi hoá khi tham gia phản ứng với H 2 S.
\(\mathop {\rm{S}}\limits^{ + 4} {{\rm{O}}_{\rm{2}}} + {{\rm{H}}_{\rm{2}}}\mathop {\rm{S}}\limits^{ - 2} \to \mathop {\rm{S}}\limits^0 + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
→ Chọn B .
7.11
Khi nhiệt kế thuỷ ngân vỡ, rắc chất bột nào sau đây lên thuỷ ngân rơi vãi sẽ chuyển hoá chúng thành hợp chất bền, ít độc hại?
A. Than đá. B. Đá vôi. C. Muối ăn. D. Sulfur.
Phương pháp giải:
Sulfur tác dụng với thủy ngân (mercury) ở ngay nhiệt độ thường: phản ứng này được dùng để xử lí mercury rơi vãi.
Hg + S → HgS
Lời giải chi tiết:
Khi nhiệt kế thuỷ ngân vỡ, rắc chất bột sulfur lên thuỷ ngân rơi vãi sẽ chuyển hoá chúng thành hợp chất bền, ít độc hại.
→ Chọn D .
7.12
Cho các loại khoáng vật sau: blend, chalcopyrite, thạch cao, pyrite. Số khoáng vật có thành phần chính chứa muối sulfide là
A.2. B. 4. C. 1. D.3.
Phương pháp giải:
Blend là một khoáng vật sulfide chứa các nguyên tố như chì, kẽm và đồng. Thành phần chính của blend là muối sulfide của các nguyên tố này.
Chalcopyrite cũng là một khoáng vật sulfide, chứa đồng và lưu huỳnh.
Thạch cao không chứa muối sulfide, mà là một khoáng vật sulfate.
Pyrite là một khoáng vật sulfide của sắt và lưu huỳnh.
Lời giải chi tiết:
Các khoáng vật có thành phần chính chứa muối sulfide là blend, chalcopyrite, pyrite.
→ Chọn D .
7.13

Phương pháp giải:
Trong phản ứng oxi hóa khử, chất khử là chất cho electron, có số oxi hóa tăng; chất oxi hóa là chất nhận electron, có số oxi hóa giảm.
Lời giải chi tiết:

7.14
Dẫn khí SO 2 vào 100 mL dung dịch KMnO 4 0,02 M đến khi mất màu tím theo sơ đồ phản ứng:
\({\rm{S}}{{\rm{O}}_{\rm{2}}}{\rm{ + KMn}}{{\rm{O}}_{\rm{4}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + MnS}}{{\rm{O}}_{\rm{4}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}\)
Thể tích khí SO 2 (đkc) đã phản ứng là
A. 50 mL. B. 248 mL. C. 124 mL. D. 100 mL
Phương pháp giải:
Cân bằng phương trình phản ứng trên rồi tìm số mol của SO 2 dựa vào KMnO 4 .
Tính thể tích theo công thức: \({\rm{V}} = {\rm{n}} \times 24,79\)
Lời giải chi tiết:
Ta có: \({{\rm{n}}_{{\rm{KMn}}{{\rm{O}}_{\rm{4}}}}} = 0,1 \times 0,02 = 0,002{\rm{ }}({\rm{mol}})\)
Xét phương trình hóa học: \({\rm{5S}}{{\rm{O}}_{\rm{2}}}{\rm{ + 2KMn}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {{\rm{K}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2MnS}}{{\rm{O}}_{\rm{4}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}\)
\({{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}} = \frac{5}{2} \times {{\rm{n}}_{{\rm{KMn}}{{\rm{O}}_{\rm{4}}}}} = \frac{5}{2} \times 0,002 = 0,005{\rm{ (mol)}}\)
\({{\rm{V}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}} = {\rm{0,005}} \times 24,79 \approx 0,124{\rm{ (L)}}\)
→ Chọn C .
7.15
Một bạn học sinh thu khí SO 2 vào bình tam giác và đậy miệng bình bằng bông tẩm dung dịch E (để giữ không cho khí SO 2 bay ra) theo sơ đồ bên.
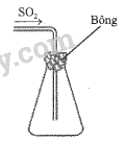
Theo em, để hiệu quả nhất, bạn học sinh cần sử dụng dung dịch E là dung dịch nào sau đây?
A. Giấm ăn. B. Muối ăn. C. Nước vôi. D. Nước má
Phương pháp giải:
Để ngăn khí SO 2 bay ra ngoài, ta cần một chất phản ứng được với SO 2 để tẩm vào bông.
SO 2 là một oxide acid, phản ứng được với dung dịch base.
Lời giải chi tiết:
Nước vôi phản ứng với SO 2 tạo thành hợp chất rắn CaSO 3 , ngăn SO 2 bay ra ngoài môi trường.
\({\rm{S}}{{\rm{O}}_{\rm{2}}} + {\rm{ Ca}}{\left( {{\rm{OH}}} \right)_{\rm{2}}} \to {\rm{ CaS}}{{\rm{O}}_{\rm{3}}} \downarrow {\rm{ }} + {\rm{ }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
→ Chọn C .
7.16
Sau khi điều chế, khí SO 2 có lẫn hơi nước được dẫn qua bình làm khô chứa các hạt chất rắn T rồi thu vào bình chứa theo hình vẽ sau:
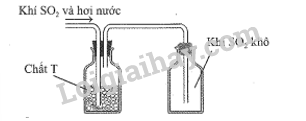
Chất T có thể là
A. KOH. B. NaOH. C. CaO. D.P 2 O 5 .
Phương pháp giải:
Chất T là chất hút được nước nhưng không phản ứng với SO 2 .
Lời giải chi tiết:
P 2 O 5 giữ lại hơi nước và không phản ứng với SO 2 do đó có tác dụng làm khô khí SO 2 .
→ Chọn D .
7.17
Xét phản ứng giữa sulfur và hydrogen ở điều kiện chuẩn:
\({{\rm{H}}_2}{\rm{(g)}} + \frac{1}{8}{{\rm{S}}_8}{\rm{(s)}} \to {{\rm{H}}_2}{\rm{S(g) }}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} = - 20,6{\rm{ kJ}}\)
Nhiệt tạo thành của H 2 S(g) là
A. -20,6 kJ/mol. B. -41,2 kJ/mol. C. 41,2 kJ/mol. D. 20,6 kJ/mol.
Phương pháp giải:
\[{\Delta _r}H_{298}^0 = \sum {\Delta _f}H_{298}^0(sp) - \sum {\Delta _f}H_{298}^0(tg)\]
Lời giải chi tiết:
\(\begin{array}{l}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} = {\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}({{\rm{H}}_2}{\rm{S}})\\ \Rightarrow {\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}({{\rm{H}}_2}{\rm{S}}) = - 20,6{\rm{ (kJ/mol)}}\end{array}\)
→ Chọn A .
7.18
Cho các ứng dụng sau:
(1) sản xuất sulfuric acid; (2) tẩy trắng bột giấy;
(3) diệt nấm mốc, thuốc đông y; (4) diệt trùng nước sinh hoạt.
Số ứng dụng của khí sulfur dioxide trong đời sống, sản xuất là
A. 1. B. 2. C. 3. D. 4.
Phương pháp giải:
Ứng dụng của sulfur dioxide:
- Dùng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc cho sản phẩm mây tre đan,...
- Là chất trung gian trong quá trình sản xuất sulfuric acid.
Lời giải chi tiết:
Ứng dụng của khí sulfur dioxide trong đời sống, sản xuất là:
(1) sản xuất sulfuric acid;
(2) tẩy trắng bột giấy;
(3) diệt nấm mốc, thuốc đông y.
→ Chọn C .
7.19
Sulfur và quặng pyrite sắt là các nguyên liệu chính trong công nghiệp sản xuất sulfuric acid.
Tại một nhà máy, cứ đốt cháy 1 tấn quặng pyrite sắt (chứa 84% khối lượng FeS 2 ) bằng không khí, thu được tối đa V m 3 khí SO 2 (đkc). Giá trị của V là
A. 173,5. B. 347,0. C. 86,8. D. 477,2.
Phương pháp giải:
\({\rm{4Fe}}{{\rm{S}}_2} + 11{{\rm{O}}_2} \to 2{\rm{F}}{{\rm{e}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}} + 8{\rm{S}}{{\rm{O}}_{\rm{2}}}\)
Tính thể tích theo công thức: \({\rm{V}} = {\rm{n}} \times 24,79\)
Lời giải chi tiết:
Ta có: \({{\rm{n}}_{{\rm{Fe}}{{\rm{S}}_{\rm{2}}}}} = \frac{{{{10}^6}}}{{120}} \times \frac{{84}}{{100}} = 7000{\rm{ (mol)}}\)
Xét phương trình hóa học: \({\rm{4Fe}}{{\rm{S}}_2} + 11{{\rm{O}}_2} \to 2{\rm{F}}{{\rm{e}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}} + 8{\rm{S}}{{\rm{O}}_{\rm{2}}}\)
\({{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}}{\rm{ = 2}}{{\rm{n}}_{{\rm{Fe}}{{\rm{S}}_{\rm{2}}}}} = 2 \times 7000{\rm{ = 14000 (mol)}}\)
\({{\rm{V}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}} = {\rm{14000}} \times 24,79 = 347060{\rm{ (L) }} \approx {\rm{ 347 (}}{{\rm{m}}^3})\)
→ Chọn B .
7.20
Phản ứng chuyển hóa hydrogen sulfide trong khí thiên nhiên thành sulfur được thực hiện theo sơ đồ phản ứng:
H 2 S + SO 2 → S + H 2 O
Khối lượng sulfur tối đa tạo ra khi chuyển hoá 1 000 m 3 khí thiên nhiên (đkc) (chứa 5 mg H 2 S/m 3 ) là
A. 10,0 g. B. 5,0 g. C. 7,06 g. D.100,0 g.
Phương pháp giải:
Tính khối lượng khí H 2 S từ 1 000 m 3 khí thiên nhiên. Từ đó, tính số mol của S từ H 2 S và sử dụng công thức:
\[{\rm{m}} = {\rm{M}} \times {\rm{n}}\]
Lời giải chi tiết:
Khối lượng H 2 S có trong 1 000 m 3 khí thiên nhiên: \({{\rm{m}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}}} = 1000 \times 5 \times {10^{ - 3}} = 5{\rm{ }}({\rm{g}})\)
\({{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}}} = \frac{5}{{34}} \approx {\rm{0,147 }}({\rm{mol}})\)
Phương trình hóa học: \({\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{S }} + {\rm{ S}}{{\rm{O}}_2} \to {\rm{ 3S }} + {\rm{ 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Ta có: \({{\rm{n}}_{\rm{S}}}{\rm{ = }}\frac{3}{2}{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}}} = \frac{3}{2} \times {\rm{0,147 = 0,2205 }}({\rm{mol}})\)
\({{\rm{m}}_{\rm{S}}}{\rm{ = 0,2205}} \times {\rm{32 = 7,056 }}({\rm{gam}})\)
→ Chọn C .
7.21
Sự phụ thuộc của độ tan khí sulfur dioxide trong nước vào nhiệt độ được mô tả ở đồ thị bên.
Dựa vào đồ thị, hãy ước tính:

a) Độ tan của sulfur dioxide ở 20 °C. Nhận xét về tính tan của sulfur dioxide ở nhiệt độ này.
b) Nồng độ phần trăm của dung dịch sulfur dioxide bão hoà ở 20 °C.
c) Nhiệt độ tại đó độ tan khí sulfur dioxide là 10 g trong 100 g nước.
Phương pháp giải:
Đồ thị trên biểu diễn độ tan của khí sulfur theo nhiệt độ (đơn vị g/1000g H 2 O).
Sử dụng công thức: \({\rm{C}}\% = \frac{{{{\rm{m}}_{{\rm{ct}}}}}}{{{{\rm{m}}_{{\rm{dd}}}}}} \times 100\% \)
Lời giải chi tiết:
a) Ở 20 o C, độ tan của sulfur dioxide khoảng 112 g SO 2 /1 kg nước.
Nhận xét: ở nhiệt độ này, sulfur dioxide tan tốt trong nước.
b) Nồng độ phần trăm của sulfur dioxide bão hòa:
\({\rm{C}}\% = \frac{{{{\rm{m}}_{{\rm{S}}{{\rm{O}}_2}}}}}{{{{\rm{m}}_{{\rm{dd S}}{{\rm{O}}_2}{\rm{ }}}}}} \times 100\% = \frac{{112}}{{1000 + 112}} \times 100\% \approx 10,1\% \)
c) Độ tan của khí sulfur dioxide là 10 g trong 100 g nước (hay độ tan của khí sulfur dioxide là 100 g trong 1000 g nước)
\( \Rightarrow \)Ở 23 o C, độ tan độ tan khí sulfur dioxide là 10 g trong 100 g nước.
7.22
Phản ứng oxi hoá SO 2 là giai đoạn then chốt trong quá trình sản xuất H 2 SO 4 :
\({\rm{S}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ }}\frac{1}{2}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ S}}{{\rm{O}}_{\rm{3}}}\left( {\rm{g}} \right){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0{\rm{ = }} - {\rm{99,2 kJ}}\)
a) Viết biểu thức tính hằng số cân bằng K C của phản ứng.
b) Hãy cho biết phản ứng trên là toả nhiệt hay thu nhiệt.
c) Trong thực tế, phản ứng được thực hiện ở khoảng 450 °C. Tại sao không thực hiện phản ứng ở 25 °C hoặc 600 °C?
Phương pháp giải:
a) Tổng quát, nếu có phản ứng thuận nghịch sau: aA+bB \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \({{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\)
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học.
b) \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) > 0: Phản ứng thu nhiệt.
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) < 0: Phản ứng tỏa nhiệt.
c) Nhiệt độ ảnh hưởng tới tốc độ phản ứng (nhiệt độ cao, tốc độ phản ứng lớn).
Nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
Chất xúc tác không làm chuyển dịch cân bằng.
Lời giải chi tiết:
a) Biểu thức tính hằng số cân bằng K C của phản ứng:
\({{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{\rm{[S}}{{\rm{O}}_{\rm{3}}}{\rm{]}}}}{{{\rm{[S}}{{\rm{O}}_{\rm{2}}}{\rm{][}}{{\rm{O}}_{\rm{2}}}{{\rm{]}}^{\frac{1}{2}}}}}\)
b) Ta có: \({\Delta _{\rm{r}}}{\rm{H}}_{298}^0{\rm{ = }} - {\rm{99,2 kJ}}\)< 0
Phản ứng trên là phản ứng tỏa nhiệt.
c) Theo nguyên lí chuyển dịch cân bằng Le Chatelier, để cân bằng chuyển dịch theo chiều thuận, ta cần giảm nhiệt độ. Nhưng khi thực hiện phản ứng ở nhiệt độ 25 °C, tốc độ phản ứng nhỏ, hiệu suất giảm. Còn khi thực hiện phản ứng ở nhiệt độ 600 °C, cân bằng chuyển dịch theo chiều nghịch, hiệu suất giảm. Vậy nên trong thực tế, phản ứng được thực hiện ở khoảng 450 °C.
7.23
Xét phản ứng giữa NO 2 và SO 2 trong không khí ô nhiễm sulfur dioxide:
\({\rm{N}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ S}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} \to {\rm{ NO}}\left( {\rm{g}} \right){\rm{ }} + {\rm{ S}}{{\rm{O}}_{\rm{3}}}\left( {\rm{g}} \right)\)
Tính biến thiên enthalpy của phản ứng và cho biết phản ứng trên là toả nhiệt hay thu nhiệt. (Biết nhiệt tạo thành của NO 2 (g), SO 2 (g), NO(g) và SO 3 (g) lần lượt là 33,2 kJ/mol, –296,8 kJ/mol, 91,3 kJ/mol và –395,7 kJ/mol.)
Phương pháp giải:
\({\Delta _r}H_{298}^0 = \sum {\Delta _f}H_{298}^0(sp) - \sum {\Delta _f}H_{298}^0(c\~n )\)
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) > 0: Phản ứng thu nhiệt.
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) < 0: Phản ứng tỏa nhiệt.
Lời giải chi tiết:
\(\begin{array}{l}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} = {\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}({\rm{NO}}) + {\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}({\rm{S}}{{\rm{O}}_{\rm{3}}}) - [{\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}({\rm{N}}{{\rm{O}}_{\rm{2}}}) + {\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}({\rm{S}}{{\rm{O}}_{\rm{2}}})]\\{\rm{ }} = 91,3 + ( - 395,7) - [33,2 + ( - 296,8)]\\{\rm{ = }} - 40,8{\rm{ (kJ)}}\end{array}\)
Ta thấy: \({\Delta _{\rm{r}}}{\rm{H}}_{298}^0{\rm{ = }} - {\rm{40,8 kJ}}\)< 0
Phản ứng trên là phản ứng tỏa nhiệt.
7.24
Hỗn hợp X gồm SO 2 và O 2 có tỉ khối so với H 2 bằng 24. Nung nóng X trong bình kín chứa xúc tác V 2 O 5 , thu được hỗn hợp khí Y có tỉ khối so với H 2 bằng 30. Viết phương trình hoá học và tính hiệu suất của phản ứng oxi hóa SO 2 thành SO 3 .
Phương pháp giải:
Sử dụng công thức: \({\rm{H}} = \frac{{{{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}{\rm{ p/u}}}}}}{{{{\rm{n}}_{{\rm{S}}{{\rm{O}}_2}{\rm{ bd}}}}}} \times 100\% \)
Lời giải chi tiết:
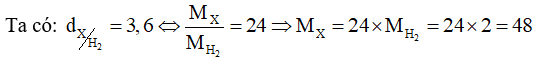
\( \Leftrightarrow \frac{{64{{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}} + 32{{\rm{n}}_{{{\rm{O}}_{\rm{2}}}}}}}{{{{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}} + {{\rm{n}}_{{{\rm{O}}_{\rm{2}}}}}}} = 48 \Rightarrow 16{{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}} = 16{{\rm{n}}_{{{\rm{O}}_{\rm{2}}}}} \Leftrightarrow \frac{{{{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}}}}{{{{\rm{n}}_{{{\rm{O}}_{\rm{2}}}}}}} = \frac{1}{1}\)
Hỗn hợp X gồm SO 2 và O 2 có tỉ lệ mol tương ứng là 1 : 1.
Chọn \({{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}} = 1{\rm{ (mol)}};{\rm{ }}{{\rm{n}}_{{{\rm{O}}_{\rm{2}}}}} = 1{\rm{ }}({\rm{mol}})\)
\( \Rightarrow \)\({{\rm{m}}_{\rm{X}}}{\rm{ = }}{{\rm{m}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}} + {{\rm{m}}_{{{\rm{O}}_{\rm{2}}}}} = 1 \times 64 + 1 \times 32 = 96{\rm{ }}({\rm{gam}})\)
Bảo toàn khối lượng, ta có:

7.25
Tại nhiều làng nghề thủ công mĩ nghệ, sulfur dioxide được dùng là chất chống mốc cho các sản phẩm mây tre đan.
Trong một ngày, một làng nghề đốt cháy 20 kg sulfur để tạo thành sulfur dioxide.
a) Viết phương trình hoá học và tính thể tích khí SO 2 (đkc) tối đa tạo ra?
b) Giả thiết có 20% lượng khí SO 2 trên bay vào khí quyển và chuyển hoá hết thành H 2 SO 4 trong nước mưa theo sơ đồ:
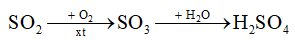
– Viết các phương trình hoá học theo sơ đồ trên.
– Tính thể tích nước mưa bị nhiễm acid nếu nồng độ H 2 SO 4 trong nước mưa là 1,25.10 -5 M.
Phương pháp giải:
a) Tính thể tích khí theo công thức: \({\rm{V}} = {\rm{n}} \times 24,79\)
b) Tính thể tích nước mưa bị nhiễm acid theo công thức: \({\rm{V}} = \frac{{\rm{n}}}{{{{\rm{C}}_{\rm{M}}}}}\)
Lời giải chi tiết:
