Bài 9. Ôn tập chương 2 trang 34, 35, 36, 37 SBT Hóa 11 Kết nối tri thức
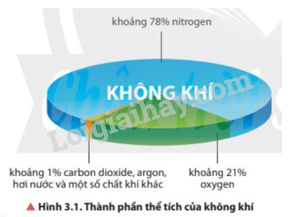
Trong khí quyển Trái Đất, phần trăm thể tích khí nitrogen chiếm là A. 21%. B. 11%. C. 78%. D. 28%.
9.1
Trong khí quyển Trái Đất, phần trăm thể tích khí nitrogen chiếm là
A. 21%. B. 11%. C. 78%. D. 28%.
Phương pháp giải:
Lời giải chi tiết:
Lời giải chi tiết:
Trong khí quyển Trái Đất, phần trăm thể tích khí nitrogen chiếm là 78%.
→ Chọn C .
9.2
Chất nào sau đây được sử dụng là chất làm lạnh trong các hệ thống làm lạnh công nghiệp?
A. N 2 . B. NH 3 . C. SO 2 . D. S.
Phương pháp giải:
Ứng dụng của ammonia: Ammonia được sử dụng để sản xuất nitric acid, các loại phân đạm. Ammonia còn được sử dụng làm chất làm lạnh, làm dung môi và nhiều ứng dụng quan trọng khác trong đời sống và sản xuất.
Lời giải chi tiết:
NH 3 được sử dụng là chất làm lạnh trong các hệ thống làm lạnh công nghiệp.
→ Chọn B .
9.3
Mưa acid là một thảm hoạ thiên nhiên toàn cầu, ảnh hưởng đến sự sống của các sinh vật. Mưa acid là hiện tượng nước mưa có
A. < 5,6. B. = 7. C. 6 - 7. D. > 8.
Phương pháp giải:
Khi các khí sulfur dioxide, nitrogen dioxide bị oxi hóa và bị hòa tan trong nước tạo thành dung dịch acid HNO 3 và H 2 SO 4 , làm nước mưa có độ pH < 5,6, gây nên mưa acid.
Lời giải chi tiết:
Mưa acid là hiện tượng nước mưa có pH < 5,6.
→ Chọn A .
9.4
Quá trình đốt cháy hồn hợp hơi nhiên liệu và không khí trong động cơ khi đánh tia lửa điện sinh ra khí NO, một tác nhân gây ô nhiễm không khí. Tên gọi của NO là
A. ammonia. B. nitrogen dioxide.
C. nitrogen monoxide. D. nitrogen.
Phương pháp giải:
Quy tắc gọi tên oxide của phi kim có nhiều hóa trị:
(Tiền tố chỉ số nguyên tử của nguyên tố) Tên nguyên tố + (tiền tố chỉ số nguyên tử oxygen) oxide.
Với tiền tố mono là một, di là hai, tri là ba, tetra là bốn,…
Lời giải chi tiết:
Tên gọi của NO là nitrogen monoxide.
→ Chọn C .
9.5
Oxide X là chất khí, mùi hắc, độc (gây ho, viêm đường hô hấp). Trong công nghiệp, X được dùng làm chất tẩy trắng bột gỗ, sản xuất sulfuric acid. Công thức của X là
A. CO 2 . B. H 2 S. C. SO 2 . D. P 2 O 5 .
Phương pháp giải:
Ứng dụng của sulfur dioxide:
- Dùng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc cho sản phẩm mây tre đan,...
- Là chất trung gian trong quá trình sản xuất sulfuric acid.
Lời giải chi tiết:
Công thức của X là SO 2 .
→ Chọn C .
9.6
Nhỏ 1 giọt dung dịch acid đặc nào sau đây lên tờ giấy trắng thì tờ giấy bị hoá đen ở chỗ tiếp xúc với acid?
A. HBr. B. HCl. C. HNO 3 . D. H 2 SO 4 .
Phương pháp giải:
Tính háo nước: Dung dịch sulfuric acid đặc có khả năng lấy nước từ hợp chất carbohydrate và khiến chúng hoá đen (hiện tượng than hoá).
Lời giải chi tiết:
Giấy là hợp chất carbohydrate, do đó khi nhỏ 1 giọt dung dịch acid H 2 SO 4 đặc lên tờ giấy trắng thì tờ giấy bị hoá đen ở chỗ tiếp xúc với acid.
→ Chọn D .
9.7
Dung dịch loãng của acid nào sau đây hoà tan được lá bạc, tạo thành muối tương ứng?
A. HNO 3 . B. HCl. C. H 3 PO 4 . D. H 2 SO 4 .
Phương pháp giải:
HCl, H 3 PO 4 , H 2 SO 4 phản ứng được với các kim loại đứng trước H trong dãy hoạt động hóa học của kim loại.
HNO 3 oxi hóa được hầu hết các kim loại trừ Au, Pt.
Lời giải chi tiết:
Ag là kim loại đứng sau H trong dãy hoạt động hóa học của kim loại, do đó Ag không phản ứng được với các dung dịch acid HCl, H 3 PO 4 , H 2 SO 4 loãng.
HNO 3 oxi hóa được Ag, tạo thành muối AgNO 3 : \({\rm{3Ag + 4HN}}{{\rm{O}}_{\rm{3}}}{\rm{ }} \to {\rm{ 3AgN}}{{\rm{O}}_{\rm{3}}}{\rm{ + NO + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\)
→ Chọn A .
9.8
Trong công nghiệp, quặng pyrite sắt (FeS 2 ) được dùng làm nguyên liệu để
A. luyện gang. B. sản xuất sulfuric acid.
C. chế tạo nam châm điện. D. tổng hợp dược phẩm.
Phương pháp giải:
Quặng pyrite sắt (FeS 2 ) được dùng để sản xuất sulfur dioxide trong quy trình sản xuất sulfuric acid.
Lời giải chi tiết:
Trong công nghiệp, quặng pyrite sắt (FeS 2 ) được dùng làm nguyên liệu để sản xuất sulfuric acid.
→ Chọn B .
9.9
Khí nào sau đây tan trong nước thu được dung dịch có khả năng làm phenolphthalein chuyển màu hồng?
A. Nitrogen. B. Ammonia.
C. Sulfur dioxide. D. Hydrogen chloride.
Phương pháp giải:
Dung dịch có môi trường base làm phenolphthalein chuyển màu hồng.
Lời giải chi tiết:
Khí ammonia khi tan trong nước tạo dung dịch có môi trường base làm phenolphthalein chuyển màu hồng.
\({\rm{N}}{{\rm{H}}_{\rm{3}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{NH}}_{\rm{4}}^{\rm{ + }}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}}\)
→ Chọn B .
9.10
Trong công nghiệp thực phẩm, nitrogen lỏng (D = 0,808 g/mL) được phun vào vỏ bao bì trước khi đóng nắp để làm căng vỏ bao bì. Thể tích khí nitrogen thu được (đkc) khi hoá hơi 1 mL nitrogen lỏng là
A. 646,4 mL. B. 808,0 mL. C. 715,4 mL. D. 1095,7 mL.
Phương pháp giải:
Sử dụng các công thức: \({\rm{m}} = {\rm{D}}{\rm{.V}};{\rm{n}} = \frac{{\rm{m}}}{{\rm{M}}};{\rm{V}} = {\rm{n}}{\rm{.24,79}}\)
Lời giải chi tiết:
Khối lượng của 1 mL nitrogen lỏng: \({{\rm{m}}_{{{\rm{N}}_{\rm{2}}}}} = 0,808 \times 1 = 0,808{\rm{ (g)}}\)
Số mol của 1 mL nitrogen lỏng: \({{\rm{n}}_{{{\rm{N}}_{\rm{2}}}}} = \frac{{0,808}}{{{\rm{28}}}}{\rm{(mol)}}\)
Thể tích khí nitrogen thu được (đkc) khi hoá hơi 1 mL nitrogen lỏng:
\({{\rm{V}}_{{{\rm{N}}_{\rm{2}}}}} = \frac{{0,808}}{{28}} \times 24,79 \approx 0,7154{\rm{ (L) = 715,4 (mL)}}\)
→ Chọn C .
9.11
Cho cân bằng hoá học sau: \({{\rm{N}}_{\rm{2}}}{\rm{(g)}} + {\rm{3}}{{\rm{H}}_{\rm{2}}}{\rm{(g)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{2N}}{{\rm{H}}_{\rm{3}}}{\rm{(g) }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 < 0\)
Tổng số mol của hỗn hợp khí khi hệ đạt cân bằng ở nhiệt độ 400 °C và 500 °C lần lượt bằng x và y. Mối quan hệ giữa x và y là
A. x > y. B. x = y. C. x <y. D. 5x = 4y.
Phương pháp giải:
Nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
Lời giải chi tiết:
Hiệu suất phản ứng khi hệ đạt cân bằng ở nhiệt độ 400 °C là x%.
Hiệu suất phản ứng khi hệ đạt cân bằng ở nhiệt độ 500 °C là y%.
Khi tăng nhiệt độ (từ 400 °C lên 500 °C), cân bằng chuyển dịch theo chiều làm giảm nhiệt độ (tức là chiều thu nhiệt), cân bằng chuyển dịch theo chiều nghịch.
Hiệu suất của hai phản ứng ở 400 °C và 500 °C là hiệu suất của phản ứng thuận, Do đó, hiệu suất ở 500 °C nhỏ hơn hiệu suất ở 400 °C.
Vậy y < x hay x > y.
→ Chọn A .
9.12
Cho một ít tinh thể muối X vào ống nghiệm và đun nóng trên ngọn lửa đèn cồn, sau một thời gian thấy không còn chất rắn nào ở đáy ống nghiệm. Muối X có thể là muối nào sau đây?
A. NaCl. B. CaCO 3 . C. KClO 3 . D. NH 4 Cl.
Phương pháp giải:
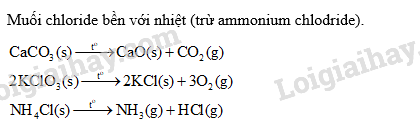
Lời giải chi tiết:
Muối X là NH 4 Cl. Sau một thời gian đun nóng, NH 4 Cl bị phân hủy hết tạo thành NH 3 và HCl ở dạng hơi.
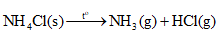
→ Chọn D .
9.13
Cho các chất sau: H 2 SO 4 , SO 2 , N 2 , NH 3 .
Số chất tan tốt trong nước ở điều kiện thường là
A. 4. B. 1. C. 3. D. 4.
Phương pháp giải:
N 2 tan rất ít trong nước.
H 2 SO 4 , SO 2 , NH 3 : tan nhiều trong nước.
Lời giải chi tiết:
Các chất tan tốt trong nước ở điều kiện thường là H 2 SO 4 , SO 2 , NH 3 .
→ Chọn C .
9.14
Trong phản ứng giữa khí ammonia và khí hydrogen chloride tạo thành ammonium chloride ở dạng khói trắng, ammonia đóng vai trò là
A. acid. B. base. C. chất oxi hoá. D. chất khử.
Phương pháp giải:
Theo thuyết acid, base của Bronsted – Lowry: Acid là chất cho H + (proton), base là chất nhận H + .
Lời giải chi tiết:
Trong phản ứng giữa khí ammonia và khí hydrogen chloride tạo thành ammonium chloride ở dạng khói trắng, ammonia nhận proton nên ammonia đóng vai trò là base.
NH 3 + HCl → NH 4 Cl
→ Chọn B .
9.15
Cho các acid ở dạng đậm đặc sau: HCl, HNO 3 , H 3 PO 4 , H 2 SO 4 .
Số acid vừa có tính acid mạnh, vừa có tính oxi hoá mạnh là
A. 1. B. 4. C. 3. D. 2.
Phương pháp giải:
Nitric acid và sulfuric acid đặc có tính acid mạnh và oxi hóa mạnh.
Lời giải chi tiết:
Các acid vừa có tính acid mạnh, vừa có tính oxi hoá mạnh: HNO 3 , H 2 SO 4 đặc.
→ Chọn D .
9.16
Tiến hành các thí nghiệm cho dung dịch H 2 SO 4 loãng lần lượt tác dụng với: Mg, NaHCO 3 , BaCl 2 , CaCO 3 . Số thí nghiệm xảy ra phản ứng oxi hoá – khử là
A. 1. B. 2. C. 3. D. 4.
Phương pháp giải:
Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời quá trình quá trình nhường electron và quá trình nhận electron.
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Lời giải chi tiết:
Thí nghiệm xảy ra phản ứng oxi hoá – khử là: \(\mathop {{\rm{Mg}}}\limits^0 {\rm{ }} + {\rm{ }}{\mathop {\rm{H}}\limits^{ + 1} _{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} \to {\rm{ }}\mathop {{\rm{Mg}}}\limits^{ + 2} {\rm{S}}{{\rm{O}}_{\rm{4}}} + {\rm{ }}{\mathop {\rm{H}}\limits^0 _{\rm{2}}}\)
→ Chọn A .
9.17
Cho các chất khí sau: H 2 S, NO, NO 2 , SO 2 .
Số khí gây ô nhiễm môi trường khi phát thải vào không khí là
A. 1. B. 4. C. 3. D. 2.
Phương pháp giải:
Khí gây ô nhiễm môi trường là những khí gây hại đến sức khỏe con người và tác động xấu đến môi trường.
Lời giải chi tiết:
Các khí gây ô nhiễm môi trường khi phát thải vào không khí là H 2 S, NO, NO 2 , SO 2 .
→ Chọn B .
9.18
Cho cân bằng hoá học sau:
\({\rm{2S}}{{\rm{O}}_{\rm{2}}}{\rm{(g)}} + {{\rm{O}}_{\rm{2}}}{\rm{(g)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{2S}}{{\rm{O}}_{\rm{3}}}{\rm{(g) }}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} < 0\)
Khi tăng nhiệt độ,
A. tổng số mol khí trong hệ giảm.
B. hiệu suất phản ứng tăng.
C. cân bằng chuyển dịch theo chiều nghịch.
D. nồng độ khí sản phẩm tăng.
Phương pháp giải:
Nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
Lời giải chi tiết:
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ (chiều thu nhiệt), cân bằng chuyển dịch theo chiều nghịch. Lúc này, tổng số mol khí trong hệ tăng, hiệu suất phản ứng giảm, nồng độ sản phẩm giảm.
→ Chọn C .
9.19
Một nhà máy luyện kim, ở giai đoạn đầu của quá trình sản xuất Zn từ quặng blend thu được sản phẩm phụ là SO 2 theo sơ đồ phản ứng: \({\rm{ZnS}} + {{\rm{O}}_{\rm{2}}} \to {\rm{ZnO}} + {\rm{S}}{{\rm{O}}_{\rm{2}}}\)
Đốt cháy 1 tấn quặng blend (chứa 77,6% khối lượng ZnS) bằng không khí, thu được tối đa V m 3 khí SO 2 (đkc). Giá trị của V là
A. 99,2. B. 198,3. C. 297,5. D. 396,6.
Phương pháp giải:
Khi hỏi thể tích khí tối đa thu được, coi hiệu suất phản ứng là 100%.
Tính thể tích khí theo công thức: \({\rm{V}} = {\rm{n}} \times 24,79\)
Lời giải chi tiết:
Ta có: \({{\rm{m}}_{{\rm{ZnS}}}} = {10^6} \times \frac{{77,6}}{{100}} = 77,6 \times {10^4}{\rm{ (g)}} \Rightarrow {{\rm{n}}_{{\rm{ZnS}}}} = \frac{{77,6 \times {{10}^4}}}{{65 + 32}} = 8000{\rm{ (mol)}}\)
Xét phương trình hóa học: \({\rm{ZnS}} + {{\rm{O}}_{\rm{2}}} \to {\rm{ZnO}} + {\rm{S}}{{\rm{O}}_{\rm{2}}}\)
\(\begin{array}{l} \Rightarrow {{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}}{\rm{ = }}{{\rm{n}}_{{\rm{ZnS}}}} = 8000{\rm{ (mol)}}\\ \Rightarrow {{\rm{V}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}} = 8000 \times 24,79 = 198320{\rm{ (L) = 198,32 (}}{{\rm{m}}^3})\end{array}\)
→ Chọn B .
9.20
Cho cân bằng hoá học sau: \({\rm{2N}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ }}{{\rm{N}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}\left( {\rm{g}} \right){\rm{ }}\)
a) Hãy tính \({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\)của phản ứng, cho nhiệt tạo thành của NO 2 (g) và N 2 O 4 (g) lần lượt là 33,2 kJ/mol và 11,1 kJ/mol.
b) Cân bằng sẽ chuyển dịch theo chiều nào khi giảm nhiệt độ của hệ?
Phương pháp giải:
a) \({\Delta _r}H_{298}^0 = \sum {\Delta _f}H_{298}^0(sp) - \sum {\Delta _f}H_{298}^0(cd)\)
b) Nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó
Lời giải chi tiết:
a) Nhiệt của phản ứng \({\rm{2N}}{{\rm{O}}_{\rm{2}}}\left( {\rm{g}} \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ }}{{\rm{N}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}\left( {\rm{g}} \right){\rm{ }}\)
\(\begin{array}{l}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} = {\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}{\rm{(}}{{\rm{N}}_{\rm{2}}}{{\rm{O}}_{\rm{4}}}) - 2{\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}{\rm{(N}}{{\rm{O}}_{\rm{2}}})\\{\rm{ = }}11,1 - 2 \times 33,2\\{\rm{ = }} - {\rm{53,3 (kJ)}}\end{array}\)
b) Khi giảm nhiệt độ của hệ, cân bằng chuyển dịch theo chiều làm tăng nhiệt độ (chiều tỏa nhiệt), cân bằng chuyển dịch theo chiều thuận.
9.21
Hoà tan 3,92 g một muối X ngậm nước vào cốc nước, thu được 100 mL dung dịch X gồm các ion: \({\rm{F}}{{\rm{e}}^{2 + }},{\rm{ NH}}_4^ + \)và \({\rm{SO}}_4^{2 - }\). Cho dung dịch NaOH dư vào 20 mL dung dịch X, đun nóng, thu được 49,58 mL khí (đkc). Cho dung dịch BaCl 2 dư vào 20 mL dung dịch X, thu được 0,466 g kết tủa. Xác định công thức của X.
Phương pháp giải:
Áp dụng định luật bảo toàn điện tích để tìm nồng độ mol mỗi loại ion trong dung dịch X. Rồi suy ra công thức của X dựa vào tỉ lệ mol của các ion
Lời giải chi tiết:
Khi cho dung dịch NaOH dư vào 20 mL dung dịch X, khí thoát ra là NH 3 .
\({\rm{NH}}_4^ + + {\rm{O}}{{\rm{H}}^ - } \to {\rm{N}}{{\rm{H}}_{\rm{3}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
\({{\rm{n}}_{{\rm{N}}{{\rm{H}}_{\rm{3}}}}} = \frac{{0,04958}}{{24,79}} = 0,002{\rm{ (mol)}} \Rightarrow {{\rm{n}}_{{\rm{NH}}_4^ + }} = {{\rm{n}}_{{\rm{N}}{{\rm{H}}_{\rm{3}}}}} = 0,002{\rm{ (mol)}}\)
Khi cho dung dịch BaCl 2 dư vào ống nghiệm thu được kết tủa là BaSO 4 .
\({\rm{B}}{{\rm{a}}^{2 + }} + {\rm{SO}}_4^{2 - } \to {\rm{BaS}}{{\rm{O}}_{\rm{4}}}\)
\({{\rm{n}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}} = \frac{{0,466}}{{233}} = 0,002{\rm{ (mol)}} \Rightarrow {{\rm{n}}_{{\rm{SO}}_4^{2 - }}} = {{\rm{n}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}} = 0,002{\rm{ (mol)}}\)
Áp dụng định luật bảo toàn điện tích trong dung dịch X:
\(\begin{array}{l}{\rm{2}}{{\rm{n}}_{{\rm{F}}{{\rm{e}}^{2 + }}}} + {{\rm{n}}_{{\rm{NH}}_4^ + }} = {\rm{2}}{{\rm{n}}_{{\rm{SO}}_4^{2 - }}}\\ \Rightarrow {{\rm{n}}_{{\rm{F}}{{\rm{e}}^{2 + }}}} = \frac{{{\rm{2}}{{\rm{n}}_{{\rm{SO}}_4^{2 - }}} - {{\rm{n}}_{{\rm{NH}}_4^ + }}}}{2}\\{\rm{ = }}\frac{{{\rm{2}} \times {\rm{0,002 - }}0,002}}{2} = 0,001{\rm{ (mol)}}\end{array}\)
Ta có: \({{\rm{n}}_{{\rm{NH}}_4^ + }}:{{\rm{n}}_{{\rm{F}}{{\rm{e}}^{2 + }}}}:{{\rm{n}}_{{\rm{SO}}_4^{2 - }}} = 0,002:0,001:0,002 = 2:1:2\)
\( \Rightarrow \) Công thức của X là: \({{\rm{(N}}{{\rm{H}}_{\rm{4}}}{\rm{)}}_{\rm{2}}}{\rm{Fe(S}}{{\rm{O}}_{\rm{4}}}{{\rm{)}}_{\rm{2}}}\)
9.22
Cho phản ứng sau: \({{\rm{H}}_2}{\rm{(g)}} + \frac{1}{8}{{\rm{S}}_8}{\rm{(g)}} \to {{\rm{H}}_2}{\rm{S(g) }}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} = ?\)
Hãy xác định:
a) Biến thiên enthalpy\({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\)của phản ứng, cho nhiệt tạo thành chuẩn của S 8 (g) và H 2 S(g) lần lượt là 101,3 kJ/mol và -20,6 kJ/mol.
b) Năng lượng liên kết S-S trong phân tử S 8 (g), biết E b(H-H) = 436 kJ/mol và E b(S-H) = 363 kJ/mol.
Phương pháp giải:
Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo enthalpy tạo thành:
\({\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = \sum {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(sp)}} - \sum {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(cd) }}\)
Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo năng lượng liên kết (các chất đều ở thể khí) là:
\({\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = \sum {{\rm{E}}_{\rm{b}}}{\rm{(cd) }} - \sum {{\rm{E}}_{\rm{b}}}{\rm{(sp) }}\)
Lời giải chi tiết:
a) Biến thiên enthalpy\({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\)của phản ứng \({{\rm{H}}_2}{\rm{(g)}} + \frac{1}{8}{{\rm{S}}_8}{\rm{(g)}} \to {{\rm{H}}_2}{\rm{S(g) }}\)
\(\begin{array}{l}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} = {\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}{\rm{(}}{{\rm{H}}_2}{\rm{S}}) - \left[ {\frac{1}{8}{\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}{\rm{(}}{{\rm{S}}_8}) + {\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}{\rm{(}}{{\rm{H}}_2})} \right]\\{\rm{ = }} - 20,6 - \left[ {\frac{1}{8} \times 101,3 + 0} \right]\\{\rm{ }} \approx {\rm{ }} - 33,3{\rm{ (kJ)}}\end{array}\)
b) Ta có: \({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} = \frac{1}{8}{{\rm{E}}_{\rm{b}}}{\rm{(}}{{\rm{S}}_8}) + {{\rm{E}}_{\rm{b}}}{\rm{(}}{{\rm{H}}_2}) - {{\rm{E}}_{\rm{b}}}{\rm{(}}{{\rm{H}}_2}{\rm{S}})\)
\(\begin{array}{l} \Leftrightarrow - 33,3 = \frac{1}{8} \times 8 \times {{\rm{E}}_{{\rm{b (S - S)}}}} + {{\rm{E}}_{{\rm{b (H - H)}}}} - 2 \times {{\rm{E}}_{{\rm{b (H - S)}}}}\\ \Leftrightarrow - 33,3 = \frac{1}{8} \times 8 \times {{\rm{E}}_{{\rm{b (S - S)}}}} + {\rm{436}} - 2 \times 363\\ \Rightarrow {{\rm{E}}_{{\rm{b (S - S)}}}} = 256,7{\rm{ (kJ/mol)}}\end{array}\)
9.23
Hydrogen sulfide phân huỷ theo phản ứng sau đây: \({\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{S(g)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{{\rm{H}}_{\rm{2}}}{\rm{(g)}} + {{\rm{S}}_{\rm{2}}}{\rm{(g)}}\)
Hằng số cân bằng K C = 9,3.10 -8 ở 427 o C.
a) Viết biểu thức hằng số cân bằng K C của phản ứng.
b) Xác định biến thiên enthalpy chuẩn của phản ứng, biết nhiệt tạo thành chuẩn của \({{\rm{H}}_{\rm{2}}}{\rm{S(g)}}\)và\({{\rm{S}}_{\rm{2}}}{\rm{(g)}}\)lần lượt là -20,6 kJ/mol và 128,6 kJ/mol. Cho biết phản ứng thuận là toả nhiệt hay thu nhiệt.
c) Ở 427 o C, tính hằng số cân bằng K’ C của phản ứng: \(2{{\rm{H}}_{\rm{2}}}{\rm{(g)}} + {{\rm{S}}_{\rm{2}}}{\rm{(g)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{S(g)}}\)
Phương pháp giải:
- Tổng quát, nếu có phản ứng thuận nghịch sau: aA+bB \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \({{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\)
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
- Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo enthalpy tạo thành:
\({\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = \sum {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(sp)}} - \sum {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(cd) }}\)
Lời giải chi tiết:
a) Hằng số cân bằng K C của phản ứng:
\({{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[}}{{\rm{H}}_{\rm{2}}}{\rm{]}}}^2}{\rm{[}}{{\rm{S}}_{\rm{2}}}{\rm{]}}}}{{{{{\rm{[}}{{\rm{H}}_{\rm{2}}}{\rm{S]}}}^2}}}\)
b) Biến thiên enthalpy chuẩn của phản ứng: \({\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{S(g)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{{\rm{H}}_{\rm{2}}}{\rm{(g)}} + {{\rm{S}}_{\rm{2}}}{\rm{(g)}}\)
\(\begin{array}{l}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} = {\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}{\rm{(}}{{\rm{S}}_2}) + 2{\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}{\rm{(}}{{\rm{H}}_2}) - 2{\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}{\rm{(}}{{\rm{H}}_2}{\rm{S}})\\{\rm{ = 128,6 + 2}} \times {\rm{0}} - 2 \times ( - 20,6)\\{\rm{ = }}169,8{\rm{ (kJ)}}\end{array}\)
c) \(2{{\rm{H}}_{\rm{2}}}{\rm{(g)}} + {{\rm{S}}_{\rm{2}}}{\rm{(g)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{S(g)}}\)
\({\rm{K}}{{\rm{'}}_{\rm{C}}} = \frac{{{{[{{\rm{H}}_{\rm{2}}}{\rm{S}}]}^2}}}{{{{[{{\rm{H}}_{\rm{2}}}]}^2}[{{\rm{S}}_{\rm{2}}}]}} = \frac{{\rm{1}}}{{{{\rm{K}}_{\rm{C}}}}} = \frac{1}{{9,{{3.10}^{ - 8}}}} \approx 1,08 \times {10^7}\)
9.24
Hiện nay, mưa acid, hiệu ứng nhà kính và thủng tầng ozone là ba thảm họa môi trường toàn cầu. Mưa acid tàn phá nhiều rừng cây, các công trình kiến trúc bằng đá và kim loại. Tác nhân chủ yếu gây ra mưa acid là sulfur dioxide.
a) Trong khí quyển, SO 2 chuyển hoá thành H 2 SO 4 trong nước mưa theo sơ đồ sau:

Viết các phương trình hoá học.
b) Một cơn mưa acid xuất hiện tại một khu công nghiệp diện tích 10 km 2 với lượng mưa trung bình 80 mm. Hãy tính:
- Thể tích nước mưa đã rơi xuống khu công nghiệp.
- Khối lượng H 2 SO 4 trong lượng nước mưa, biết nồng độ H 2 SO 4 trong nước mưa là 2.10 -5 M.
c) Lượng acid trong nước mưa có thể ăn mòn các công trình bằng đá vôi.
- Viết 1 phương trình hoá học minh hoạ.
- Khối lượng CaCO 3 tối đa bị ăn mòn bởi lượng acid trên.
d) Em hãy tìm hiểu về nguyên nhân phát sinh các khí gây mưa acid và đề xuất giải pháp hạn chế.
Phương pháp giải:
a) \({\rm{2S}}{{\rm{O}}_2} + {\rm{ }}{{\rm{O}}_2} \to 2{\rm{S}}{{\rm{O}}_3}{\rm{ }}\)
\({\rm{S}}{{\rm{O}}_{\rm{3}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \to {{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}{\rm{ }}\)
b) Thể tích nước mưa chứa H 2 SO 4 tại khu công nghiệp diện tích 10 km 2 : \({\rm{V}} = 10 \times {1000^2} \times \frac{{80}}{{1000}} = 8 \times {10^5}{\rm{ (}}{{\rm{m}}^3})\)
Số mol của H 2 SO 4 trong lượng nước mưa: \({{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}}} = 8 \times {10^5} \times {10^3} \times 2 \times {10^{ - 5}} = 16 \times {10^3}{\rm{ }}({\rm{mol)}}\)
Khối lượng H 2 SO 4 trong lượng nước mưa: \({{\rm{m}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}}} = 16 \times {10^3} \times 98 = 1568 \times {10^3}({\rm{g) = }}1568{\rm{ }}({\rm{kg) }}\)
c) \({\rm{CaC}}{{\rm{O}}_{\rm{3}}} + {\rm{ }}{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} \to {\rm{CaS}}{{\rm{O}}_{\rm{4}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} + {\rm{C}}{{\rm{O}}_{\rm{2}}}\)
\(\begin{array}{l}{{\rm{n}}_{{\rm{CaC}}{{\rm{O}}_{\rm{3}}}}}{\rm{ = }}{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}}} = 16 \times {10^3}{\rm{ }}({\rm{mol)}}\\ \Rightarrow {{\rm{m}}_{{\rm{CaC}}{{\rm{O}}_{\rm{3}}}}} = 16 \times {10^3} \times 100 = 16 \times {10^5}{\rm{(g) = 1600 (kg)}}\end{array}\)
d) - Nguyên nhân phát sinh các khí gây mưa acid:
+ Nguồn phát sinh sulfur dioxide
Sulfur dioxide được sinh ra từ cả nguồn tự nhiên (khí thải núi lửa) và nguồn nhân tạo. Nguồn sulfur dioxide nhân tạo chủ yếu sinh ra từ quá trình đốt cháy nhiên liệu có chứa tạp chất sulfur (than đá, dầu mỏ), đốt quặng sulfide (galen, blend) trong luyện kim, đốt sulfur và quặng pyrite trong sản xuất sulfuric acid,....
+ Nguồn gốc phát sinh NO x trong không khí
Bên cạnh nguồn gốc tự nhiên như núi lửa phun trào, cháy rừng, mưa dông kèm theo sấm sét, sự phân huỷ các hợp chất hữu cơ, thì sự phát sinh NO x chủ yếu là do hoạt động của con người. Các nguồn gây phát thải NOx nhân tạo từ hoạt động giao thông vận tải, sản xuất công nghiệp, nông nghiệp, nhà máy nhiệt điện và trong đời sống.
- Giải pháp hạn chế phát sinh NO x , SO 2 : tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo; sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên; cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur, nitrogen