Bài 20. Kim loại trong tự nhiên và phương pháp tách kim loại trang 69, 70 SBT Hóa 12 Kết nối tri thức
Chất nào dưới đây là thành phần chính của quặng hematite?
20.1
Chất nào dưới đây là thành phần chính của quặng hematite?
A. Iron(II) oxide. B. Iron(III) oxide. C. Iron. D. Iron(II) sulfide.
Phương pháp giải:
Dựa vào một số quặng trong tự nhiên.
Lời giải chi tiết:
Quặng hematite có chứa nhiều iron(III) oxide.
Đáp án B
20.2
Kim loại nào sau đây thường có ở dạng đơn chất trong tự nhiên?
A. Đồng. B. Kẽm. C. Vàng. D. Sắt.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
Vàng có ở dạng đơn chất trong tự nhiên do vàng trơ về mặt hóa học.
Đáp án C
20.3
Kim loại nào sau đây có thể được điều chế từ hợp chất của nó bằng cách chỉ dùng nhiệt (đun nóng)?
A. Bạc. B. Nhôm. C. Sắt. D. Kẽm.
Phương pháp giải:
Dựa vào các phương pháp điều chế kim loại.
Lời giải chi tiết:
Ag được điều chế bằng phương pháp nhiệt phân muối.
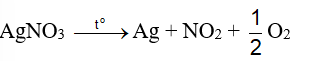
Đáp án A
20.4
Phương pháp thích hợp để điều chế Mg từ MgCl 2 , là
A. dùng kali khử ion Mg 2+ trong dung dịch. B. điện phân MgCl 2 , nóng chảy.
C. điện phân dung dịch MgCl 2 . D. nhiệt phân MgCl 2 .
Phương pháp giải:
Mg là kim loại mạnh nên dùng phương pháp điện phân nóng chảy.
Lời giải chi tiết:
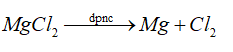
Đáp án B
20.5
Có thể thu được kim loại nào trong số các kim loại sau: Cu, Na, Ca, Al bằng cả ba phương pháp điều chế kim loại phổ biến?
A. Na. B. Ca. C. Cu. D. Al.
Phương pháp giải:
Dựa vào các phương pháp tách kim loại.
Lời giải chi tiết:
Có thể điều chế Cu bằng phương pháp điện phân nóng chảy, thủy luyện, nhiệt luyện.
Đáp án C
20.6
Phản ứng nào sau đây không điều chế được kim loại Cu?
A. Cho Fe tác dụng với dung dịch CuSO 4 .
B. Cho Na tác dụng với dung dịch CuSO 4 .
C. Điện phân dung dịch CuSO 4 (điện cực trơ).
D. Cho H 2 tác dụng với CuO, đun nóng.
Phương pháp giải:
Dựa vào phương pháp điều chế kim loại.
Lời giải chi tiết:
Không dùng Na tác dụng với dung dịch CuSO 4 vì Na phản ứng mạnh với H 2 O tạo NaOH sau đó mới tác dụng với CuSO 4 tạo Cu(OH) 2 nên không thu được kim loại Cu.
Đáp án B
20.7
Trong công nghiệp, nhôm được tách ra từ quặng bauxite bằng cách nào sau đây?
A. Nung nóng quặng bauxite. B. Nung nóng quặng bauxite với carbon.
C. Nung nóng quặng bauxite với hydrogen. D. Điện phân nóng chảy quặng bauxite.
Phương pháp giải:
Dựa vào phương pháp điều chế kim loại.
Lời giải chi tiết:
Nhôm là kim loại mạnh nên được điều chế bằng điện phân nóng chảy quặng bauxite.
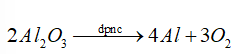
Đáp án D
20.8
Phương pháp nào sau đây có thể tách được sodium kim loại?
A. Nung nóng mạnh quặng sodium trong không khí.
B. Nung nóng quặng sodium với carbon.
C. Điện phân nước muối.
D. Điện phân muối sodium chloride nóng chảy.
Phương pháp giải:
Dựa vào phương pháp điều chế kim loại.
Lời giải chi tiết:
Na là kim loại mạnh nên được điều chế bằng phương pháp điện phân nóng chảy.
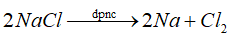
Đáp án D
20.9
Cho ba kim loại được tách từ quặng của chúng theo các cách tương ứng sau.
|
Kim loại |
Phương pháp tách thông dụng |
|
X |
Điện phân |
|
Y |
Nhiệt phân, nung nóng trực tiếp |
|
Z |
Nung nóng với carbon |
Khả năng hoạt động hoá học của các kim loại giảm dần theo thứ tự nào sau đây?
A. X, Z, Y. B. Y, Z, X. C. X, Y, Z. D. Z, Y, X.
Phương pháp giải:
Dựa vào phương pháp điều chế kim loại.
Lời giải chi tiết:
X cần dùng phương pháp điện phân nóng chảy => X là kim loại mạnh như Na, K, Ba, Ca, Mg, Al.
Y nhiệt phân, nung nóng trực tiếp => Y là kim loại rất yếu như Ag, Hg.
Z nung nóng với carbon => Z là kim loại trung bình như Fe, Cu.
Vậy, khả năng hoạt động hóa học giảm dần theo thứ tự: X, Y, Z.
20.10
Cho các oxide kim loại sau: (1) Silver oxide; (2) Calcium oxide và (3) Mercury(II) oxide. Nung nóng oxide kim loại nào ở trên thu được kim loại?
A. (1). B. (2). C. (1); (3). D. (2); (3).
Phương pháp giải:
Dựa vào phương pháp nhiệt luyện.
Lời giải chi tiết:
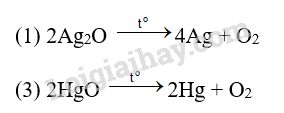
Đáp án C
20.11
Cho các phát biểu về tách kim loại;
(1) Đồng có thể được tách từ copper(II) oxide bằng cách nung nóng.
(2) Trong phương pháp điện phân nóng chảy aluminium oxide, có thể thu được nhôm nóng chảy ở điện cực âm của bình điện phân.
(3) Kẽm có thể được tách từ zinc oxide bằng cách nung nóng zinc oxide với carbon.
Các phát biểu đúng là
A. (1) và (2). B. (1) và (3). C. (2) và (3). D. (1), (2) và (3).
Phương pháp giải:
Dựa vào phương pháp nhiệt luyện
Lời giải chi tiết:
(1) Sai do CuO không bị nhiệt phân.
(2) Đúng.
(3) Đúng.
Đáp án C
20.12
Để khử hoàn toàn một lượng oxide kim loại thành kim loại cần vừa đủ V lít khí H 2 . Hoà tan lượng kim loại tạo thành bằng H 2 SO 4 loãng, dư thu được V lít H 2 (các khí đo cùng điều kiện). Oxide kim loại đó là
A. MgO. B. Fe 2 O 3 . C. FeO. D. CuO.
Phương pháp giải:
Dựa vào phương pháp tách kim loại.
Lời giải chi tiết:
Nhận thấy kim loại Cu không phản ứng với H 2 SO 4 loãng => loại D.
MgO không bị khử bởi H 2 => loại A.
Oxide kim loại phản ứng với H 2 và kim loại tương ứng phản ứng với H 2 SO 4 loãng sinh ra lượng H 2 tương ứng (bằng nhau) thì kim loại phản ứng với H 2 SO 4 phải có hóa trị bằng hóa trị của kim loại trong oxide.
Vậy đáp án C.
20.13
Cho khí CO (dư) đi qua ống sứ nung nóng đựng hỗn hợp X gồm Al 2 O 3 , MgO, Fe 3 O 4 và CuO, thu được chất rắn Y. Cho Y vào dung dịch NaOH dư, khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm
A. MgO, Fe, Cu. B. Mg, Fe, Cu. C. MgO, Fe 3 O 4 , Cu. D. Mg, Al, Fe, Cu
Phương pháp giải:
Dựa vào phương pháp nhiệt luyện.
Lời giải chi tiết:
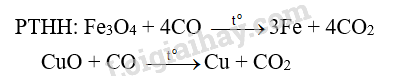
=> Chất rắn Y: Al 2 O 3 , MgO, Fe và Cu tác dụng với NaOH dư.
Al 2 O 3 + 2NaOH → 2NaAlO 2 + H 2 O
=> Chất rắn Z: MgO, Fe và Cu.
Đáp án A
20.14
Hãy chọn đúng hoặc sai cho mỗi ý a, b, c, d
a) Các kim loại Fe, Al, Cu đều có thể điều chế bằng phương pháp dùng CO khử oxide kim loại tương ứng.
b) Trong công nghiệp, kim loại Al chỉ có thể điều chế được bằng phương pháp điện phân.
c) Để tách Ag khỏi các tạp chất Fe, Cu ta có thể cho hỗn hợp vào dung dịch AgNO 3 du.
d) Trong công nghiệp, kim loại Na được điều chế bằng cách điện phân dung dich NaCl.
Phương pháp giải:
Dựa vào phương pháp tách kim loại.
Lời giải chi tiết:
a) Sai. Al điều chế bằng phương pháp điện phân nóng chảy.
b) Đúng.
c) Đúng.
d) Sai. Na được điều chế bằng cách điện phân nóng chảy NaCl.
20.15
Dẫn khí CO dư qua ống sử dụng 16 g Fe 2 O 3 nung nóng, sau khi phản ứng xảy ra hoàn toàn thu được m gam kim loại. Giá trị của m là bao nhiêu?
Phương pháp giải:
Dựa vào phương pháp nhiệt luyện.
Lời giải chi tiết:
n Fe2O3 = 16 : 160 = 0,1 mol.
Bảo toàn nguyên tố: n Fe = 2.n Fe2O3 = 0,1.2 = 0,2 mol
\( \to \)m Fe = 0,2.56 = 11,2g
20.16
Cho 14 g bột Fe vào 400 mL dung dịch X gồm AgNO 3 0,5 M và Cu(NO 3 ) 2 x M. Khuấy nhẹ cho tới khi phản ứng kết thúc thu được dung dịch Y và 30,4 g chất rắn Z. Giá trị của x là
A. 0,15. B. 0,125. C. 0,2. D. 0,1
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại.
Lời giải chi tiết:
\({n_{Ag}} = {n_{AgN{O_3}}} = 0,2\,mol \Rightarrow {m_{Ag}} = 108.0,2 = 21,6\,g\, < \,30,4\,g\)=> Z chứa Ag và Cu (có thể có Fe dư)
Xét dung dịch \(\left\{ \begin{array}{l}NO_3^ - :(0,2 + 0,8x)\,mol\\F{e^{2 + }}:0,25\,mol\\C{u^{2 + }}:a\,mol\end{array} \right.\)
Bảo toàn điện tích ta có: \( \Rightarrow 2a + 2.0,25 = 0,2 + 0,8x \Rightarrow 0,4x - a = 0,15\)
\( \Rightarrow \)m Z = 108. 0,2 + 64. 0,15 = 31,2 g > 30,4 g(loại)
Vậy dung dịch \(\left\{ \begin{array}{l}NO_3^ - :(0,2 + 0,8x)\,mol\\F{e^{2 + }}:b\,mol\end{array} \right.\)
\( \Rightarrow \left\{ \begin{array}{l}2b = 0,2 + 0,8x\\108.0,2 + 64.0,4x + 56(0,25 - b) = 30,4\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,125\\b = 0,15\end{array} \right.\)
Đáp án B
20.17
Hãy chọn đúng hoặc sai cho mỗi ý a, b, c, d
Điện phân 200 mL dung dịch chứa hai muối Cu(NO 3 ) 2 x M và AgNO 3 y M với cường độ dòng điện 0,804 A. Sau thời gian điện phân là 2 giờ, khối lượng cathode tăng thêm 3,44 g và bắt đầu thoát khí.
a) Kim loại nào có nồng độ cao hơn sẽ được tạo thành trước.
b) Giá trị của x và y đều bằng 0,1.
c) Sau 2 giờ trong bình điện phân chỉ còn 1 chất tan.
d) Số mol khí thoát ra ở anode sau 2 giờ điện phân là 0,2.
Phương pháp giải:
Dựa vào phương pháp điện phân dung dịch.
Lời giải chi tiết:
n Cu(NO3)2 = 0,2x mol; n AgNO3 = 0,2y
Áp dụng định luật Faraday: I.t = n.F
\( \to \)n e = \(\frac{{0,804.2.3600}}{{96500}}0,06mol\)
Vì tại cathode bắt đầu thoát ra khí nên Cu 2+ và Ag + bị điện phân hết tạo thành kim loại.
Quá trình xảy ra ở bình điện phân
|
Điện cực cathode ( - ) |
Điện cực anode ( + ) |
|
Ag + + 1e\( \to \) Ag 0,2y \( \to \) 0,2y 0,2y |
2H 2 O \( \to \)O 2 + 4H + + 4e 0,015 \( \leftarrow \) 0,06 |
|
Cu 2+ + 2e \( \to \) Cu 0,2x\( \to \) 0,4x 0,2x |
Bảo toàn electron: 0,2y + 0,4x = 0,06 (1)
Khối lượng cathode tăng = m Cu + m Ag = 0,2y.108 + 0,2x.64 = 3,44 (2)
Từ (1) và (2) ta có: x = y = 0,1 mol
a) Sai. Kim loại có tính khử yếu hơn sẽ tạo ra trước.
b) Đúng
c) Đúng
d) Sai, số mol khí thoát ra ở anode sau 2 giờ điện phân là 0,015 mol.
20.18
Hãy chọn đúng hoặc sai cho mỗi ý a, b, c, d
Cho 4,958 lít khí CO (ở đkc) từ từ đi qua ống sứ nung nóng đựng 8 g một oxide sắt đến khi phản ứng xảy ra hoàn toàn. Khi thu được sau phản ứng có tỉ khối so với H 2 bằng 20.
a) Công thức của oxide sắt là Fe 2 O 3 .
b) Phần trăm thể tích CO 2 trong hỗn hợp khí sau phản ứng là 75%.
c) Hỗn hợp khí sau phản ứng có thể tích 4,958 lít (ở đkc).
d) Khối lượng chất rắn thu được là 5,6 g.
Phương pháp giải:
Dựa vào phương pháp nhiệt luyện.
Lời giải chi tiết:
n CO = 4,958 : 24,79 = 0,2 mol
CO + Fe x O y \( \to \) Fe + CO 2
Hỗn hợp khí sau phản ứng gồm: CO và CO 2
\({d_{hh/H2}} = \frac{{{M_{hh}}}}{{{M_{{H_2}}}}} = 20 \to {M_{hh}} = 20.2 = 40\)
\(\begin{array}{l}{M_{hh}} = \frac{{{m_{CO}} + {m_{CO2}}}}{{{n_{CO}} + {n_{CO2}}}} = 40\\ \to 28a + 44b = 40{\rm{a}} + 40b\\ \to \frac{a}{b} = \frac{1}{3} \to \left\{ \begin{array}{l}{n_{CO}} = 0,05\\{n_{CO2}} = 0,15\end{array} \right.\end{array}\)
=> %V CO2 = \(\frac{{0,15}}{{0,05 + 0,15}}.100\% = 75\% \)
Ta có: n O (oxide) = n CO2 = 0,15 \( \to \)n Fe = \(\frac{{8 - 16.0,15}}{{56}} = 0,1mol\)
\( \to \)\(\frac{{{n_{Fe}}}}{{{n_O}}} = \frac{{0,1}}{{0,15}} = \frac{2}{3} \to CTHH:F{e_2}{{\rm{O}}_3}\)
a) Đúng.
b) Đúng.
c) Đúng.
d) Đúng