Bài 24. Nguyên tố nhóm IA trang 81, 82, 83 SBT Hóa 12 Kết nối tri thức
Ở trạng thái cơ bản nguyên tử K có cấu hình electron là [Ar]4s1.
24.1
Ở trạng thái cơ bản nguyên tử K có cấu hình electron là [Ar]4s 1 . Trong bảng tuần hoàn, nguyên tố K thuộc nhóm.
A. IIIA. B. IA. C. IVA. D. IIA.
Phương pháp giải:
Dựa vào số electron hóa trị.
Lời giải chi tiết:
Vì ở trạng thái cơ bản, K có cấu hình [Ar]4s 1 có 1 electron lớp ngoài cùng nên K thuộc nhóm IA.
Đáp án B
24.2
Khi tham gia phản ứng hóa học, mỗi nguyên tử kim loại nhóm IA đều thể hiện khuynh hướng
A. Nhường 2 electron. B. Nhận 2 electron. C. Nhận 1 electron. D. Nhường 1 electron.
Phương pháp giải:
Dựa vào tính chất hóa học của nguyên tố IA.
Lời giải chi tiết:
Nguyên tố kim loại IA đều thể hiện khuynh hướng nhường 1 electron.
Đáp án D
24.3
Ở điều kiện thường các tinh thể kim loại nhóm IA đều có kiểu cấu trúc.
A. Lập phương tâm khối. B. Lập phương tâm mặt.
C. Lục phương. D. Lập phương đơn giản.
Phương pháp giải:
Dựa vào cấu trúc tinh thể của kim loại IA.
Lời giải chi tiết:
ở điều kiện thường các tinh thể kim loại nhóm IA đề có kiểu cấu trúc lập phương tâm khối.
đáp án A
24.4
Nhiệt độ nóng chảy của các kim loại nhóm IA từ Li đến Cs biến đổi như thế nào?
A. Tăng dần. B. Không đổi. C. Không có quy luật. D. Giảm dần.
Phương pháp giải:
Dựa vào biến đổi tính chất vật lí trong cùng một nhóm.
Lời giải chi tiết:
Trong cùng một nhóm, nhiệt độ nóng chảy của các kim loại IA từ Li đến Cs giảm dần.
Đáp án D
24.5
Ở điều kiện thường kim loại có khối lượng riêng, nhỏ nhất là.
A. K. B. Rb. C. Li. D. Na.
Phương pháp giải:
Dựa vào biến đổi tính chất vật lí trong cùng một nhóm.
Lời giải chi tiết:
Ở điều kiện thường, kim loại có khối lượng riêng nhỏ nhất là Li.
Đáp án C
24.6
Hợp hợp kim nào sau đây có nhiệt độ nóng chảy thấp (~70 o C), dễ hóa lỏng nên được dùng làm chất dẫn nhiệt trong một số lò phản ứng hạt nhân?
A. Fe – C. B. Na – K. C. Al – Mg. D. Au – Ag.
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại IA.
Lời giải chi tiết:
Kim loại nhóm IA có nhiệt nóng chảy thấp dễ hóa lỏng nên được dùng làm chất dẫn nhiệt trong một số lò phản ứng hạt nhân.
Đáp án B
24.7
Nhận định nào sau đây về kim loại nhóm IA không đúng?
A. Độ cứng thấp. B. Dễ nóng chảy. C. Khối lượng riêng lớn. D. Dẫn điện tốt.
Phương pháp giải:
Dựa vào tính chất vật lí của nhóm IA.
Lời giải chi tiết:
Nhóm IA có khối lượng riêng nhỏ.
Đáp án C
24.8
Ở một số quốc gia, khoáng vật trona là nguyên liệu chính để sản xuất soda. Thành phần hóa học chính của trona là.
A. 3NaF.AlF 3 . B. NaCl.KCl.
C. Na 2 CO 3 .NaHCO 3 .2H 2 O. D. NaNO 3 .
Phương pháp giải:
Dựa vào ứng dụng của các hợp chất nhóm IA
Lời giải chi tiết:
Thành phần chính của trona là Na 2 CO 3 .NaHCO 3 .2H 2 O.
Đáp án C
24.9
Tính khử của các kim loại nhóm IA từ Li đến Cs biến đổi như thế nào?
A. Tăng dần. B. Không đổi. C. Không có quy luật. D. Giảm dần.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại nhóm IA.
Lời giải chi tiết:
Tính khử của các kim loại nhóm IA từ Li đến Cs tăng dần.
Đáp án A
24.10
Dãy nào sau đây sắp xếp các kim loại nhóm IA theo mức độ phản ứng với nước tăng dần?
A. K, Na, Li. B. Na, K, Li. C. Li, Na, K. D. K, Li, Na.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại nhóm IA.
Lời giải chi tiết:
Li, Na, K tăng dần tính khử nên mức độ phản ứng với nước cũng tan dần.
Đáp án C
24.11
Kim loại nhóm IA có tính khử mạnh nhất trong các nhóm kim loại. Giá trị thế điện cực chuẩn nào sau đây thuộc về một kim loại trong nhóm IA.
A. -0,44 V. B. -2,93 V. C. 0 V. D. 1,52 V.
Phương pháp giải:
Dựa vào bảng thế điện cực chuẩn của kim loại.
Lời giải chi tiết:
Giá trị thế điện cực chuẩn của một kim loại trong nhóm IA là – 2,93V.
Đáp án B
24.12
Khi đốt nóng tinh thể LiCl trong ngọn lửa đèn khí không màu thì tạo ra ngọn lửa có màu
A. Da cam. B. Tím nhạt. C. Vàng. D. Đỏ tía.
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại
Lời giải chi tiết:
Khi đốt nóng tinh thể LiCl trong ngọn lửa đèn khí không màu tạo ra ngọn lửa có màu đỏ tía.
Đáp án D
24.13
Các kim loại kiềm đều hoạt động hóa học mạnh. Vì vậy, để bảo quản lâu dài, chúng thường được ngâm trong
A. Dầu hỏa. B. Nước máy. C. Ethyl alcohol D. Giấm ăn.
Phương pháp giải:
Dựa vào cách bảo quản kim loại IA.
Lời giải chi tiết:
Để bảo quản lâu dài, kim loại IA thường được ngâm trong dầu hỏa.
Đáp án A
24.14
Hợp chất nào sau đây vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch NaOH?
A. NaHCO 3 B. NaCl. C. Ba(OH) 2 . D. Na 2 CO 3 .
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
NaHCO 3 vừa tác dụng với HCl và NaOH theo phản ứng sau:
NaHCO 3 + HCl → NaCl + CO 2 + H 2 O
NaHCO 3 + NaOH → Na 2 CO 3 + H 2 O
Đáp án A
24.15
Trong công nghiệp, quá trình điện phân dung dịch NaCl bảo hòa (điện cực trơ màng, ngăn xốp) để sản xuất các hóa chất nào sau đây?
A. Na và Cl 2 . B. Na, H 2 và Cl 2 . C. NaOH, H 2 và Cl 2 . D. NaOH, O 2 và Cl 2 .
Phương pháp giải:
Dựa vào phản ứng điện phân dung dịch NaCl.
Lời giải chi tiết:
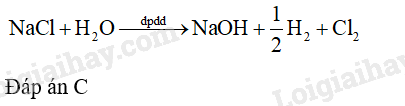
24.16
Nhỏ vài giọt dung dịch phenolphtalein vào dung dịch Na 2 CO 3 thì dùng dịch chuyển sang màu.
A. Tím. B. Vàng. C. Xanh. D. Hồng.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
Na 2 CO 3 có môi trường base nên nhỏ vài giọt dung dịch phenolphtalein sẽ chuyển sang màu hồng.
Đáp án D
24.17
Ở các nước ôn đới, để làm giảm nhiệt độ đóng băng của nước, làm tuyết tan, khoáng chất được rải lên tuyết là.
A. Muối mỏ. B. Than đá. C. Đá vôi. D. Thạch cao.
Phương pháp giải:
Dựa vào ứng dụng của kim loại IA.
Lời giải chi tiết:
Ở các nước ôn đới, để làm giảm nhiệt độ đóng băng của nước, làm tuyết tan, khoáng chất được rải lên tuyết là muối mỏ.
Đáp án A
24.18
Diêm tiêu kali được dùng để chế tạo thuốc nổ đen (làm mìn pha đá), làm phân bón (cung cấp nguyên tố N và K cho cây trồng) có công thức hóa học là.
A. KNO 3 . B. K 2 CO 3 . C. KCl. D. K 2 SO 4 .
Phương pháp giải:
Dựa vào các hợp chất thông dụng nhóm IA.
Lời giải chi tiết:
Diêm tiêu kali có công thức là KNO 3 .
Đáp án A
24.19
Quá trình sản xuất soda bằng Phương pháp Solvay k hông sử dụng nguyên liệu nào sau đây?
A. Carbon dioxide. B. Muối ăn. C. Xút ăn da. D. Ammonia.
Phương pháp giải:
Dựa vào Phương pháp Solvay.
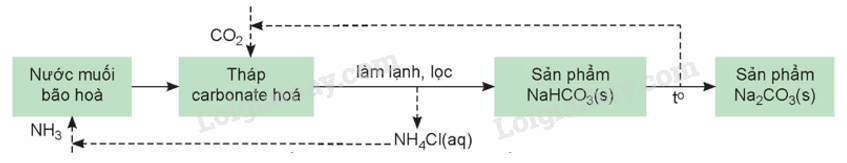
Lời giải chi tiết:
Quá trình sản xuất soda bằng Phương pháp Slovay không sử dụng xút ăn da.
Đáp án C
24.20
Khi đốt cháy kim loại Na trong bình chứa oxygen tạo thành sản phẩm là.
A. NaO. B. Na 2 O 2 . C. Na 2 O. D. NaO 2 .
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
Khi đốt cháy kim loại Na trong bình chứa oxygen tạo thành Na 2 O 2 (peoxide)
Đáp án B
24.21
Trong dãy kim loại nhóm IA từ Li đến Cs. Nhiệt độ nóng chảy giảm dần là do nguyên nhân nào sau đây?
A. Độ bền liên kết kim loại giảm dần. B. Số electron hóa trị tăng dần.
C. Khối lượng nguyên tử tăng dần. D. Độ âm điện giảm dần.
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại IA.
Lời giải chi tiết:
Nhiệt độ nóng chảy giảm dần là do độ bền liên kết kim loại giảm dần.
Đáp án A
24.22
Trong dãy kim loại nhóm IA. Từ Li đến Cs, số electron hóa trị trên một đơn vị thể tích biến đổi như thế nào?
A. Giảm dần. B. Tăng dần. C. Không đổi. D. Không có quy luật.
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại nhóm IA.
Lời giải chi tiết:
Số electron hóa trị trên một đơn vị thể tích biến đổi giảm dần.
Đáp án A
24.23
Khi so sánh nhóm IA với các nguyên tố khác trong cùng chu kỳ, nhận định nào sau đây không đúng?
A. Có tính khử mạnh nhất. B. Có thế đến cực chuẩn âm nhất.
C. Có bán kính nguyên tử lớn nhất. D. Có liên kết kim loại mạnh nhất.
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại nhóm IA.
Lời giải chi tiết:
Khi so sánh nhóm IA với các nguyên tố khác trong cùng chu kì, các liên kết kim loại IA là yếu nhất.
Đáp án D
24.24
Trong quá trình điện phân dung dịch NaCl với điện cực trơ có màng ngăn xốp, phân tử hay ion nào sau đây di chuyển được từ anode sang cathode qua màng ngăn xốp?
A. Cl - . B. Na + . C. OH - . D. Cl 2 .
Phương pháp giải:
Dựa vào nguyên tắc điện phân dung dịch.
Lời giải chi tiết:
Khi điện phân dung dịch, ion Na + di chuyển được từ anode sang cathode qua màng ngăn xốp vì Na + không bị điện phân.
Đáp án B
24.25
Một gia đình pha 1kg nước muối sinh lí 0,9% để làm nước súc miệng. Khối lượng muối ăn cần dùng là
A. 9 g. B. 27 g. C. 18 g. D. 36 g.
Phương pháp giải:
Dựa vào công thức tính C%
Lời giải chi tiết:
Khối lượng muối ăn cần dùng là: 1.0,9% = 0,009kg = 9g
Đáp án A
24.26
X, Y, Z là các hợp chất vô cơ của sodium, biết rằng:

Các hợp chất X, Z lần lượt là
A. Na 2 CO 3 , NaHCO 3 . B. NaHCO 3 , NaOH
C. NaOH, Na 2 CO 3 . D. NaHCO 3 , Na 2 CO 3 .
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
Z, Y lần lượt là NaHCO 3 , NaOH
Đáp án B
24.27
Xét phản ứng nhiệt phân NaHCO 3 thành Na 2 CO 3 trong quá trình Solvay:
2NaHCO 3 (s) → Na 2 CO 3 (s) + CO 2 (g) + H 2 O (g) ΔH o =+135,6kJ
Nhiệt lượng cần cung cấp để nhiệt phân 1kg NaHCO 3 theo phản ứng trên là
A. 807,1 kJ. B. 1 614,3 kJ C. 1 210,7 kJ. D. 403,6 kJ.
Phương pháp giải:
Dựa vào công thức tính biến thiên enthalpy của phản ứng
Lời giải chi tiết:
n NaHCO3 = \(\frac{{{{1.10}^3}}}{{84}}\)mol
Nhiệt lượng cần cung cấp để nhiệt phân 1kg NaHCO 3 theo phản ứng là: \(\frac{{{{1.10}^3}}}{{84}}\) .135,6 : 2 = 807,1 kJ
Đáp án A
24.28
Trong một giai đoạn của quá trình Solvay có tồn tại cân bằng giữa các muối trong dung dịch:
NaCl + NH 4 HCO 3 ⇄ NaHCO 3 + NH 4 Cl
Dựa trên tính chất nào của NaHCO 3 để kết tinh muối này từ dung dịch hỗn hợp?
A. Độ tan thấp.
B. Tính lưỡng tính.
C. Độ bền nhiệt thấp.
D. Tính acid Bronsted.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
NaHCO 3 được kết tinh muối này từ dung dịch dựa vào độ tan thấp của muối này.
Đáp án A
24.29
Đun nóng tinh thể muối halide nào sau đây với dung dịch sulfuric acid đặc sẽ xảy ra phản ứng oxi hóa – khử?
A. NaCl. B. NaF. C. KCl. D. KBr.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
KBr khi tác dụng với H 2 SO 4 đặc sẽ xảy ra phản ứng oxi hóa – khử theo phương trình sau:
2KBr + 2H 2 SO 4 đặc → K 2 SO 4 + Br 2 + SO 2 + 2H 2 O
Đáp án D
24.30
Dãy nào sau đây sắp xếp các dung dịch (có nồng độ 0,1M) theo thứ tự pH tăng dần?
A. LiOH, Na 2 CO 3 , KCl. B. Na 2 CO 3 , KCl, LiOH.
C. KCl, Na 2 CO 3 , LiOH. D. Na 2 CO 3 , LiOH, KCl.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
KCl có pH = 7
LiOH có pH > 7
Na 2 CO 3 có pH > 7 nhưng thấp hơn dung dịch base.
Thứ tự pH tăng dần là: KCl, Na 2 CO 3 , LiOH
Đáp án C
24.31
Hãy chọn đúng hoặc sai cho mỗi ý a, b, c, d ở các câu 24.31 – 24.32.
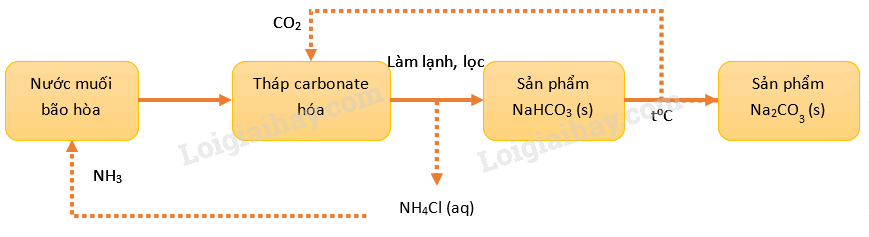
Phương pháp Solvay để sản xuất Na 2 CO 3 trong công nghiệp được minh họa ở sơ đồ sau:
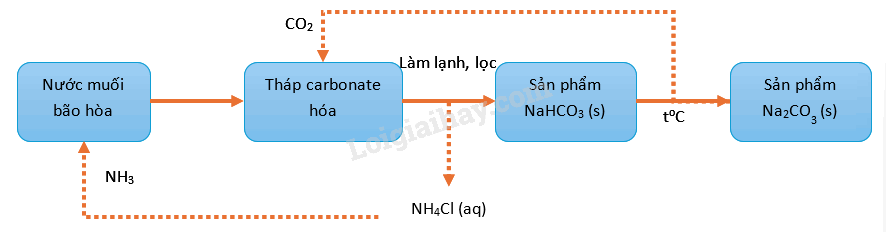
a) Ion hydrogencarbonate được tạo thành tại tháp carbonate hóa.
b) Ở giai đoạn làm lạnh, NaHCO 3 được tách biệt bằng Phương pháp kết tủa.
c) Phản ứng chuyển hóa NaHCO 3 thành Na 2 CO 3 là phản ứng tỏa nhiệt.
d) Ammonia và carbon dioxide được sử dụng quay vòng trong quá trình sản xuất.
Phương pháp giải:
Dựa vào Phương pháp Solvay.
Lời giải chi tiết:
a) đúng; vì sản phẩm NaHCO 3 được hình thành trong sơ đồ trên (tức là trong tháp sản phẩm)
b) sai; vì NaHCO 3 không phải kết tủa mà là kết tinh
c) sai; vì phản ứng NaHCO 3 → Na 2 CO 3 là phản ứng nhiệt phân (tức là thu nhiệt)
d) đúng; vì trong sơ đồ trên có nêu rõ các dấu mũi tên tương ứng với sự quay vòng 2 chất này.
24.32
Quặng sylvinite là một khoáng chất phổ biến có thành phần chính là NaCl.KCl. Sự phụ thuộc của độ tan các muối vào nhiệt độ được biểu diễn ở đồ thị sau
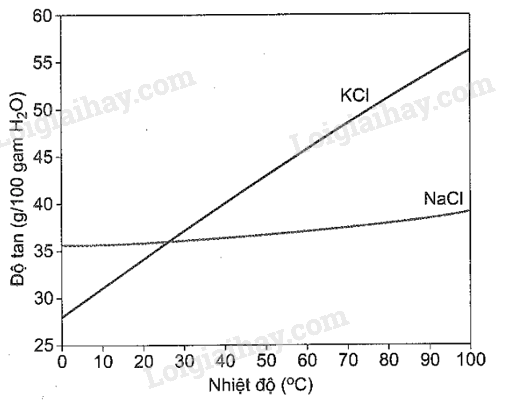
a) Độ tan của KCl giảm chậm khi giảm nhiệt độ từ 100 o C về 0 o C.
b) Tách được KCl khỏi dung dịch NaCl bằng phương pháp kết tinh.
c) Độ tan của NaCl tăng nhanh khi nhiệt độ từ 0 o C đến 100 o C.
d) Độ tan của KCl giảm nhanh hơn của NaCl khi giảm nhiệt độ từ 100 o C về 0 o C.
Phương pháp giải:
Dựa vào biểu đồ sự phụ thuộc của độ tan các muối vào nhiệt độ.
Lời giải chi tiết:
a) sai; đồ thị độ tan của KCl là một đường dốc đứng, nói cách khác thì độ tan giảm (hoặc tăng nhanh) khi nhiệt độ thay đổi.
b) đúng; do độ tan của KCl thay đổi mạnh khi thay đổi nhiệt độ so với độ tan của NaCl (2 đồ thị có độ dốc khác nhau rất lớn) nên có thể tách KCl bằng phương pháp kết tinh
c) sai; như đã giải thích ở trên độ tan của NaCl thay đổi không đáng kể khi tăng hoặc giảm nhiệt độ
d) đúng; như đã giải thích ở trên, hãy dựa vào đồ thị, cụ thể là độ dốc của đồ thị để nhận xét.
24.33
Ở 20 o C, độ tan của NaCl trong nước là 35,9 g trong 100 g nước. Ở nhiệt độ này, dung dịch NaCl bão hòa có nồng độ a%.
Giá trị của a là bao nhiêu? (Làm tròn kết quả đến phần mười).
Phương pháp giải:
Dựa vào công thức tính độ tan S và nồng độ phần trăm C%
Lời giải chi tiết:
Độ tan là khối lượng chất tan trong 100 gam dung môi
\(\left\{ \begin{array}{l}S = \frac{{{m_{ct}}}}{{{m_{dm}}}}.100\\C\% = \frac{{{m_{ct}}}}{{{m_{dm}} + {m_{ct}}}}.100\end{array} \right. \Leftrightarrow \frac{S}{{C\% }} = \frac{{{m_{dm}} + {m_{ct}}}}{1} \Leftrightarrow C\% = \frac{S}{{{m_{dm}} + {m_{ct}}}} = \frac{S}{{100 + s}}.100\)
\(C = \frac{S}{{100 + S}}.100\% = \frac{{35,9}}{{100 + 35,9}}.100 = 26,4\% \)
24.34
Trong tinh thể NaCl, các ion trái dấu tiếp xúc và sắp xếp xen kẽ nhau như mô hình sau đây.
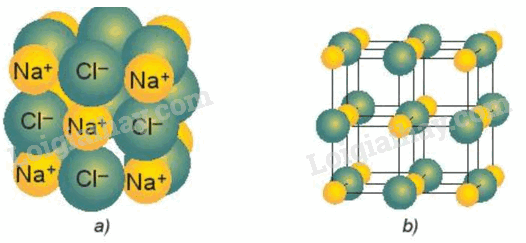
Biết chiều dài cạnh của hình lập phương ở mô hình rỗng là a=564 pm và bán kính ion Cl - là 182 pm.
Bán kính ion Na + là bao nhiêu pm? (làm tròn kết quả đến phần nguyên).
Phương pháp giải:
Dựa vào cách tính bán kính nguyên tử.
Lời giải chi tiết:
Độ dài cạnh của hình lập phương bằng khoảng cách của (đường kính ion Cl - + 2.(bán kính ion Na + )) – các em hãy quan sát hình ảnh mô hình rỗng để hiểu rõ.
\(2.{R_{C{l^ - }}} + 2.{R_{N{a^ + }}} = d \Rightarrow {R_{N{a^ + }}} = \frac{{d - 2.{R_{C{l^ - }}}}}{2}\)
(Hoặc tổng bán kính ion Na + và ion Cl - \( = \frac{a}{2} = \frac{{564{\rm{ pm}}}}{2} = 282{\rm{ pm}}\))
Þ Bán kính ion Na + = 100 pm
24.35
Tại một nhà máy quặng bauxite được đun nóng với dung dịch NaOH 20% ở nhiệt độ 170 o C đến 180 o C để chuyển hóa Al 2 O 3 thành muối dễ tan theo phương trình hóa học:
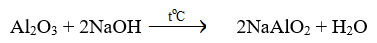
Để hòa tan một tấn Al 2 O 3 trong quặng bauxite. Cần dùng ít nhất bao nhiêu tấn dung dịch NaOH 20%. (Làm tròn kết quả đến phần trăm).
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
Lượng NaOH cần dùng tối thiểu đúng bằng lượng NaOH được tính toán trên phản ứng trên.
\({n_{A{l_2}{O_3}}} = \frac{{{{10}^6}}}{{27.2 + 16.3}}\)Þ \({n_{NaOH}} = 2.\frac{{{{10}^6}}}{{102}}\)
Số mol NaOH tối thiểu cần dùng \( = \frac{{1{\rm{ 000 000}}}}{{102}}.2 = 19{\rm{ 608 (mol)}}\). Với \({m_{dd}} = \frac{{{m_{ct}}.C\% }}{{100}}\)
Khối lượng dung dịch: \(40.{\rm{19 608}}{\rm{.}}\frac{{100}}{{20}} = 3{\rm{ 921 600 (g) = 3,9216 tan}}\).
24.36
Cho 1,9 gam hỗn hợp gồm muối carbonate và hydrocarbonate của một kim loại kiềm. Tác dụng với dung dịch HCl dư thu được 0,496 lít khí (đkc). Kim loại kiềm là
A. K. B. Li. C. Na. D. Rb.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
n CO2 = \(\frac{{0,496}}{{24,79}} = 0,02mol\)
gọi công thức của kim loại IA là M
Ta có: MCO 3 + 2HCl → MCl + CO 2 + H 2 O
MHCO 3 + HCl → MCl + CO 2 + H 2 O
Theo phương trình phản ứng: n muối = n CO2
\({\bar M_{muoi}} = \frac{{1,9}}{{0,02}} = 95\)→ MHCO 3 < 95 < M 2 CO 3 → 17,5 < M < 34. Vậy M là Na (23)
Đáp án C
24.37
Hòa tan hoàn toàn hỗn hợp K và Na vào nước, thu được dung dịch X và a mol khí H 2 . Trung hòa X cần 200 mL dung dịch H 2 SO 4 0,1 M. Giá trị của a là
A. 0,04. B. 0,02. C. 0,005. D. 0,01.
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
K + H 2 O → KOH + ½ H 2
Na + H 2 O → NaOH + ½ H 2
2KOH + H 2 SO 4 → K 2 SO 4 + H 2 O
2NaOH + H 2 SO 4 → Na 2 SO 4 + H 2 O
n H2SO4 = 0,2.0,1 = 0,02 mol
Ta thấy: n KOH + n NaOH = 2. n H2SO4 = 0,04 mol
n H2 = \(\frac{1}{2}.({n_{NaOH}} + {n_{K{\rm{O}}H}})\)= 0,04 : 2 =0,02 mol
Đáp án C
24.38
Độ hòa tan của NaHCO 3 ở 20 o C và 60 o C lần lượt là 9,6 và 16,5 g/100 g H 2 O. Để 1 tấn dung dịch NaHCO 3 bão hòa ở 60 o C làm nguội về 20 o C (giả thiết không có sự bay hơi của nước), thu được dung dịch X và a kg chất rắn khan. Giá trị của a là
A. 59,23. B. 69,00. C. 54,04. D. 96,00.
Phương pháp giải:
Dựa vào tính chất của kim loại IA.
Lời giải chi tiết:
Ở 60 o C NaHCO 3 tan được 16,5 gam trong 100 gam H 2 O => \({m_{dd}} = 16,5 + 100 = 116,5{\rm{ gam}}\)
Ở 20 o C NaHCO 3 tan được 9,6 gam trong 100 gam H 2 O tương đương với thoát ra chất rắn không tan NaHCO 3 là \({m_{ket{\rm{ tinh}}}} = 16,5 - 9,6 = 6,9{\rm{ gam}}\)
1 tấn dung dịch NaHCO 3 ở 60 o C khi hạ nhiệt độ xuống 20 o C sẽ kết tinh được
\(m = \frac{{{{10}^6}.6,9}}{{116,5}} = 59227,5{\rm{ gam}} = 59,2275{\rm{ kg}}\)
24.39
Hãy chọn đúng hoặc sai cho mỗi ý a, b, c, d ở các câu 24.39 – 24.40
a) Thứ tự giảm dần của các kim loại kiềm là: Cs, Rb, K, Na, Li.
b) Phương pháp chung để điều chế kim loại kiềm là điện phân dung dịch.
c) Để bảo quản kim loại Na cần ngâm Na trong cồn tinh khiết.
d) Na 2 O tan trong nước tạo dung dịch trong suốt và thoát ra khí H 2 .
Phương pháp giải:
Dựa vào cách bảo quản kim loại IA.
Lời giải chi tiết:
a) đúng; ngược lại, đi từ trên xuống dưới tính kim loại giảm dần
b) sai; nói đúng hơn phải là điện phân nóng chảy
c) sai; Na tác dụng với các chất có gốc OH, nên chỉ được bảo quản trong dầu hỏa
d) sai; Na 2 O tác dụng với H 2 O chỉ sinh ra NaOH không có khí H 2 .
24.40
a) Điện phân dung dịch NaCl có màng ngăn xốp thu được NaOH, H 2 , O 2 .
b) NaHCO 3 là hợp chất lưỡng tính.
c) Na 2 CO 3 là nguyên liệu sản xuất thủy tinh.
d) Phương pháp Solvay sản xuất NaHCO 3 từ nguyên liệu là NH 3 , NaCl và CO 2 .
Phương pháp giải:
Dựa vào Phương pháp điều chế kim loại IA và các hợp chất IA.
Lời giải chi tiết:
a) sai; khi điện phân có màng ngăn xốp ta sẽ thu được Cl 2 ở điện cực dương, và H 2 , NaOH ở điện cực âm
b) đúng; NaHCO 3 có thể tác dụng với acid hoặc base
\(HCO_3^ - \) → \(CO_3^{2 - }\) + H +
\(HCO_3^ - \)+ H 2 O → H 2 CO 3 (H 2 O + CO 2 ) + OH -
c) đúng; Na 2 CO 3 còn gọi là soda, là một trong những nguyên liệu quan trọng cùng với cát (SiO 2 ) và đá vôi (CaCO 3 ), Na 2 CO 3 đóng vai trò quan trọng trong quá trình nấu chảy và tạo thành thủy tinh. Cụ thể, nó giúp giảm nhiệt độ nấu chảy của hỗn hợp và tạo ra một hỗn hợp lỏng đồng nhất.
d) đúng; dưới đây là mô hình của Phương pháp solvay.
24.41
Nhỏ từ từ từng giọt đến hết 150 mL dung dịch HCl 1 M vào 100 mL dung dịch gồm Na 2 CO 3 0,5 M và NaHCO 3 1 M. Sau phản ứng thu được số mol CO 2 là bao nhiêu?
Phương pháp giải:
Dựa vào tính chất hóa học kim loại IA.
Lời giải chi tiết:
\({n_{{H^ + }}} = {n_{HCl}} = 0,15{\rm{ mol; }}{n_{N{a_2}C{O_3}}} = 0,1.0,5 = 0,05{\rm{ mol; }}{n_{NaHC{O_3}}} = 0,1\;{\rm{mol}}\)
Khi nhỏ từ từ dung dịch HCl vào dung dịch gồm Na 2 CO 3 và NaHCO 3 xảy ra các phản ứng ion thu gọn sau:
H + + \(CO_3^{2 - }\) → \(HCO_3^ - \) (1)
0,07 ←0,05 → 0,05
\(HCO_3^ - \) + H + → CO 2 + H 2 O (2)
0,1 → 0,1
Dựa vào 2 phản ứng này, ta tính toán được
n \(HCO_3^ - \)(1) = 0,05 + 0,1 = 0,15 mol; n H+ dư (1) = 0,15 – 0,05 = 0,1 mol
→ n CO2 = 0,1 mol → V CO2 = 0,1.24,79 = 2,479L
24.42
Hấp thụ hoàn toàn 2,479 lit CO 2 (đkc) vào 100 mL dung dịch gồm K 2 CO 3 0,2 M và KOH nồng độ C mol/L. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl 2 dư, thu được 11,82 gam kết tủa. Giá trị của C là bao nhiêu?
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại IA.
Lời giải chi tiết:
\({n_{C{O_2}}} = \frac{{2,479}}{{24,79}} = 0,1{\rm{ mol; }}{n_{{K_2}C{O_3}}} = 0,1.0,2 = 0,02{\rm{ mol; }}{n_{KOH}} = 0,1C{\rm{ mol}}\)
Các phản ứng xảy ra:
2KOH + CO 2 → K 2 CO 3 + H 2 O (1)
KOH + CO 2 → KHCO 3 (2)
Dung dịch Y tác dụng với dung dịch BaCl 2 nên ta có phương trình ion thu gọn:
\(CO_3^{2 - } + B{a^ + } \to BaC{O_3}\)
n BaCO3 = 11,82 : 197 = 0,06 mol
Bảo toàn nguyên tố ta thấy: n BaCO3 < n C => Không có phản ứng (2)
Tổng n \(CO_3^{2 - }\) = 0,06 = n K2CO3 + n K2CO3 (1)
Coi như lượng \(CO_3^{2 - }\) do KOH sinh ra thêm là: 0,06 – 0,02 = 0,04 mol
→ n OH - = n CO2 + n \(CO_3^{2 - }\) = 0,1 + 0,04 = 0,14 mol = n KOH = 0,1C → C = 1,4M