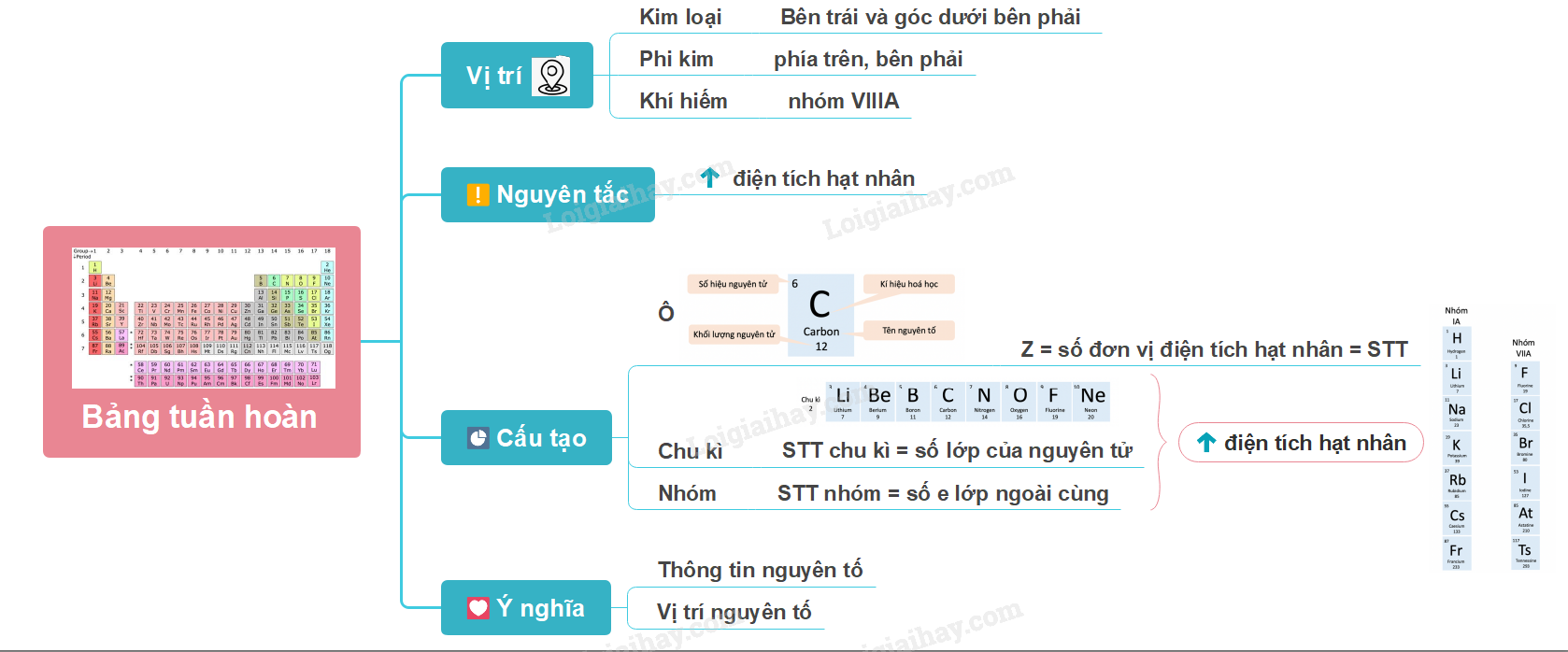
Lý thuyết bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học - KHTN 7 Cánh Diều
Sơ lược về bảng tuần hoàn các nguyên tố hóa học: ô nguyên tố, chu kì, nhóm
Lý thuyết: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
I. Nguyên tắc sắp xếp bảng tuần hoàn các nguyên tố hóa học
- Các nguyên tố hóa học được sắp xếp theo quy luật trong một bảng gọi là bảng tuần hoàn các nguyên tố hóa học (gọi tắt là bảng tuần hoàn)
- Bảng tuần hoàn hiện nay có 118 nguyên tố hóa học được sắp xếp theo chiều tăng dần điện tích hạt nhân nguyên tử
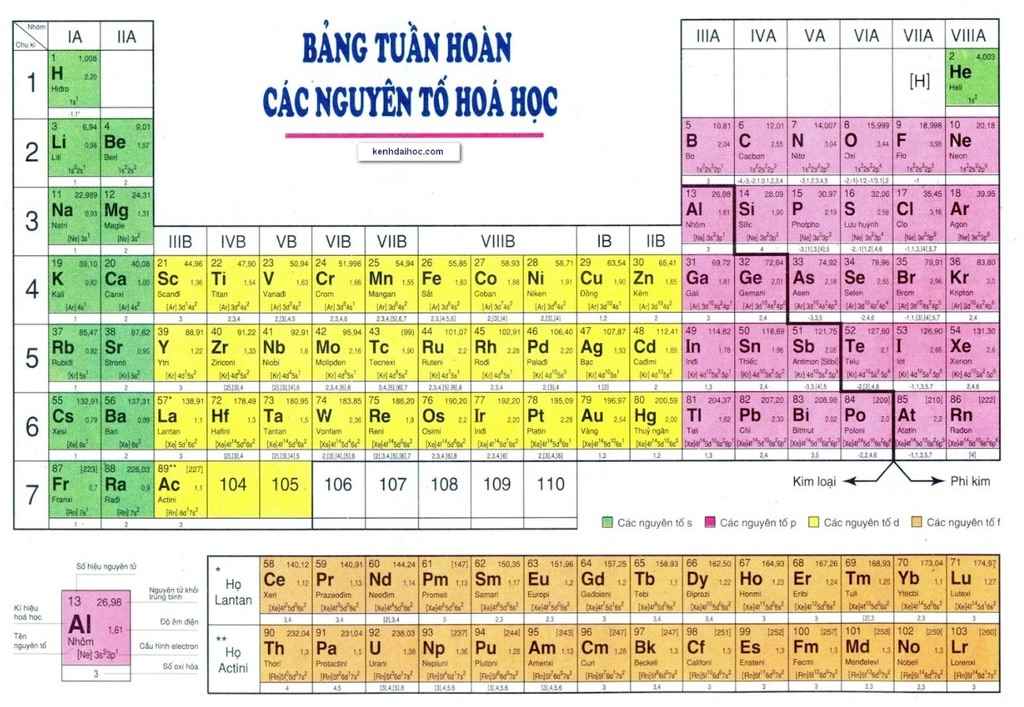
II. Cấu tạo bảng tuần hoàn
Bảng tuần hoàn gồm các ô được sắp xếp thành các hàng và các cột
1. Ô nguyên tố
- Mỗi nguyên tố hóa học được sắp xếp vào một ô của bảng tuần hoàn, được gọi là ô nguyên tố
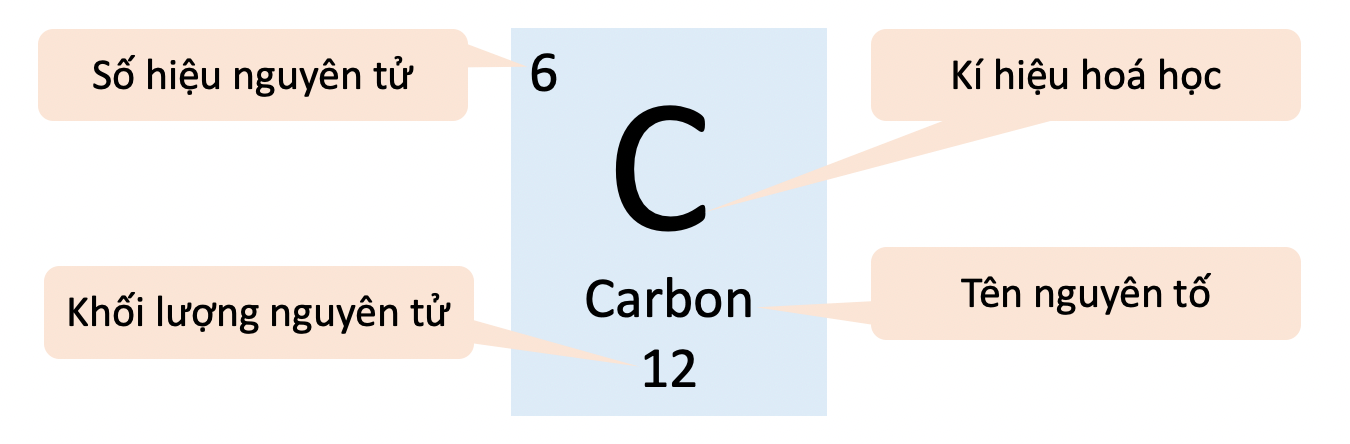
- Ô nguyên tố cho biết:
+ Số hiệu nguyên tử (Z)
+ Kí hiệu hóa học
+ Tên nguyên tố
+ Khối lượng nguyên tử
- Số hiệu nguyên tử (Z) bằng số đơn vị điện tích hạt nhân, và cũng là số thứ tự của nguyên tố trong bảng tuần hoàn
2. Chu kì
- Chu kì gồm các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được sắp xếp thành hàng theo chiều tăng dần của điện tích hạt nhân
- Số thứ tự của chu kì bằng số lớp electron trong nguyên tử của các nguyên tố trong chu kì đó
- Bảng tuần hoàn hiện này gồm 7 chu kì, được đánh số từ 1 đến 7
- Chu kì 1:
+ Gồm 2 nguyên tố (H và He)
+ Số lớp electron: 1
+ Điện tích hạt nhân tăng từ H (+1) đến He (+2)

Mô hình cấu tạo nguyên tử hydrogen và helium
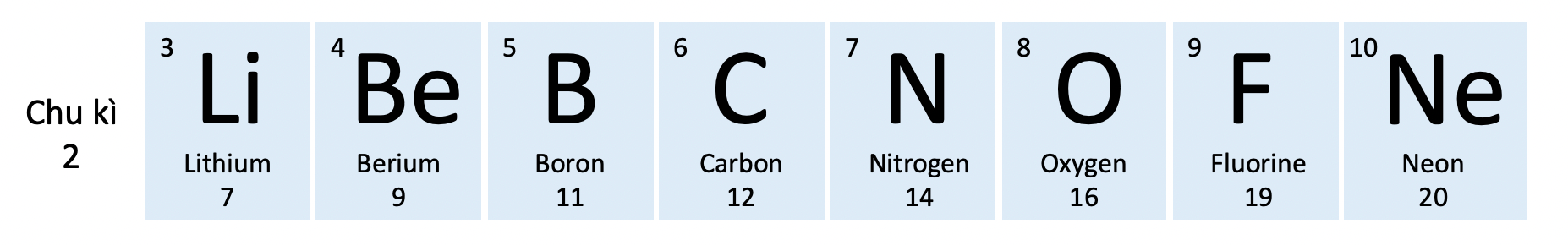
- Chu kì 2:
+ Gồm 8 nguyên tố (từ Li đến Ne)
+ Số lớp electron: 2
+ Điện tích hạt nhân tăng dần từ Li (+3) đến Ne (+10)
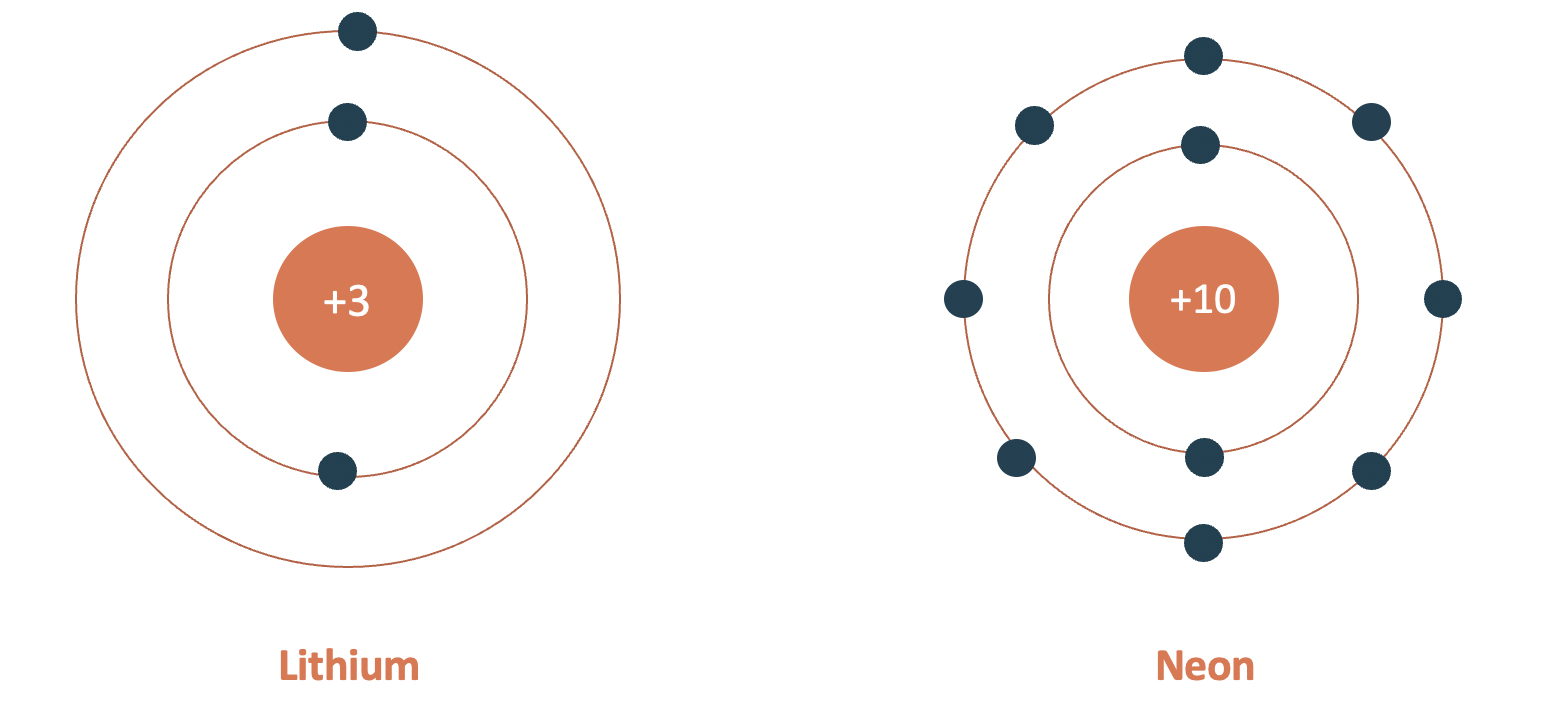
Mô hình cấu tạo nguyên tử lithium và neon
- Chu kì 3:
+ Gồm 8 nguyên tố (từ Na đến Ar)
+ Số lớp electron: 3
+ Điện tích hạt nhân tăng từ Na (+11) đến Ar (+18)
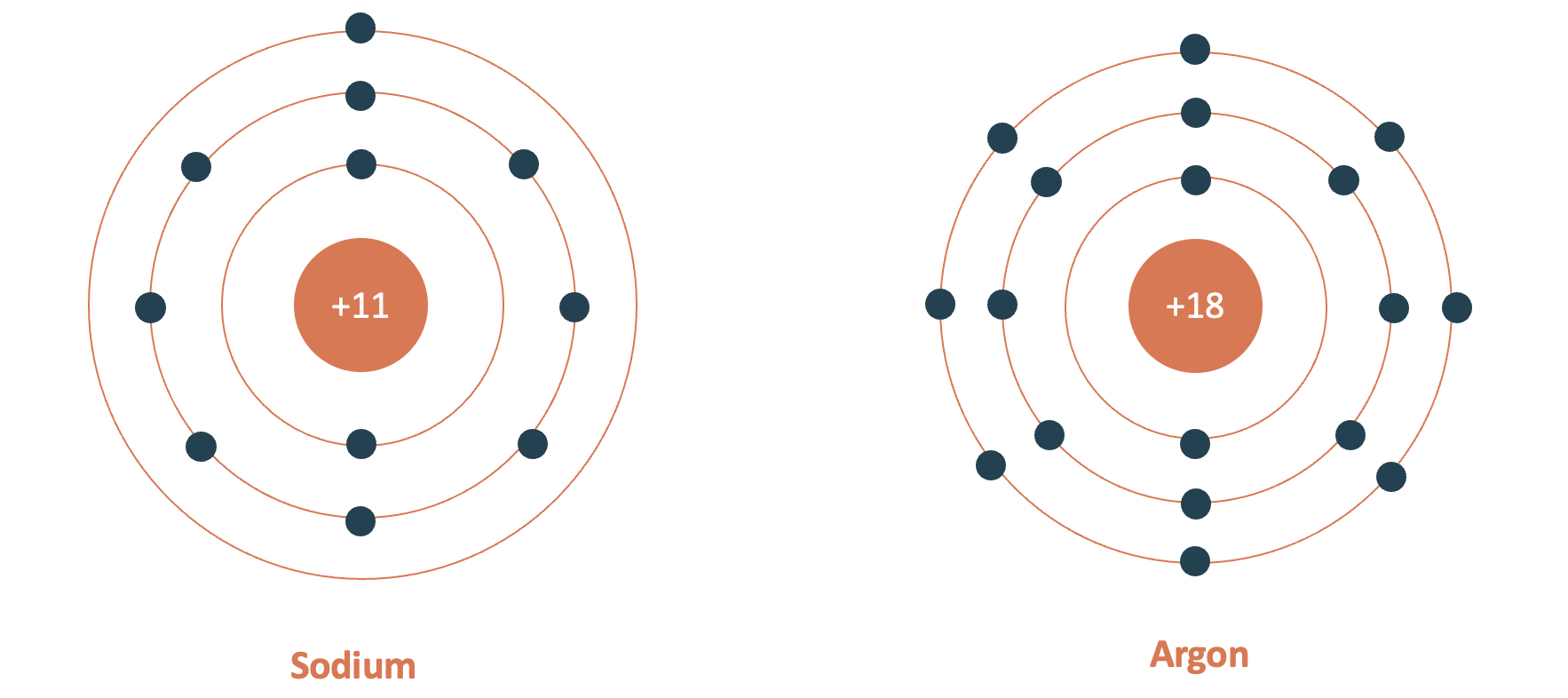
Mô hình cấu tạo nguyên tử sodium và argon
- Trong một chu kì, khi đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân
+ Mở đầu chu kì là một kim loại điển hình (trừ chu kì 1)
+ Cuối chu kì là một phi kim điển hình
+ Kết thúc chu kì là một khí hiếm
Ví dụ: Trong chu kì 3:
+ Mở đầu chu kì là nguyên tố sodium (Na), là một kim loại điển hình
+ Cuối chu kì là nguyên tố chlorine (Cl), là một phi kim điển hình
+ Kết thúc chu kì là nguyên tố khí hiếm argon (Ar)
3. Nhóm
- Nhóm gồm các nguyên tố có tính chất hóa học tương tự nhau, được xếp thành cột theo chiều tăng dần của điện tích hạt nhân
- Bảng tuần hoàn gồm 18 cột, trong đó có 8 cột là nhóm A và 10 cột là nhóm B.
- Nhóm A được đánh số thứ tự bằng số La Mã lần lượt từ nhóm IA đến nhóm VIIIA.
- Số thứ tự của nhóm A bằng số electron lớp ngoài cùng trong nguyên tử của nguyên tố thuộc nhóm đó.
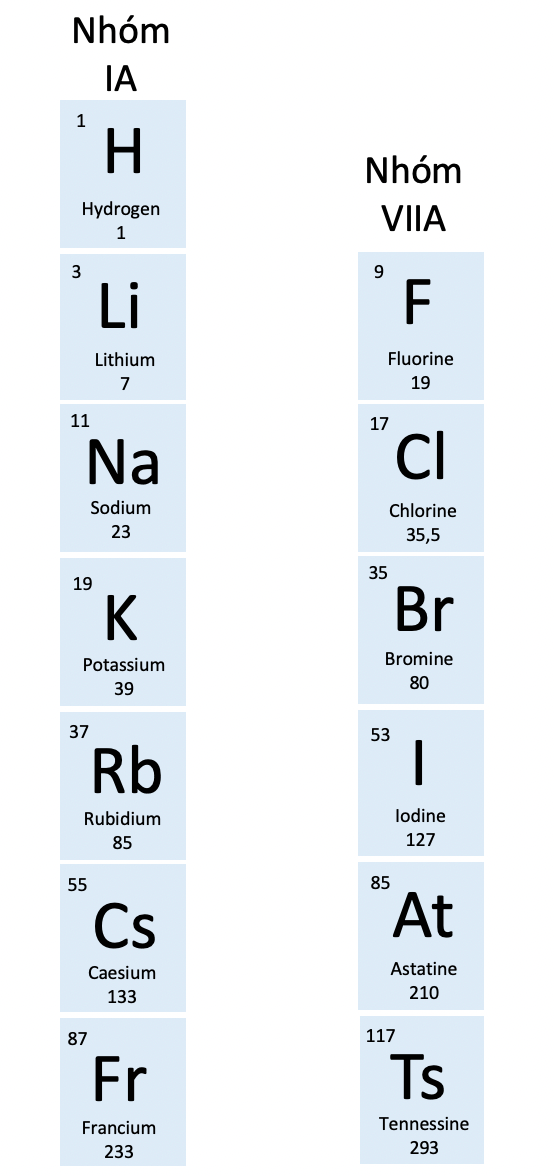
- Nhóm IA:
+ Gồm các nguyên tố kim loại hoạt động mạnh (kim loại điển hình) trừ hydrogen
+ Số electron lớp ngoài cùng: 1
+ Điện tích hạt nhân của nguyên tử kim loại tăng dần từ Li (+3) đến Fr (+87)
- Nhóm VIIA:
+ Gồm các nguyên tố phi kim hoặt động mạnh (phi kim điển hình) trừ tennesine
+ Số electron lớp ngoài cùng: 7
+ Điện tích hạt nhân của nguyên tử phi kim tăng dần từ F (+9) đến At (+85)
- Nhóm VIIIA:
+ Gồm các nguyên tố khí hiếm
+ Số electron lớp ngoài cùng: 8 (trừ helium)
+ Điện tích hạt nhân tăng dần từ He (+2) đến Og (+118)
III. Vị trí của các nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn
- Các nguyên tố hóa học được chia làm 3 loại: kim loại, phi kim và khí hiếm
a) Kim loại
- Các nguyên tố kim loại nằm ở phía bên trái và góc dưới bên phải của bảng tuần hoàn
- Các nguyên tố nhóm IA (trừ hydrogen) đều là kim loại điển hình
b) Phi kim
- Các nguyên tố phi kim nằm ở phía trên, bên phải của bảng tuần hoàn
- Các nguyên tố nhóm VIIA hầu hết đều là phi kim điển hình (flourine là phi kim hoạt động mạnh nhất)
c) Khí hiếm
- Tất cả các nguyên tố nằm trong nhóm VIIIA được gọi là nguyên tố khí hiếm
IV. Ý nghĩa của bảng tuần hoàn
- Bảng tuần hoàn cho biết:
+ Các thông tin của một nguyên tố hóa học
+ Vị trí của một nguyên tố hóa học, phi kim hay khí hiếm
Ví dụ 2: Sử dụng bảng tuần hoàn để biết được, nguyên tố lưu huỳnh (S)
+ Ở ô số 16, chu kfi 3, nhóm VIA
+ Là nguyên tố phi kim