Trắc nghiệm Bài 15. Phản ứng oxi hóa - khử - Hóa 10 Kết nối tri thức
Đề bài
Số oxi hóa của nitơ trong NH 4 + , NO 2 - , và HNO 3 lần lượt là:
-
A.
+5, -3, +3.
-
B.
-3, +3, +5
-
C.
+3, -3, +5
-
D.
+3, +5, -3.
Số oxi hóa của Mn, Fe trong Fe 3+ , S trong SO 3 , P trong PO 4 3- lần lượt là:
-
A.
0, +3, +6, +5
-
B.
0, +3, +5, +6
-
C.
+3, +5, 0, +6
-
D.
+5, +6, +3, 0.
Phản ứng nào là phản ứng oxi hoá - khử?
-
A.
2HgO \( \xrightarrow[]{t^{0}}\) 2Hg + O 2
-
B.
СаСОз \( \xrightarrow[]{t^{0}}\) CaO + CO 2 .
-
C.
2Al(OH) 3 \( \xrightarrow[]{t^{0}}\) Al 2 O 3 + 3H 2 O
-
D.
2NaHCO 3 \( \xrightarrow[]{t^{0}}\) Na 2 CO3 + CO 2 + H 2 O
Ở phản ứng nào NH 3 không đóng vai trò chất khử ?
-
A.
4NH 3 + 5O 2 \(\xrightarrow[{xt}]{{{t^0}}}\) 4NO + 6H 2 O
-
B.
2NH 3 + 3Cl 2 —> N 2 + 6HCl
-
C.
NH 3 + 3CuO \(\xrightarrow{{{t^0}}}\) 3Cu + N 2 + 3H 2 O
-
D.
2NH 3 + H 2 O 2 + MnS0 4 —> Mn0 2 + (NH 4 ) 2 SO 4 .
-
A.
Chỉ là chất oxí hoá.
-
B.
Chỉ là chất khử.
-
C.
Là chất oxi hoá, nhưng đồng thời cũng là chất khử.
-
D.
Không là chất oxi hoá, không là chất khử.
Phản ứng nào là phản ứng oxi hoá - khử?
-
A.
HNO 3 + NaOH → NaNO 3 + H 2 O
-
B.
N 2 O 5 + H 2 O → 2HNO 3
-
C.
2HNO 3 + 3H 2 S → 3S + 2NO + 4H 2 O
-
D.
2Fe(OH) 3 → Fe 2 O 3 + 3H 2 O.
Cho sơ đồ phản ứng :
\(F{e_3}{O_4} + HN{O_3} \to Fe{\left( {N{O_3}} \right)_3} + NO + {H_2}O\)
Cân bằng PTHH của phản ứng trên. Các hệ số tương ứng với phân tử các chất là dãy số nào sau đây ?
-
A.
3, 14, 9, 1, 7
-
B.
3, 28, 9, 1, 14
-
C.
3, 26, 9, 2, 13
-
D.
2, 28, 6, 1, 14
Trong phản ứng đốt cháy \(CuFeS_2\) tạo ra sản phẩm \(CuO, Fe_2O_3\) và \(SO_2\) thì một phân tử \(CuFeS_2\) sẽ
-
A.
nhận 13e.
-
B.
nhận 12e.
-
C.
nhường 13e.
-
D.
nhường 12e.
Cho phản ứng : M 2 O x + HN0 3 —> M(NO 3 ) 3 + ...
Khi x có giá trị là bao nhiêu thì phản ứng trên không thuộc loại phản ứng oxi hoá - khử ?
-
A.
x = 1
-
B.
x = 2
-
C.
x = 1 hoặc x = 2
-
D.
x = 3
Trong phản ứng: \(C{l_2} + {H_2}O \to HCl + HClO\), các nguyên tử Cl
-
A.
bị oxi hoá.
-
B.
bị khử.
-
C.
vừa bị oxi hoá, vừa bị khử.
-
D.
không bị oxi hoá, không bị khử.
Để oxi hóa hoàn toàn 0,1 mol hỗn hợp gồm Al và Fe cần dùng V lít O 2 (đkc). Giá trị của V là
-
A.
2,240 lít .
-
B.
1,680 lít.
-
C.
1,860 lít .
-
D.
2,688 lít.
Cho 3,7185 lít khí Cl 2 tác dụng với bột Fe (dư). Sau khi phản ứng hoàn toàn thu được m gam muối. Giá trị của m là
-
A.
19,05
-
B.
16,25
-
C.
15,48
-
D.
17,08
Cho 4,33825 lít (đkc) hỗn hợp khí X gồm Cl 2 và O 2 phản ứng vừa đủ với 5,55 gam hỗn hợp Y gồm Mg và Al, thu được 15,05 gam hỗn hợp Z . Phần trăm khối lượng của Mg trong Y là
-
A.
51,35%.
-
B.
75,68%.
-
C.
24,32%.
-
D.
48,65%.
Hỗn hợp X gồm Cl 2 và O 2 phản ứng vừa hết với 9,6 gam Mg và 16,2 gam Al tạo ra 74,1 gam hỗn hợp muối chloride và oxide. Thành phần % theo khối lượng của Cl 2 trong X là
-
A.
50%.
-
B.
73,5%.
-
C.
66,67%.
-
D.
44,44%.
Cho 19,2g Cu phản ứng với 500ml dung dịch NaNO 3 1M và 500ml HCl 2M thu được V lít NO (sản phẩm khử duy nhất ở đkc). Giá trị của V là
-
A.
6,19 lít
-
B.
4,958 lít
-
C.
3,714 lít
-
D.
2,24 lít
Trộn 8,4 gam bột Fe và 3,2 gam bột S, đun nóng hỗn hợp (không có không khí) cho phản ứng xảy ra hoàn toàn. Sản phẩm thu được hòa tan hoàn toàn trong dung dịch H 2 SO 4 đặc nóng thấy thoát ra V lít khí SO 2 (ở đkc). Giá trị của V là
-
A.
10,523 lít.
-
B.
7,28 lít.
-
C.
1,4856 lít.
-
D.
13,014lít.
Tiến hành các thí nghiệm sau:
a) Sục khí etilen vào dung dịch KMnO 4 loãng.
b) Cho hơi ancol etylic đi qua bột CuO nung nóng.
c) Sục khí etilen vào dung dịch Br 2 trong CCl 4 .
d) Cho dung dịch glucozơ vào dung dịch AgNO 3 trong NH 3 dư, đun nóng.
e) Cho Fe 2 O 3 vào dung dịch H 2 SO 4 đặc, nóng.
Trong các thí nghiệm trên, số thí nghiệm có xảy ra phản ứng oxi hóa - khử là
-
A.
3
-
B.
4
-
C.
2
-
D.
5
Cho từng chất Fe, FeS, FeO, Fe 2 O 3 , Fe 3 O 4 , Fe(OH) 2 , Fe(OH) 3 , FeBr 2 , FeBr 3 , FeCl 2 , FeCl 3 lần lượt tác dụng với dung dịch H 2 SO 4 đặc, nóng. Số trường hợp xảy ra phản ứng oxi hóa-khử là:
-
A.
9
-
B.
10
-
C.
8
-
D.
7
Lời giải và đáp án
Số oxi hóa của nitơ trong NH 4 + , NO 2 - , và HNO 3 lần lượt là:
-
A.
+5, -3, +3.
-
B.
-3, +3, +5
-
C.
+3, -3, +5
-
D.
+3, +5, -3.
Đáp án : B
Trong hầu hết các hợp chất lấy
H có hóa trị I => số oxi hóa là +1
O có hóa trị II => số oxi hóa là -2
Tất cả các kim loại kiềm, kiềm thổ có hóa trị ứng với số nhóm trong bảng tuần hoàn => có số oxi hóa + 1; + 2
Nguyên tử luôn trung hòa về điện => tổng số oxi hóa của các chất trong phân tử = 0 => từ đó tính được số oxi hóa của các chất chưa biết.
Gọi số oxi hóa của N trong các hợp chất là x
Ta có: NH 4 + : x + 4 = 1 \( \to\) x = -3 \( \to\) số oxi hóa của N trong NH 4 + là -3
NO 2 - : x + 2.(-2) = -1 \( \to\) x = 3 \( \to\) số oxi hóa của N trong NO 2 - là +3
HNO 3 : 1 + x + 3.(-2) = 0 \( \to\) x = 5 \( \to\) số oxi hóa của N trong HNO 3 là +5
Số oxi hóa của Mn, Fe trong Fe 3+ , S trong SO 3 , P trong PO 4 3- lần lượt là:
-
A.
0, +3, +6, +5
-
B.
0, +3, +5, +6
-
C.
+3, +5, 0, +6
-
D.
+5, +6, +3, 0.
Đáp án : A
Trong hầu hết các hợp chất lấy
H có hóa trị I => số oxi hóa là +1
O có hóa trị II => số oxi hóa là -2
Tất cả các kim loại kiềm, kiềm thổ có hóa trị ứng với số nhóm trong bảng tuần hoàn => có số oxi hóa + 1; + 2
Nguyên tử luôn trung hòa về điện => tổng số oxi hóa của các chất trong phân tử = 0 => từ đó tính được số oxi hóa của các chất chưa biết.
Mn là đơn chất nên có số oxi hóa 0
Fe 3+ có số oxi hóa +3
SO 3 : x + 3.(-2) = 0 \( \to\) x = 6 \( \to\) số oxi hóa của S là +6
PO 4 3- : x + 4.(-2) = -3 \( \to\) x = 5 \( \to\) số oxi hóa của P là +5
Phản ứng nào là phản ứng oxi hoá - khử?
-
A.
2HgO \( \xrightarrow[]{t^{0}}\) 2Hg + O 2
-
B.
СаСОз \( \xrightarrow[]{t^{0}}\) CaO + CO 2 .
-
C.
2Al(OH) 3 \( \xrightarrow[]{t^{0}}\) Al 2 O 3 + 3H 2 O
-
D.
2NaHCO 3 \( \xrightarrow[]{t^{0}}\) Na 2 CO3 + CO 2 + H 2 O
Đáp án : A
Phản ứng oxi hóa khử là phản ứng hóa học trong đó đồng thời xảy ra sự oxi hóa và sự khử. Tức số oxi hóa của các chất trước và sau phản ứng thay đổi.
Những phản ứng theo đề bài cho, phản ứng oxi hóa khử là
\(2HgO\xrightarrow{{{t^0}}}2Hg + {O_2}\)
Hg 2+ + 2e \( \to\) Hg 0
2O 2- \( \to\) O 2 + 4e
Còn các phản ứng khác không phải là phản ứng oxi hóa khử
Ở phản ứng nào NH 3 không đóng vai trò chất khử ?
-
A.
4NH 3 + 5O 2 \(\xrightarrow[{xt}]{{{t^0}}}\) 4NO + 6H 2 O
-
B.
2NH 3 + 3Cl 2 —> N 2 + 6HCl
-
C.
NH 3 + 3CuO \(\xrightarrow{{{t^0}}}\) 3Cu + N 2 + 3H 2 O
-
D.
2NH 3 + H 2 O 2 + MnS0 4 —> Mn0 2 + (NH 4 ) 2 SO 4 .
Đáp án : D
NH 3 đóng vai trò là chất khử khi số oxi hóa của NH 3 tăng sau phản ứng => các phản ứng còn lại NH 3 sẽ đóng vai trò là chất oxi hóa
A,B,C số oxi hóa của NH 3 đều tăng sau phản ứng => đóng vai trò là chất khử
=> ở phản ứng D NH 3 đóng vai trò là môi trường
-
A.
Chỉ là chất oxí hoá.
-
B.
Chỉ là chất khử.
-
C.
Là chất oxi hoá, nhưng đồng thời cũng là chất khử.
-
D.
Không là chất oxi hoá, không là chất khử.
Đáp án : C
Chất oxi hóa là chất nhận e (tham gia quá trình khử)
Chất khử là chất cho e (tham gia quá trình oxi hóa)
NO 2 đóng vai trò vừa là chất oxi hoá vừa là chất khử
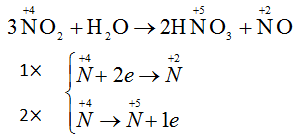
Quá trình 1 là quá trình khử
Quá trình 2 là quá trình oxi hóa
Phản ứng nào là phản ứng oxi hoá - khử?
-
A.
HNO 3 + NaOH → NaNO 3 + H 2 O
-
B.
N 2 O 5 + H 2 O → 2HNO 3
-
C.
2HNO 3 + 3H 2 S → 3S + 2NO + 4H 2 O
-
D.
2Fe(OH) 3 → Fe 2 O 3 + 3H 2 O.
Đáp án : C
Phản ứng oxi hóa khử là phản ứng hóa học trong đó đồng thời xảy ra sự oxi hóa và sự khử( tức các chất có sự thay đổi số oxi hóa trước và sau phản ứng) => tìm ra được phản ứng oxi hóa khử.
Trong các phản ứng trên chi có phản ứng C là phản ứng oxi hoá - khử vì có sự thay đổi số oxi hoá của các nguyên tố.
![]()
Cho sơ đồ phản ứng :
\(F{e_3}{O_4} + HN{O_3} \to Fe{\left( {N{O_3}} \right)_3} + NO + {H_2}O\)
Cân bằng PTHH của phản ứng trên. Các hệ số tương ứng với phân tử các chất là dãy số nào sau đây ?
-
A.
3, 14, 9, 1, 7
-
B.
3, 28, 9, 1, 14
-
C.
3, 26, 9, 2, 13
-
D.
2, 28, 6, 1, 14
Đáp án : B
Cân bằng PTHH theo phương pháp thăng bằng electron
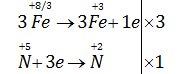
\(3F{e_3}{O_4} + 28HN{O_3} \to 9Fe{\left( {N{O_3}} \right)_3} + NO + 14{H_2}O\)
Trong phản ứng đốt cháy \(CuFeS_2\) tạo ra sản phẩm \(CuO, Fe_2O_3\) và \(SO_2\) thì một phân tử \(CuFeS_2\) sẽ
-
A.
nhận 13e.
-
B.
nhận 12e.
-
C.
nhường 13e.
-
D.
nhường 12e.
Đáp án : C
Viết quá trình oxi hóa của \(CuFeS_2\)
\(\mathop {CuFe{S_2}}\limits^0 \to \mathop {Cu}\limits^{ + 2} + \mathop {Fe}\limits^{ + 3} + 2\mathop S\limits^{ + 4} + 13e\)
=> 1 phân tử \(CuFeS_2\) nhường 13e
Cho phản ứng : M 2 O x + HN0 3 —> M(NO 3 ) 3 + ...
Khi x có giá trị là bao nhiêu thì phản ứng trên không thuộc loại phản ứng oxi hoá - khử ?
-
A.
x = 1
-
B.
x = 2
-
C.
x = 1 hoặc x = 2
-
D.
x = 3
Đáp án : D
Để phản ứng không là phản ứng oxi hóa khử khi số oxi hóa của các nguyên tố trong phản ứng không thay đổi
Vì x = 3 thì số oxi hóa của M trước và sau phản ứng không thay đổi vẫn là +3
Trong phản ứng: \(C{l_2} + {H_2}O \to HCl + HClO\), các nguyên tử Cl
-
A.
bị oxi hoá.
-
B.
bị khử.
-
C.
vừa bị oxi hoá, vừa bị khử.
-
D.
không bị oxi hoá, không bị khử.
Đáp án : C
Xác định số oxi hóa của Cl trước và sau phản ứng
Số oxi hóa tăng => Chất khử, bị oxi hóa
Số oxi hóa giảm => Chất oxi hóa, bị khử
Ta có:
\({\mathop {Cl_2}\limits^0} + {H_2}O \to H\mathop {Cl}\limits^{ - 1} + H\mathop {Cl}\limits^{ + 1} O\)
Số oxi hóa của Cl vừa tăng, vừa giảm => Cl vừa bị oxi hoá, vừa bị khử.
Để oxi hóa hoàn toàn 0,1 mol hỗn hợp gồm Al và Fe cần dùng V lít O 2 (đkc). Giá trị của V là
-
A.
2,240 lít .
-
B.
1,680 lít.
-
C.
1,860 lít .
-
D.
2,688 lít.
Đáp án : C
Dựa vào phương pháp bảo toàn electron
Vì hỗn hợp gồm Al và Fe đều nhường 3 electron => n e nhường = 0,1 . 3 = 0,3 mol
\(\begin{array}{l}{\mathop O\limits^o _2}{\rm{ }} + {\rm{ }}4e{\rm{ }} \to {O^{ + 2}}\\{\rm{0,075}} \leftarrow {\rm{0,3}}\end{array}\)
V O2 = 0,075. 24,79 = 1,86 lít
Cho 3,7185 lít khí Cl 2 tác dụng với bột Fe (dư). Sau khi phản ứng hoàn toàn thu được m gam muối. Giá trị của m là
-
A.
19,05
-
B.
16,25
-
C.
15,48
-
D.
17,08
Đáp án : B
\(\begin{array}{l}3C{l_2} + 2Fe \to 2FeC{l_3}\\0,15 \to {\rm{ 0,1}}\\{{\rm{m}}_{FeCl3}} = 0,1.162,5 = 16,25g\end{array}\)
Đáp án B
Cho 4,33825 lít (đkc) hỗn hợp khí X gồm Cl 2 và O 2 phản ứng vừa đủ với 5,55 gam hỗn hợp Y gồm Mg và Al, thu được 15,05 gam hỗn hợp Z . Phần trăm khối lượng của Mg trong Y là
-
A.
51,35%.
-
B.
75,68%.
-
C.
24,32%.
-
D.
48,65%.
Đáp án : B
Dựa vào phương pháp bảo toàn khối lượng và bảo toàn electron
n X = 4,33825 : 24,79 = 0,175 mol
Bảo toàn khối lượng: m X + m Y = m Z => m X = 15,05 – 5,55 = 9,5g
Gọi số mol của Cl 2 và O 2 lần lượt là a và b (mol)
Ta có: n Cl2 + n O2 = 0,175 => a + b = 0,175 (1)
m Cl2 + m O2 = 9,5 => 71a + 32b = 9,5 (2)
từ (1) và (2) ta có: a = 0,1 và b = 0,075
gọi số mol của Mg và Al lần lượt là x và y (mol)
\(\begin{array}{l}M{g^0} \to M{g^{ + 2}} + 2e {\rm{ Cl}}_2^0 + 2e \to C{l^{ - 1}}\\x \to {\rm{ 2x 0,1}} \to {\rm{0,2}}\\{\rm{A}}{{\rm{l}}^0} \to A{l^{ + 3}} + 3e{\rm{ O}}_2^0{\rm{ }} + {\rm{ }}4e \to {{\rm{O}}^{ - 2}}{\rm{ }}\\y \to {\rm{ 3y 0,075}} \to 0,3\end{array}\)
Theo định luật bảo toàn electron:
2x + 3y = 0,2 + 0,3
24x + 27y = 5,55
=> x = 0,175; y = 0,05
%Mg = 75,65%
Hỗn hợp X gồm Cl 2 và O 2 phản ứng vừa hết với 9,6 gam Mg và 16,2 gam Al tạo ra 74,1 gam hỗn hợp muối chloride và oxide. Thành phần % theo khối lượng của Cl 2 trong X là
-
A.
50%.
-
B.
73,5%.
-
C.
66,67%.
-
D.
44,44%.
Đáp án : B
Dựa vào định luật bảo toàn khối lượng và bảo toàn electron
n Mg = 9,6 : 24 = 0,4 mol; n Al = 16,2 : 27 = 0,6 mol
Gọi số mol Cl 2 và O 2 lần lượt là x và y mol
Bảo toàn khối lượng: m X + m Mg + m Al = m hỗn hợp => m X = 74,1 – 9,6 – 16,2 = 48,3g
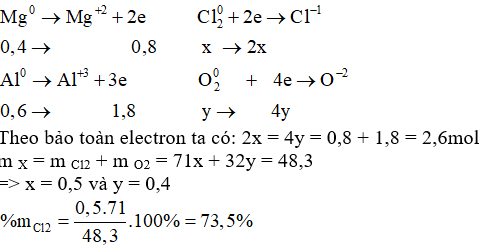
Cho 19,2g Cu phản ứng với 500ml dung dịch NaNO 3 1M và 500ml HCl 2M thu được V lít NO (sản phẩm khử duy nhất ở đkc). Giá trị của V là
-
A.
6,19 lít
-
B.
4,958 lít
-
C.
3,714 lít
-
D.
2,24 lít
Đáp án : B
Dựa vào phương pháp bảo toàn electron
\(\begin{array}{l}3C{u^0} + 8{H^ + } + 2NO_3^ - \to 3C{u^{2 + }} + 2NO + 4{H_2}O\\0,3{\rm{ 1 0,5}}\end{array}\)
Xét tỉ lệ mol: n Cu hết; n NO 3 - và H + dư
n NO = (0,3.2) : 3 = 0,1 mol => V NO = 0,2 . 24,79 = 4,958 lít
đáp án B
Trộn 8,4 gam bột Fe và 3,2 gam bột S, đun nóng hỗn hợp (không có không khí) cho phản ứng xảy ra hoàn toàn. Sản phẩm thu được hòa tan hoàn toàn trong dung dịch H 2 SO 4 đặc nóng thấy thoát ra V lít khí SO 2 (ở đkc). Giá trị của V là
-
A.
10,523 lít.
-
B.
7,28 lít.
-
C.
1,4856 lít.
-
D.
13,014lít.
Đáp án : A
n Fe = 8,4 : 56 = 0,15 mol; n S = 3,2 : 32 = 0,1 mol
giả sử hỗn hợp Fe và S không phản ứng với nhau, cho hỗn hợp phản ứng trực tiếp với H2SO4 đặc nóng
theo bảo toàn khối lượng ta thấy:
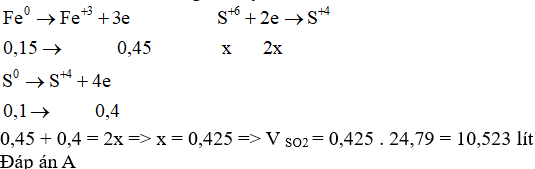
Tiến hành các thí nghiệm sau:
a) Sục khí etilen vào dung dịch KMnO 4 loãng.
b) Cho hơi ancol etylic đi qua bột CuO nung nóng.
c) Sục khí etilen vào dung dịch Br 2 trong CCl 4 .
d) Cho dung dịch glucozơ vào dung dịch AgNO 3 trong NH 3 dư, đun nóng.
e) Cho Fe 2 O 3 vào dung dịch H 2 SO 4 đặc, nóng.
Trong các thí nghiệm trên, số thí nghiệm có xảy ra phản ứng oxi hóa - khử là
-
A.
3
-
B.
4
-
C.
2
-
D.
5
Đáp án : B
Phản ứng oxi hóa khử xảy ra khi có sự thay đổi số oxi hóa của 2 chất
(a) đúng vì C và Mn thay đổi số oxi hóa
(b) đúng vì C và Cu thay đổi số oxi hóa
(c) đúng vì C và Br 2 thay đổi số oxi hóa
(d) đúng vì C và Ag thay đổi số oxi hóa
(e) sai vì Fe không đổi số oxi hóa
Đáp án D
Cho từng chất Fe, FeS, FeO, Fe 2 O 3 , Fe 3 O 4 , Fe(OH) 2 , Fe(OH) 3 , FeBr 2 , FeBr 3 , FeCl 2 , FeCl 3 lần lượt tác dụng với dung dịch H 2 SO 4 đặc, nóng. Số trường hợp xảy ra phản ứng oxi hóa-khử là:
-
A.
9
-
B.
10
-
C.
8
-
D.
7
Đáp án : D
Fe chưa đạt số oxi hóa cao nhất + 3 đều thể hiện tính khử
Fe, FeS, FeO, Fe 3 O 4 , Fe(OH) 2 , FeBr 2 , FeCl 2 phản ứng oxi hóa với dung dịch H 2 SO 4 đặc, nóng
Đáp án D