Trắc nghiệm Bài 17. Biến thiên enthalpy trong các phản ứng hóa học - Hóa 10 Kết nối tri thức
Đề bài
Phản ứng nào sau đây là phản ứng tỏa nhiệt?
-
A.
Phản ứng nhiệt phân muối KNO 3
-
B.
Phản ứng phân hủy khí NH 3
-
C.
Phản ứng oxi hóa glucose trong cơ thể
-
D.
Phản ứng hòa tan NH 4 Cl trong nước
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
-
A.
Phản ứng nhiệt phân Cu(OH) 2
-
B.
Phản ứng giữa H 2 và O 2 trong hỗn hợp khí
-
C.
Phản ứng giữa Zn và dung dịch H 2 SO 4
-
D.
Phản ứng đốt cháy cồn
Nung KNO 3 lên 550 o C xảy ra phản ứng:
KNO 3 (s) → KNO 2 (s) + ½ O 2 (g) ∆H
Phản ứng nhiệt phân KNO 3 là
-
A.
tỏa nhiệt, có ∆H < 0
-
B.
thu nhiệt, có ∆H > 0
-
C.
tỏa nhiệt, có ∆H > 0
-
D.
thu nhiệt, có ∆H < 0
Cho phản ứng hóa học xảy ra ở điều kiện tiêu chuẩn sau:
2NO 2 (g) (đỏ nâu) → N 2 O 4 (g) (không màu)
Biết NO 2 và N 2 O 4 có \({\Delta _f}H_{298}^o\) tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
-
A.
tỏa nhiệt, NO 2 bền vững hơn N 2 O 4
-
B.
thu nhiệt, NO 2 bền vững hơn N 2 O 4
-
C.
tỏa nhiệt, N 2 O 4 bền vững hơn NO 2
-
D.
thu nhiệt, N 2 O 4 bền vững hơn NO 2
Nung nóng hai ống nghiệm chứa NaHCO 3 và P, xảy ra các phản ứng sau:
2NaHCO 3 (s) → Na 2 CO 3 (s) + CO 2 (g) + H 2 O(g) (1)
4P(s) + 5O 2 (g) → 2P 2 O 5 (s) (2)
Khi ngừng đun nóng, phản ứng (1) dừng lại còn phản ứng (2) tiếp tục xảy ra, chứng tỏ
-
A.
phản ứng (1) tỏa nhiệt, phản ứng (2) thu nhiệt
-
B.
phản ứng (1) thu nhiệt, phản ứng (2) tỏa nhiệt
-
C.
cả 2 phản ứng đều tỏa nhiệt
-
D.
cả 2 phản ứng đều thu nhiệt
Tiến hành quá trình ozone hóa 100 g oxi theo phản ứng sau:
3O 2 (g) (oxygen) → 2O 3 (g) (ozone)
Hỗn hợp thu được có chứa 24% ozone về khối lượng, tiêu tốn 71,2 kJ. Nhiệt tạo thành \({\Delta _f}H_{298}^o\) của ozone (kJ/mol) có giá trị là
-
A.
142,4
-
B.
284,8
-
C.
-142,4
-
D.
-284,8
Cho phản ứng hydrogen hóa ethylene:
H 2 C=CH 2 (g) + H 2 (g) → H 3 C-CH 3 (g)
Biết năng lượng liên kết trong các chất cho trong bảng sau:
|
Liên kết |
Phân tử |
E b (kJ/mol) |
Liên kết |
Phân tử |
E b (kJ/mol) |
|
C=C |
C 2 H 4 |
612 |
C-C |
C 2 H 6 |
346 |
|
C-H |
C 2 H 4 |
418 |
C-H |
C 2 H 6 |
418 |
|
H-H |
H 2 |
436 |
Biến thiên enthalpy (kJ) của phản ứng có giá trị là
-
A.
134
-
B.
-134
-
C.
478
-
D.
284
Cho phương trình phản ứng sau:
2H 2 (g) + O 2 (g) → 2H 2 O(l) ∆H = -572 kJ
Khi cho 2 g khí H 2 tác dụng hoàn toàn với 32g khí O 2 thì phản ứng
-
A.
tỏa ra nhiệt lượng 286 kJ
-
B.
thu vào nhiệt lượng 286 kJ
-
C.
tỏa ra nhiệt lượng 572 kJ
-
D.
thu vào nhiệt lượng 572 kJ
Phát biểu nào sau đây không đúng?
-
A.
Các phản ứng phân hủy thường là phản ứng thu nhiệt
-
B.
Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra
-
C.
Phản ứng oxi hóa chất béo cung cấp nhiệt cho cơ thể
-
D.
Các phản ứng khi đun nóng đều dễ xảy ra hơn
Cho phương trình phản ứng
Zn(r) + CuSO 4 (aq) → ZnSO 4 (aq) + Cu(r) ∆H = -210 kJ
và các phát biểu sau:
(1) Zn bị oxi hóa
(2) Phản ứng trên tỏa nhiệt
(3) Biến thiên enthalpy của phản ứng tạo thành 3,84 g Cu là +12,6 kJ
(4) Trong quá trình phản ứng, nhiệt độ hỗn hợp tăng lên
Các phát biểu đúng là
-
A.
(1) và (3)
-
B.
(2) và (4)
-
C.
(1), (2) và (4)
-
D.
(1), (3) và (4)
Trong các phát biểu sau đây có bao nhiêu phát biểu đúng ?
(1) Phản ứng thu nhiệt xảy ra thuận lợi hơn so với phản ứng tỏa nhiệt.
(2) Giá trị hiệu ứng nhiệt của phản ứng tỏa nhiệt trái dấu với phản ứng thu nhiệt.
(3) Phản ứng thu nhiệt thường phải cung cấp nhiệt độ liên tục trong quá trình phản ứng.
(4) Biến thiên enthalpy \({\Delta _r}{\rm{H}}_{298}^0\) của phản ứng xảy ra trong quá trình đẳng áp và điều kiện chuẩn.
(5) Khi cho vôi sống vào nước thấy nhiệt độ tăng so với ban đầu chứng tỏ đây là phản ứng tỏa nhiệt
-
A.
2
-
B.
4
-
C.
3
-
D.
5
Dựa vào phương trình nhiệt hoá học của phản ứng sau:
3Fe (s) + 4H 2 O (l) → Fe 3 O 4 (s) + 4H 2 (g) \({\Delta _r}H_{298}^0\)= +26,32 kJ
Giá trị \({\Delta _r}H_{298}^0\) của phản ứng: Fe 3 O 4 (s) + 4H 2 (g) → 3Fe (s) + 4H 2 O (l) là
-
A.
-26,32 kJ.
-
B.
+13,16 kJ.
-
C.
+13,16 kJ.
-
D.
-10,28 kJ
Dựa vào bảng enthalpy tạo thành chuẩn của 1 số chất dưới đây, thứ tự tăng dần độ bền nhiệt các khísau đây: (1) CH 4 (g); (2) C 2 H 6 (g); (3) C 2 H 2 (g) và (4) C 2 H 4 (g) là:
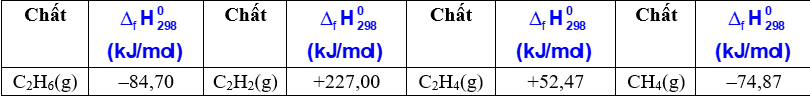
-
A.
(2) < (1) < (4) < (3).
-
B.
(3) < (4) < (2) < (1).
-
C.
(1) > (2) > (4) > (3).
-
D.
(2) > (3) > (4) > (1).
Biết nhiệt tạo thành \({\Delta _f}H_{298}^0\)của FeS 2 (s), Fe 2 O 3 (s) và SO 2 (g) lần lượt là –177,9 kJ/mol, –825,5 kJ/mol và –296,8 kJ/mol, cho phản ứng sau đây
\(4Fe{S_2} + 11{O_2} \to 2F{e_2}{O_3} + 8S{O_2}\).
Phát biểu nào sau đây đúng ?
-
A.
Phản ứng trên xảy ra không thuận lợi.
-
B.
Phản ứng trên cần cung cấp nhiệt lượng bằng 3 313,8 kJ.
-
C.
Tổng nhiệt tạo thành của chất tham gia lớn hơn chất sản phẩm.
-
D.
Biến thiên enthalpy chuẩn của phản ứng trên giá trị bằng -313,8 kJ.
Phản ứng thế của methane với chlorine để thu được methyl chloride :
CH 4 (g) + Cl 2 (g) → CH 3 Cl (g) + HCl
\({\Delta _r}H_{298}^0\)= -110 kJ.
Biết năng lượng liên kết (kJ/mol) của C–H, Cl–Cl, H–Cl lần lượt là 418, 243 và 432. Năng lượng liên kết của C – Cl trong methyl chloride là
-
A.
265 kJ/mol.
-
B.
393 kJ/mol.
-
C.
933 kJ/mol.
-
D.
339 kJ/mol
Cho hai phản ứng cùng xảy ra ở điều kiện chuẩn:
(1) N 2 (g) + O 2 (g) ⟶ 2NO(g) \({\Delta _r}H_{298\;(1)}^0\)
(2) NO(g) + \(\frac{1}{2}\)O 2 (g) ⟶ NO 2 (g) \({\Delta _r}H_{298\;(2)}^0\)
Trong các phát biểu sau đây có bao nhiêu phát biểu không đúng ?
(1) Enthalpy tạo thành chuẩn của NO là \(\frac{1}{2}{\Delta _r}H_{298\;(1)}^0\)kJ mol −1 .
(2) Enthalpy tạo thành chuẩn của NO 2 là \({\Delta _r}H_{298\;(2)}^0\) kJ mol−1.
(3) Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol N 2 với 1 mol O 2 tạo thành 2 mol NO là \(\frac{1}{2}{\Delta _r}H_{298\;(1)}^0\)kJ mol −1 .
(4) Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol khí NO với 0,5 mol khí O 2 tạo thành 1 mol khí NO 2 là \({\Delta _r}H_{298\;(2)}^0\)kJ.
(5) Enthalpy tạo thành chuẩn của NO 2 ( g ) là: \(\frac{1}{2}{\Delta _r}H_{298\;(1)}^0 + {\Delta _r}H_{298\;(2)}^0\) (kJ mol−1)
-
A.
4
-
B.
2
-
C.
3
-
D.
5
Cho các phát biểu sau :
(1) Phản ứng đốt cháy cồn dễ thực hiện hơn phản ứng nung vôi
(2) Nhiên liệu cháy ở trên vùng cao nhanh hơn khi cháy ở vùng thấp.
(3) Có 3 đơn chất có \({\Delta _f}H_{298}^0\)= 0 trong dãy sau : C (graphite, s), Br 2 (l), Br 2 (g), Na (s), Na (g), Hg (l), Hg (s).
(4) Nước đóng băng ở Bắc cực và Nam cực là quá trình tỏa nhiệt.
Số phát biểu đúng là
-
A.
2
-
B.
4
-
C.
5
-
D.
3
Calcium oxide (CaO) đã phản với nước trong một cốc chịu nhiệt theo phương trình:
CaO + H 2 O →Ca(OH) 2 . Ghi nhận giá trị nhiệt độ sau khoảng 2 phút thấy nhiệt độ chất lỏng trong cốc tăng lên từ 25 o C đến 50 o C. Kết luận nào sau đây là đúng ?
-
A.
Phản ứng trên là phản ứng thu nhiệt.
-
B.
Phản ứng trên có giá trị \(\Delta H > 0\) .
-
C.
Phản ứng có năng lượng của hệ chất phản ứng nhỏ hơn năng lượng của hệ chất sản phẩm.
-
D.
Phản ứng trên giải phóng năng lượng dưới dạng nhiệt.
Cho phương trình nhiệt hoá học của phản ứng:
N 2 (g) + O 2 (g) → 2NO (g) \({\Delta _r}H_{298}^0\)= + 179,20 kJ
Phản ứng trên là phản ứng
-
A.
thu nhiệt và hấp thu 179,20 kJ nhiệt.
-
B.
không có sự thay đổi năng lượng.
-
C.
toả nhiệt và giải phóng 179,20 kJ nhiệt.
-
D.
có sự giải phóng nhiệt lượng ra môi trường.
Cho phản ứng sau : KNO 3 (s) → KNO 2 (s) + \(\frac{1}{2}\)O 2 (g) \({\Delta _r}H_{298}^{0.}\).
Biểu thức đúng tính\({\Delta _r}H_{298}^{0.}\) của phản ứng theo giá trị enthalpy tạo thành chuẩn của các chất là :
-
A.
\({\Delta _r}H_{298}^0 = \;{\Delta _f}H_{298}^0\;\left( {KN{O_2}(s)} \right)\; + {\rm{ }}\frac{1}{2} \times {\Delta _f}H_{298}^0\left( {{O_2}(g)} \right) + {\Delta _f}H_{298}^0\;\left( {KN{O_3}(s)} \right)\)
-
B.
\({\Delta _r}H_{298}^0 = \;{\Delta _f}H_{298}^0\;\left( {KN{O_3}(s)} \right) - {\Delta _f}H_{298}^0\;\left( {KN{O_2}(s)} \right)\; - {\rm{ }}\frac{1}{2} \times {\Delta _f}H_{298}^0\left( {{O_2}(g)} \right)\)
-
C.
\({\Delta _r}H_{298}^0 = \;{\Delta _f}H_{298}^0\;\left( {KN{O_2}(s)} \right)\; - \frac{1}{2} \times {\Delta _f}H_{298}^0\left( {{O_2}(g)} \right) - {\Delta _f}H_{298}^0\;\left( {KN{O_3}(s)} \right)\)
-
D.
\({\Delta _r}H_{298}^0 = \;{\Delta _f}H_{298}^0\;\left( {KN{O_2}(s)} \right)\;{\rm{ + }}\frac{1}{2} \times {\Delta _f}H_{298}^0\left( {{O_2}(g)} \right) - {\Delta _f}H_{298}^0\;\left( {KN{O_3}(s)} \right)\)
Cho các phản ứng sau:
(1) C (s) + CO 2 (g) → 2CO(g) \({\Delta _r}H_{298}^0\)= 173,6 kJ
(2) C(s) + H 2 O(g) → CO(g) + H 2 (g) \({\Delta _r}H_{298}^0\) = 133.8 kJ
(3) CO(g) + H 2 O(g) → CO 2 (g) + H 2 (g)
Ở 500 K, 1 atm, biến thiên enthalpy của phản ứng (3) có giá trị là
-
A.
-39,8 kJ
-
B.
39,8 kJ
-
C.
-47,00 kJ
-
D.
106,7 kJ
Lời giải và đáp án
Phản ứng nào sau đây là phản ứng tỏa nhiệt?
-
A.
Phản ứng nhiệt phân muối KNO 3
-
B.
Phản ứng phân hủy khí NH 3
-
C.
Phản ứng oxi hóa glucose trong cơ thể
-
D.
Phản ứng hòa tan NH 4 Cl trong nước
Đáp án : C
- Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt
- Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt
Oxi hóa glucose thành CO 2 và H 2 O, tương tự phản ứng đốt cháy glucose là phản ứng tỏa nhiệt
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
-
A.
Phản ứng nhiệt phân Cu(OH) 2
-
B.
Phản ứng giữa H 2 và O 2 trong hỗn hợp khí
-
C.
Phản ứng giữa Zn và dung dịch H 2 SO 4
-
D.
Phản ứng đốt cháy cồn
Đáp án : C
Phản ứng A, B, D đều cần đốt cháy để xảy ra
Phản ứng C có thể xảy ra ở điều kiện thường
Nung KNO 3 lên 550 o C xảy ra phản ứng:
KNO 3 (s) → KNO 2 (s) + ½ O 2 (g) ∆H
Phản ứng nhiệt phân KNO 3 là
-
A.
tỏa nhiệt, có ∆H < 0
-
B.
thu nhiệt, có ∆H > 0
-
C.
tỏa nhiệt, có ∆H > 0
-
D.
thu nhiệt, có ∆H < 0
Đáp án : B
- Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt (∆H < 0)
- Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt (∆H > 0)
Phản ứng xảy ra ở nhiệt độ cao
=> Phản ứng thu nhiệt
=> ∆H > 0
Cho phản ứng hóa học xảy ra ở điều kiện tiêu chuẩn sau:
2NO 2 (g) (đỏ nâu) → N 2 O 4 (g) (không màu)
Biết NO 2 và N 2 O 4 có \({\Delta _f}H_{298}^o\) tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
-
A.
tỏa nhiệt, NO 2 bền vững hơn N 2 O 4
-
B.
thu nhiệt, NO 2 bền vững hơn N 2 O 4
-
C.
tỏa nhiệt, N 2 O 4 bền vững hơn NO 2
-
D.
thu nhiệt, N 2 O 4 bền vững hơn NO 2
Đáp án : C
Áp dụng công thức:
\({\Delta _r}H_{298}^o\) = \(\sum {{\Delta _f}H_{298}^o} (sp) - \sum {{\Delta _f}H_{298}^o} (c{\text{d}})\)
\({\Delta _r}H_{298}^o\) = \(\sum {{\Delta _f}H_{298}^o} (sp) - \sum {{\Delta _f}H_{298}^o} (c{\text{d}})\)
= 9,16 - 2.33,18 = -57,2 kJ/mol < 0
=> Phản ứng tỏa nhiệt, N 2 O 4 bền vững hơn NO 2
Nung nóng hai ống nghiệm chứa NaHCO 3 và P, xảy ra các phản ứng sau:
2NaHCO 3 (s) → Na 2 CO 3 (s) + CO 2 (g) + H 2 O(g) (1)
4P(s) + 5O 2 (g) → 2P 2 O 5 (s) (2)
Khi ngừng đun nóng, phản ứng (1) dừng lại còn phản ứng (2) tiếp tục xảy ra, chứng tỏ
-
A.
phản ứng (1) tỏa nhiệt, phản ứng (2) thu nhiệt
-
B.
phản ứng (1) thu nhiệt, phản ứng (2) tỏa nhiệt
-
C.
cả 2 phản ứng đều tỏa nhiệt
-
D.
cả 2 phản ứng đều thu nhiệt
Đáp án : B
(1) cần cung cấp nhiệt độ mới xảy ra phản ứng
(2) không cần cung cấp nhiệt độ
- Phản ứng (1) cần cung cấp nhiệt mới xảy ra phản ứng => Phản ứng thu nhiệt
- Phản ứng (2) không cần cung cấp nhiệt vẫn xảy ra phản ứng => Phản ứng tỏa nhiệt
Tiến hành quá trình ozone hóa 100 g oxi theo phản ứng sau:
3O 2 (g) (oxygen) → 2O 3 (g) (ozone)
Hỗn hợp thu được có chứa 24% ozone về khối lượng, tiêu tốn 71,2 kJ. Nhiệt tạo thành \({\Delta _f}H_{298}^o\) của ozone (kJ/mol) có giá trị là
-
A.
142,4
-
B.
284,8
-
C.
-142,4
-
D.
-284,8
Đáp án : A
- Tính số mol O 3
- Tính: \({\Delta _r}H_{298}^o\)
- \({\Delta _r}H_{298}^o\) = \(\sum {{\Delta _f}H_{298}^o} (sp) - \sum {{\Delta _f}H_{298}^o} (c{\text{d}})\)

Cho phản ứng hydrogen hóa ethylene:
H 2 C=CH 2 (g) + H 2 (g) → H 3 C-CH 3 (g)
Biết năng lượng liên kết trong các chất cho trong bảng sau:
|
Liên kết |
Phân tử |
E b (kJ/mol) |
Liên kết |
Phân tử |
E b (kJ/mol) |
|
C=C |
C 2 H 4 |
612 |
C-C |
C 2 H 6 |
346 |
|
C-H |
C 2 H 4 |
418 |
C-H |
C 2 H 6 |
418 |
|
H-H |
H 2 |
436 |
Biến thiên enthalpy (kJ) của phản ứng có giá trị là
-
A.
134
-
B.
-134
-
C.
478
-
D.
284
Đáp án : B
\({\Delta _r}H_{298}^o\) = \(\sum {{E_b}} (cd) - \sum {{E_b}} (sp)\)
\({\Delta _r}H_{298}^o\) = \(\sum {{E_b}} (cd) - \sum {{E_b}} (sp)\)
= E C2H4 + E H2 – E C2H6 = E C=C + 4.E C-H + E H-H – E C-C – 6.E C-H
= 612 + 4.418 + 436 – 346 – 6.418 = -134
Cho phương trình phản ứng sau:
2H 2 (g) + O 2 (g) → 2H 2 O(l) ∆H = -572 kJ
Khi cho 2 g khí H 2 tác dụng hoàn toàn với 32g khí O 2 thì phản ứng
-
A.
tỏa ra nhiệt lượng 286 kJ
-
B.
thu vào nhiệt lượng 286 kJ
-
C.
tỏa ra nhiệt lượng 572 kJ
-
D.
thu vào nhiệt lượng 572 kJ
Đáp án : A
∆H < 0: Phản ứng tỏa nhiệt
∆H > 0: Phản ứng thu nhiệt
- Ta có ∆H < 0
=> Phản ứng tỏa nhiệt
- Nhiệt hình thành là nhiệt lượng tỏa ra hay thu vào khi hình thành 1 mol chất sản phẩm
=> Phản ứng hình thành 1 mol H 2 O tỏa ra nhiệt lượng 572 kJ
Phát biểu nào sau đây không đúng?
-
A.
Các phản ứng phân hủy thường là phản ứng thu nhiệt
-
B.
Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra
-
C.
Phản ứng oxi hóa chất béo cung cấp nhiệt cho cơ thể
-
D.
Các phản ứng khi đun nóng đều dễ xảy ra hơn
Đáp án : D
Các phản ứng tỏa nhiệt như CO 2 + CaO → CaCO 3 , phản ứng lên men,… khó xảy ra hơn khi đun nóng
Cho phương trình phản ứng
Zn(r) + CuSO 4 (aq) → ZnSO 4 (aq) + Cu(r) ∆H = -210 kJ
và các phát biểu sau:
(1) Zn bị oxi hóa
(2) Phản ứng trên tỏa nhiệt
(3) Biến thiên enthalpy của phản ứng tạo thành 3,84 g Cu là +12,6 kJ
(4) Trong quá trình phản ứng, nhiệt độ hỗn hợp tăng lên
Các phát biểu đúng là
-
A.
(1) và (3)
-
B.
(2) và (4)
-
C.
(1), (2) và (4)
-
D.
(1), (3) và (4)
Đáp án : C
Phát biểu (3) sai: Biến thiên enthalpy của phản ứng tạo thành 3,84 g Cu là: -210.3,84/64 = -12,6 kJ
Trong các phát biểu sau đây có bao nhiêu phát biểu đúng ?
(1) Phản ứng thu nhiệt xảy ra thuận lợi hơn so với phản ứng tỏa nhiệt.
(2) Giá trị hiệu ứng nhiệt của phản ứng tỏa nhiệt trái dấu với phản ứng thu nhiệt.
(3) Phản ứng thu nhiệt thường phải cung cấp nhiệt độ liên tục trong quá trình phản ứng.
(4) Biến thiên enthalpy \({\Delta _r}{\rm{H}}_{298}^0\) của phản ứng xảy ra trong quá trình đẳng áp và điều kiện chuẩn.
(5) Khi cho vôi sống vào nước thấy nhiệt độ tăng so với ban đầu chứng tỏ đây là phản ứng tỏa nhiệt
-
A.
2
-
B.
4
-
C.
3
-
D.
5
Đáp án : B
Dựa vào ý nghĩa của biến thiên enthalpy
(1) sai, vì phản ứng thu nhiệt cần cung cấp nhiệt độ trong suốt quá trình xảy ra
(2) đúng
(3) đúng
(4) đúng
(5) đúng
Đáp án B
Dựa vào phương trình nhiệt hoá học của phản ứng sau:
3Fe (s) + 4H 2 O (l) → Fe 3 O 4 (s) + 4H 2 (g) \({\Delta _r}H_{298}^0\)= +26,32 kJ
Giá trị \({\Delta _r}H_{298}^0\) của phản ứng: Fe 3 O 4 (s) + 4H 2 (g) → 3Fe (s) + 4H 2 O (l) là
-
A.
-26,32 kJ.
-
B.
+13,16 kJ.
-
C.
+13,16 kJ.
-
D.
-10,28 kJ
Đáp án : A
Phản ứng thuận là phản ứng tỏa nhiệt thì phản ứng nghịch là phản ứng thu nhiệt và ngược lại
3Fe (s) + 4H 2 O (l) → Fe 3 O 4 (s) + 4H 2 (g) \({\Delta _r}H_{298}^0\)= +26,32 kJ
=> Fe 3 O 4 (s) + 4H 2 (g) → 3Fe (s) + 4H 2 O (l) có \({\Delta _r}H_{298}^0\) = -26,32 KJ
Đáp án A
Dựa vào bảng enthalpy tạo thành chuẩn của 1 số chất dưới đây, thứ tự tăng dần độ bền nhiệt các khísau đây: (1) CH 4 (g); (2) C 2 H 6 (g); (3) C 2 H 2 (g) và (4) C 2 H 4 (g) là:

-
A.
(2) < (1) < (4) < (3).
-
B.
(3) < (4) < (2) < (1).
-
C.
(1) > (2) > (4) > (3).
-
D.
(2) > (3) > (4) > (1).
Đáp án : B
Giá trị enthalpy càng âm chất càng bền nhiệt và ngược lại
Dựa vào bảng enthalpy: (3) < (4) < (2) < (1).
Đáp án B
Biết nhiệt tạo thành \({\Delta _f}H_{298}^0\)của FeS 2 (s), Fe 2 O 3 (s) và SO 2 (g) lần lượt là –177,9 kJ/mol, –825,5 kJ/mol và –296,8 kJ/mol, cho phản ứng sau đây
\(4Fe{S_2} + 11{O_2} \to 2F{e_2}{O_3} + 8S{O_2}\).
Phát biểu nào sau đây đúng ?
-
A.
Phản ứng trên xảy ra không thuận lợi.
-
B.
Phản ứng trên cần cung cấp nhiệt lượng bằng 3 313,8 kJ.
-
C.
Tổng nhiệt tạo thành của chất tham gia lớn hơn chất sản phẩm.
-
D.
Biến thiên enthalpy chuẩn của phản ứng trên giá trị bằng -313,8 kJ.
Đáp án : C
Dưa vào nhiệt tạo thành của các chất và tính giá trị biến thiên enthalpy của phản ứng
\(\begin{array}{l}{\Delta _r}H_{298}^o = 2{\Delta _f}H_{298}^o(F{e_2}{O_3}) + 8.{\Delta _f}H_{298}^o(S{O_2}) - 4.{\Delta _f}H_{298}^o(Fe{S_2})\\ = 2. - 825,5 + 8. - 296,8 - 4.( - 177,9) = - 3313,8kJ\end{array}\)
=> Phản ứng tỏa nhiệt xảy ra thuận lợi
=> Phản ứng trên tỏa ra nhiệt lượng bằng 3313,8Kj
=> tổng nhiệt tạo thành của chất tham gia lớn hơn sản phẩm
Đáp án C
Phản ứng thế của methane với chlorine để thu được methyl chloride :
CH 4 (g) + Cl 2 (g) → CH 3 Cl (g) + HCl
\({\Delta _r}H_{298}^0\)= -110 kJ.
Biết năng lượng liên kết (kJ/mol) của C–H, Cl–Cl, H–Cl lần lượt là 418, 243 và 432. Năng lượng liên kết của C – Cl trong methyl chloride là
-
A.
265 kJ/mol.
-
B.
393 kJ/mol.
-
C.
933 kJ/mol.
-
D.
339 kJ/mol
Đáp án : D
Dựa vào năng lượng liên kết của chất để tính biến thiên enthalpy
\(\begin{array}{l}{\Delta _r}H_{298}^o = 4{E_{C - H}} + {E_{Cl - Cl}} - 3{E_{C - H}} - {E_{C - Cl}} - {E_{H - Cl}}\\ \Rightarrow 4.418 + 243 - 3.418 - {E_{C - Cl}} - 432 = - 110\\ \Rightarrow {E_{C - Cl}} = 339kJ/mol\end{array}\)
Đáp án D
Cho hai phản ứng cùng xảy ra ở điều kiện chuẩn:
(1) N 2 (g) + O 2 (g) ⟶ 2NO(g) \({\Delta _r}H_{298\;(1)}^0\)
(2) NO(g) + \(\frac{1}{2}\)O 2 (g) ⟶ NO 2 (g) \({\Delta _r}H_{298\;(2)}^0\)
Trong các phát biểu sau đây có bao nhiêu phát biểu không đúng ?
(1) Enthalpy tạo thành chuẩn của NO là \(\frac{1}{2}{\Delta _r}H_{298\;(1)}^0\)kJ mol −1 .
(2) Enthalpy tạo thành chuẩn của NO 2 là \({\Delta _r}H_{298\;(2)}^0\) kJ mol−1.
(3) Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol N 2 với 1 mol O 2 tạo thành 2 mol NO là \(\frac{1}{2}{\Delta _r}H_{298\;(1)}^0\)kJ mol −1 .
(4) Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol khí NO với 0,5 mol khí O 2 tạo thành 1 mol khí NO 2 là \({\Delta _r}H_{298\;(2)}^0\)kJ.
(5) Enthalpy tạo thành chuẩn của NO 2 ( g ) là: \(\frac{1}{2}{\Delta _r}H_{298\;(1)}^0 + {\Delta _r}H_{298\;(2)}^0\) (kJ mol−1)
-
A.
4
-
B.
2
-
C.
3
-
D.
5
Đáp án : B
(1) đúng
(2) sai vì enthalpy tạo thành chuẩn của NO 2 phải được tạo thành từ N 2 và O 2
(3) sai vì biến thiên enthalpy tạo thành chuẩn được xét ở 1 mol
(4) đúng
Đáp án B
Cho các phát biểu sau :
(1) Phản ứng đốt cháy cồn dễ thực hiện hơn phản ứng nung vôi
(2) Nhiên liệu cháy ở trên vùng cao nhanh hơn khi cháy ở vùng thấp.
(3) Có 3 đơn chất có \({\Delta _f}H_{298}^0\)= 0 trong dãy sau : C (graphite, s), Br 2 (l), Br 2 (g), Na (s), Na (g), Hg (l), Hg (s).
(4) Nước đóng băng ở Bắc cực và Nam cực là quá trình tỏa nhiệt.
Số phát biểu đúng là
-
A.
2
-
B.
4
-
C.
5
-
D.
3
Đáp án : A
Dựa vào phản ứng tỏa nhiệt và phản ứng thu nhiệt
(1) đúng
(2) sai vì trên cao nồng độ O 2 thấp hơn nên quá trình cháy xảy ra chậm hơn
(3) sai vì tất cả đơn chất đều có enthalpy tạo thành chuẩn bằng 0
(4) đúng
Đáp án A
Calcium oxide (CaO) đã phản với nước trong một cốc chịu nhiệt theo phương trình:
CaO + H 2 O →Ca(OH) 2 . Ghi nhận giá trị nhiệt độ sau khoảng 2 phút thấy nhiệt độ chất lỏng trong cốc tăng lên từ 25 o C đến 50 o C. Kết luận nào sau đây là đúng ?
-
A.
Phản ứng trên là phản ứng thu nhiệt.
-
B.
Phản ứng trên có giá trị \(\Delta H > 0\) .
-
C.
Phản ứng có năng lượng của hệ chất phản ứng nhỏ hơn năng lượng của hệ chất sản phẩm.
-
D.
Phản ứng trên giải phóng năng lượng dưới dạng nhiệt.
Đáp án : D
Dựa vào thông tin nhiệt độ tăng trong cốc sau 2 phút
Nhiệt độ trong cốc tăng nên đây là phản ứng tỏa nhiệt
Đáp án D
Cho phương trình nhiệt hoá học của phản ứng:
N 2 (g) + O 2 (g) → 2NO (g) \({\Delta _r}H_{298}^0\)= + 179,20 kJ
Phản ứng trên là phản ứng
-
A.
thu nhiệt và hấp thu 179,20 kJ nhiệt.
-
B.
không có sự thay đổi năng lượng.
-
C.
toả nhiệt và giải phóng 179,20 kJ nhiệt.
-
D.
có sự giải phóng nhiệt lượng ra môi trường.
Đáp án : A
Dựa vào \({\Delta _r}H_{298}^0\) của phản ứng
Phản ứng trên có \({\Delta _r}H_{298}^0\) = + 179,20 Kj > 0 => Phản ứng thu nhiệt và hấp thu 179,20 KJ nhiệt
Đáp án A
Cho phản ứng sau : KNO 3 (s) → KNO 2 (s) + \(\frac{1}{2}\)O 2 (g) \({\Delta _r}H_{298}^{0.}\).
Biểu thức đúng tính\({\Delta _r}H_{298}^{0.}\) của phản ứng theo giá trị enthalpy tạo thành chuẩn của các chất là :
-
A.
\({\Delta _r}H_{298}^0 = \;{\Delta _f}H_{298}^0\;\left( {KN{O_2}(s)} \right)\; + {\rm{ }}\frac{1}{2} \times {\Delta _f}H_{298}^0\left( {{O_2}(g)} \right) + {\Delta _f}H_{298}^0\;\left( {KN{O_3}(s)} \right)\)
-
B.
\({\Delta _r}H_{298}^0 = \;{\Delta _f}H_{298}^0\;\left( {KN{O_3}(s)} \right) - {\Delta _f}H_{298}^0\;\left( {KN{O_2}(s)} \right)\; - {\rm{ }}\frac{1}{2} \times {\Delta _f}H_{298}^0\left( {{O_2}(g)} \right)\)
-
C.
\({\Delta _r}H_{298}^0 = \;{\Delta _f}H_{298}^0\;\left( {KN{O_2}(s)} \right)\; - \frac{1}{2} \times {\Delta _f}H_{298}^0\left( {{O_2}(g)} \right) - {\Delta _f}H_{298}^0\;\left( {KN{O_3}(s)} \right)\)
-
D.
\({\Delta _r}H_{298}^0 = \;{\Delta _f}H_{298}^0\;\left( {KN{O_2}(s)} \right)\;{\rm{ + }}\frac{1}{2} \times {\Delta _f}H_{298}^0\left( {{O_2}(g)} \right) - {\Delta _f}H_{298}^0\;\left( {KN{O_3}(s)} \right)\)
Đáp án : D
Dựa vào công thức tính \({\Delta _r}H_{298}^{0.}\) của phản ứng
\({\Delta _r}H_{298}^0 = \;{\Delta _f}H_{298}^0\;\left( {KN{O_2}(s)} \right)\;{\rm{ + }}\frac{1}{2} \times {\Delta _f}H_{298}^0\left( {{O_2}(g)} \right) - {\Delta _f}H_{298}^0\;\left( {KN{O_3}(s)} \right)\)
Đáp án D
Cho các phản ứng sau:
(1) C (s) + CO 2 (g) → 2CO(g) \({\Delta _r}H_{298}^0\)= 173,6 kJ
(2) C(s) + H 2 O(g) → CO(g) + H 2 (g) \({\Delta _r}H_{298}^0\) = 133.8 kJ
(3) CO(g) + H 2 O(g) → CO 2 (g) + H 2 (g)
Ở 500 K, 1 atm, biến thiên enthalpy của phản ứng (3) có giá trị là
-
A.
-39,8 kJ
-
B.
39,8 kJ
-
C.
-47,00 kJ
-
D.
106,7 kJ
Đáp án : A
Dựa vào biến thiên enthalpy của phản ứng (1), (2) từ đó xác định phản ứng (3)
\(\begin{array}{l}{\Delta _r}H_{298}^o(3) = {\Delta _r}H_{298}^o(2) + ( - {\Delta _r}H_{298}^o(1))\\ = 133,8 + ( - 173,6) = - 39,8kJ\end{array}\)
Đáp án A