Đề thi giữa kì 1 Hóa 10 Cánh diều - Đề số 12
Các nguyên tố hóa học ở nhóm IIA trong bảng tuần hoàn thuộc khối các nguyên tố.
Đề bài
Các nguyên tố hóa học ở nhóm IIA trong bảng tuần hoàn thuộc khối các nguyên tố.
-
A.
f
-
B.
d
-
C.
s
-
D.
p
Theo mô hình nguyên tử của Ruther – Bohr.
-
A.
các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
-
B.
orbital nguyên tử kà khu vực không gian xung quanh hạt nhân.
-
C.
các electron chuyển động trên những quỹ đạo tròn hay bầu dục xung quanh hạt nhân.
-
D.
các electron chuyển động rất nhanh cách xa hạt nhân.
Nguyên tử nguyên tố X có tổng số hạt là 28; trong đó hạt mang điện ở hạt nhân ít hơn hạt không mang điện là 1 hạt. Cho các phát biểu sau: (a) Nguyên tử X có 5 electron ở lớp ngoài cùng. (b) Nguyên tử X có 3 electron độc thân. (c) Tổng số electron trên phân lớp s là 4. (d) Nguyên tố X là phi kim
Số phát biểu đúng là
-
A.
3
-
B.
2
-
C.
1
-
D.
4
Tổng số electron trong ion \(AB_4^{3 - }\)là 50. Số hạt mang điện trong nguyên tử A nhiều hơn số hạt mang điện trong hạt nhân nguyên tử B là 22. Số proton của nguyên tử A, B lần lượt là
-
A.
16 và 7
-
B.
7 và 16
-
C.
15 và 8
-
D.
8 và 15.
Cấu hình electron nguyên tử của X là 1s 2 2s 2 2p 6 3s 2 3p 3 . Phát biểu nào sau đây sai?
-
A.
Lớp L có 8 electron.
-
B.
Lớp M có 5 electron.
-
C.
Lớp K có 2 electron
-
D.
Lớp ngoài cùng có 3 electron.
Nếu 5 electron được điền vào 3 AO thì số lượng electron độc thân là
-
A.
0
-
B.
1
-
C.
2
-
D.
5
Cho cấu hình electron nguyên tử của các nguyên tố sau:
X: 1s 2 2s 2 2p 6 3s 2 Z: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2
Y: 1s 2 2s 2 2p 6 3s 2 3p 5 R: 1s 2 2s 2 2p 6
Các nguyên tố kim loại là
-
A.
X, Y, Z
-
B.
X, Z
-
C.
X, Z, R
-
D.
X, Y, R.
Đồng có hai đồng vị bền trong tự nhiên là và . Nguyên tử khối trung bình của đồng là 63,55 (điện tích Z của các ion đồng vị đồng đều bằng 1+). Hình vẽ phổ khối nào dưới đây là đúng?
-
A.
-
B.

-
C.
-
D.
Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì có tổng số hạt mang điện trong hai hạt nhân là 25. Vị trí của X và Y trong bảng tuần hoàn là
-
A.
chu kì 3 và các nhóm IA và IIA
-
B.
chu kì 2 và các nhóm IA và IIA.
-
C.
chu kì 3 và các nhóm IIIA và IVA
-
D.
chu kì 3 và các nhóm IIA và IIIA.
Hòa tan 0,03 gam hỗn hợp hai kim loại X và Y thuộc hai chu kì liên tiếp của nhóm IA (M X < M Y ) vào H 2 O thì thu được 0,02479 lít khí H 2 (đkc). X và Y lần lượt là
-
A.
Li và Na
-
B.
K và Rb
-
C.
Na và K
-
D.
Rb và Cs.
Phát biểu nào sau đây sai?
-
A.
Các nguyên tố nhóm VIIIA có 8 electron ở lớp ngoài cùng.
-
B.
Các nguyên tố nhóm VIA có 6 electron ở lớp ngoài cùng.
-
C.
Các nguyên tố nhóm IA có 1 electron ở lớp ngoài cùng
-
D.
Các nguyên tố nhóm IIIA có 3 electron ở lớp ngoài cùng.
X được dùng làm chất bản dẫn trong kĩ thuật vô tuyến điện, chế tạo pin Mặt Trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của nguyên tử X là:
-
A.
1s 2 2s 2 2p 5 .
-
B.
1s 2 2s 2 2p 6 .
-
C.
1s 2 2s 2 2p 6 3s 2 3p 2 .
-
D.
1s 2 2s 2 2p 6 3s 1 .
Trong tự nhiên chlorine có hai đồng vị bền: \(_{17}^{37}Cl\) chiếm 24,23% tổng số nguyên tử, còn lại là \(_{17}^{35}Cl\). Thành phần % theo khối lượng của đồng vị \(^{37}Cl\) trong HClO 4 là
-
A.
8,43%
-
B.
8,79%
-
C.
8,92%
-
D.
8,56%
. Cho các phát biểu sau:
(1) Chỉ có nguyên tử magnesium mới có tỉ lệ số proton và neutron là 1:1
(2) Nguyên tử aluminum có 3 lớp electron.
(3) Nguyên tử khối là khối lượng tương đối của nguyên tử.
(4) Hai nguyên tử \(_{92}^{234}U\)và \(_{92}^{235}U\)khác nhau về số electron.
(5) Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ nguyên tử.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
4
-
D.
1
Gali (Z=31) được Boisbaudran phát hiện năm 1875, ông gọi là nguyên tố “gallia” theo tên cổ xưa của nước Pháp, quê hương ông. Ga có 2 đồng vị với số neutron lần lượt là 38 và 40, có nguyên tử khối trung bình là 69,798. Phần trăm số nguyên tử của đồng vị Ga có số khối nhỏ là
-
A.
39,9%
-
B.
60,1%
-
C.
59,4%
-
D.
40,6%
Trong 5 nguyên tử \(_{17}^{35}X,_{16}^{34}Y,_8^{16}Z,_{34}^{80}T,_8^{17}R\)cặp nguyên tử nào là đồng vị của nhau?
-
A.
X và R
-
B.
Y và Z
-
C.
Y và T
-
D.
Z và R
Nguyên tố R có Z = 25, vị trí của R trong bảng tuần hoàn là
-
A.
chu kì 4, nhóm VIIA
-
B.
chu kì 4, nhóm VB
-
C.
chu kì 4, nhóm IIA
-
D.
chu kì 4, nhóm VIIB.
Electron thuộc lớp nào liên kết chặt chẽ với hạt nhân nhất?
-
A.
Lớp N
-
B.
Lớp L
-
C.
Lớp M
-
D.
Lớp K
X và Y (Z X < Z Y ) là hai kim loại thuộc cùng nhóm A, ở hai chu kì liên tiếp. Biết Z X + Z Y = 32.
Hiệu số hạt mang điện trong hạt nhân của Y và X là 8.
Tính kim loại của X mạnh hơn của Y.
X và Y đều có 2 electron ở lớp ngoài cùng
X có độ âm điện lớn hơn Y.
Cho 3 nguyên tố: \(_8^{16}X,_6^{16}Y,_9^{18}Z,_9^{19}T\)
X và Y là 2 đồng vị của nhau
X với Y có cùng số khối.
Có ba nguyên tố hóa học
Z và T thuộc cùng nguyên tố hóa học.
Cho kí hiệu nguyên tố: \(_{24}^{52}X\)
Nguyên tử X có tổng các hạt mang điện nhiều hơn số hạt không mang điện là 20.
Nguyên tử X có 4 lớp electron.
Cấu hình electron của nguyên tử X là [Ar]3d 4 4s 2
X là kim loại.
Chọn phát biểu đúng, sai
Các nguyên tử có 2 electron lớp ngoài cùng đều là nguyên tử của nguyên tố kim loại.
Trong nguyên tử, các electron nằm trên cùng một lớp có mức năng lượng gần bằng nhau.
Trong các nguyên tử, lớp K là lớp có mức năng lượng cao nhất và liên kết bền chặt nhất với hạt nhân.
Tất cả các nguyên tử của nguyên tố khí hiếm đều có cấu hình electron lớp ngoài cùng là ns 2 np 6 .
Lời giải và đáp án
Các nguyên tố hóa học ở nhóm IIA trong bảng tuần hoàn thuộc khối các nguyên tố.
-
A.
f
-
B.
d
-
C.
s
-
D.
p
Đáp án : C
Dựa vào lớp và phân lớp.
Các nguyên tố nhóm IIA thuộc khối các nguyên tố s trong bảng tuần hoàn.
Đáp án C
Theo mô hình nguyên tử của Ruther – Bohr.
-
A.
các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
-
B.
orbital nguyên tử kà khu vực không gian xung quanh hạt nhân.
-
C.
các electron chuyển động trên những quỹ đạo tròn hay bầu dục xung quanh hạt nhân.
-
D.
các electron chuyển động rất nhanh cách xa hạt nhân.
Đáp án : A
Dựa vào mô hình nguyên tử của Ruther – Bohr.
Các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
Đáp án A
Nguyên tử nguyên tố X có tổng số hạt là 28; trong đó hạt mang điện ở hạt nhân ít hơn hạt không mang điện là 1 hạt. Cho các phát biểu sau: (a) Nguyên tử X có 5 electron ở lớp ngoài cùng. (b) Nguyên tử X có 3 electron độc thân. (c) Tổng số electron trên phân lớp s là 4. (d) Nguyên tố X là phi kim
Số phát biểu đúng là
-
A.
3
-
B.
2
-
C.
1
-
D.
4
Đáp án : B
Dựa vào cấu hình electron X.
Ta có: P + N + E = 28
N – P = 1
\( \to \)P = E = 9; N = 10.
Cấu hình electron của X là: 1s 2 2s 2 2p 5
a. sai, nguyên tử X có 7 electron ở lớp ngoài cùng.
b. sai, nguyên tử X có 1 electron độc thân.
c. đúng
d. đúng
Đáp án B
Tổng số electron trong ion \(AB_4^{3 - }\)là 50. Số hạt mang điện trong nguyên tử A nhiều hơn số hạt mang điện trong hạt nhân nguyên tử B là 22. Số proton của nguyên tử A, B lần lượt là
-
A.
16 và 7
-
B.
7 và 16
-
C.
15 và 8
-
D.
8 và 15.
Đáp án : C
Dựa vào thành phần nguyên tử.
Số hạt mang điện trong nguyên tử A nhiều hơn số hạt mang điện trong hạt nhân nguyên tử B là 22:
2P A – P B = 22
Tổng số electron trong ion \(AB_4^{3 - }\)là: E A + 4.E B + 3 = 50
Và P = E
Giải hệ phương trình: \(\left\{ \begin{array}{l}2{P_A} - {P_B} = 22\\{E_{\rm{A}}} + 4{{\rm{E}}_B} + 3 = 50\\P = E\end{array} \right. \to \left\{ \begin{array}{l}{P_A} = 15\\{P_B} = 8\end{array} \right.\)
Đáp án C
Cấu hình electron nguyên tử của X là 1s 2 2s 2 2p 6 3s 2 3p 3 . Phát biểu nào sau đây sai?
-
A.
Lớp L có 8 electron.
-
B.
Lớp M có 5 electron.
-
C.
Lớp K có 2 electron
-
D.
Lớp ngoài cùng có 3 electron.
Đáp án : D
Dựa vào cấu hình electron nguyên tử của X.
Lớp K có 2 electron
Lớp L có 8 electron
Lớp M có 5 electron
Đáp án D
Nếu 5 electron được điền vào 3 AO thì số lượng electron độc thân là
-
A.
0
-
B.
1
-
C.
2
-
D.
5
Đáp án : B
Dựa vào orbital nguyên tử.
5 electron được điều vào 3AO thì số lượng electron độc thân là 1.
Đáp án B
Cho cấu hình electron nguyên tử của các nguyên tố sau:
X: 1s 2 2s 2 2p 6 3s 2 Z: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2
Y: 1s 2 2s 2 2p 6 3s 2 3p 5 R: 1s 2 2s 2 2p 6
Các nguyên tố kim loại là
-
A.
X, Y, Z
-
B.
X, Z
-
C.
X, Z, R
-
D.
X, Y, R.
Đáp án : B
Số electron hóa trị 1,2,3 thường là kim loại.
X, Z có 2 electron hóa trị nên là kim loại.
Đáp án B
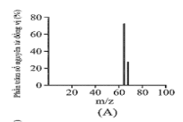
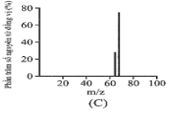
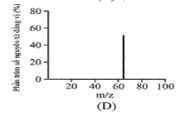
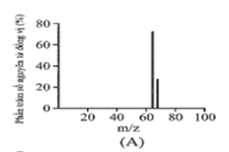
Đồng có hai đồng vị bền trong tự nhiên là và . Nguyên tử khối trung bình của đồng là 63,55 (điện tích Z của các ion đồng vị đồng đều bằng 1+). Hình vẽ phổ khối nào dưới đây là đúng?
-
A.

-
B.

-
C.

-
D.

Đáp án : A
Dựa vào phổ khối.
Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì có tổng số hạt mang điện trong hai hạt nhân là 25. Vị trí của X và Y trong bảng tuần hoàn là
-
A.
chu kì 3 và các nhóm IA và IIA
-
B.
chu kì 2 và các nhóm IA và IIA.
-
C.
chu kì 3 và các nhóm IIIA và IVA
-
D.
chu kì 3 và các nhóm IIA và IIIA.
Đáp án : D
Dựa vào cấu tạo bảng tuần hoàn.
Vì X và Y đứng kế tiếp nhau trong một chu kì nên: Z Y – Z X = 1
Tổng số hạt mang điện trong hai hạt nhân là: P X + P Y = 25
Giải hệ phương trình \(\left\{ \begin{array}{l}{P_{\rm{X}}} + {P_Y} = 25\\ - {P_{\rm{X}}} + {P_Y} = 1\end{array} \right. \to \left\{ \begin{array}{l}{P_{\rm{X}}} = 12\\{P_Y} = 13\end{array} \right.\)
X và Y thuộc chu kì 3 và các nhóm IIA và IIIA.
Đáp án D
Hòa tan 0,03 gam hỗn hợp hai kim loại X và Y thuộc hai chu kì liên tiếp của nhóm IA (M X < M Y ) vào H 2 O thì thu được 0,02479 lít khí H 2 (đkc). X và Y lần lượt là
-
A.
Li và Na
-
B.
K và Rb
-
C.
Na và K
-
D.
Rb và Cs.
Đáp án : A
Dựa vào tính chất hóa học của nhóm IA.
Gọi R là nguyên tố tổng quát.
n H2 = 0,02479 : 24,79 = 0,001 mol
R + H 2 O \( \to \)ROH + ½ H 2
0,002 \( \leftarrow \) 0,001
\({\bar M_R} = \frac{{0,03}}{{0,002}} = 15\)
M X < \({\bar M_R}\)< M Y \( \to \)X là Li, Y là Na
Đáp án A
Phát biểu nào sau đây sai?
-
A.
Các nguyên tố nhóm VIIIA có 8 electron ở lớp ngoài cùng.
-
B.
Các nguyên tố nhóm VIA có 6 electron ở lớp ngoài cùng.
-
C.
Các nguyên tố nhóm IA có 1 electron ở lớp ngoài cùng
-
D.
Các nguyên tố nhóm IIIA có 3 electron ở lớp ngoài cùng.
Đáp án : A
Dựa vào cấu tạo của bảng tuần hoàn.
A sai, vì He thuộc nhóm VIIIA nhưng có 2 electron lớp ngoài cùng.
Đáp án A
X được dùng làm chất bản dẫn trong kĩ thuật vô tuyến điện, chế tạo pin Mặt Trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của nguyên tử X là:
-
A.
1s 2 2s 2 2p 5 .
-
B.
1s 2 2s 2 2p 6 .
-
C.
1s 2 2s 2 2p 6 3s 2 3p 2 .
-
D.
1s 2 2s 2 2p 6 3s 1 .
Đáp án : C
Dựa vào cấu hình electron của X.
Cấu hình của nguyên tử X là: 1s 2 2s 2 2p 6 3s 2 3p 2 .
Đáp án C
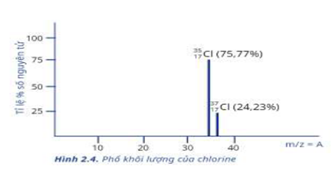
Trong tự nhiên chlorine có hai đồng vị bền: \(_{17}^{37}Cl\) chiếm 24,23% tổng số nguyên tử, còn lại là \(_{17}^{35}Cl\). Thành phần % theo khối lượng của đồng vị \(^{37}Cl\) trong HClO 4 là
-
A.
8,43%
-
B.
8,79%
-
C.
8,92%
-
D.
8,56%
Đáp án : C
Dựa vào công thức tính nguyên tử khối trung bình.
\({\bar A_{Cl}} = \frac{{37.24,23\% + 35.(100 - 24,23)}}{{100}} = 35,4846\)
%\(^{37}Cl\) trong HClO 4 là: \(\frac{{37.24,23\% }}{{1 + 35,4846 + 16.4}}.100 = 8,92\% \)
. Cho các phát biểu sau:
(1) Chỉ có nguyên tử magnesium mới có tỉ lệ số proton và neutron là 1:1
(2) Nguyên tử aluminum có 3 lớp electron.
(3) Nguyên tử khối là khối lượng tương đối của nguyên tử.
(4) Hai nguyên tử \(_{92}^{234}U\)và \(_{92}^{235}U\)khác nhau về số electron.
(5) Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ nguyên tử.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
4
-
D.
1
Đáp án : A
Dựa vào thành phần nguyên tử.
(1) sai, calcium có tỉ lệ số proton và neutron là 1:1
(2) đúng
(3) đúng
(4) sai, hai nguyên tử \(_{92}^{234}U\)và \(_{92}^{235}U\)có cùng số electron.
(5) sai, khối lượng nguyên tử tập trung ở hạt nhân.
Đáp án A
Gali (Z=31) được Boisbaudran phát hiện năm 1875, ông gọi là nguyên tố “gallia” theo tên cổ xưa của nước Pháp, quê hương ông. Ga có 2 đồng vị với số neutron lần lượt là 38 và 40, có nguyên tử khối trung bình là 69,798. Phần trăm số nguyên tử của đồng vị Ga có số khối nhỏ là
-
A.
39,9%
-
B.
60,1%
-
C.
59,4%
-
D.
40,6%
Đáp án : B
Dựa vào công thức tính nguyên tử khối trung bình.
Gọi % đồng vị của 69 Ga và 71 Ga lần lượt là a và 100 – a.
\({\bar A_{Ga}} = \frac{{69.a + 71.(100 - a)}}{{100}} = 69,798 \to a = 60,1\% \)
Đáp án B
Trong 5 nguyên tử \(_{17}^{35}X,_{16}^{34}Y,_8^{16}Z,_{34}^{80}T,_8^{17}R\)cặp nguyên tử nào là đồng vị của nhau?
-
A.
X và R
-
B.
Y và Z
-
C.
Y và T
-
D.
Z và R
Đáp án : D
Đồng vị là các nguyên tố có cùng số proton khác nhau số khối.
Z và R có cùng số proton khác nhau về số khối.
Đáp án D
Nguyên tố R có Z = 25, vị trí của R trong bảng tuần hoàn là
-
A.
chu kì 4, nhóm VIIA
-
B.
chu kì 4, nhóm VB
-
C.
chu kì 4, nhóm IIA
-
D.
chu kì 4, nhóm VIIB.
Đáp án : D
Dựa vào cấu tạo của bảng tuần hoàn.
Cấu hình electron R là: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2
R thuộc chu kì 4, nhóm VIIB.
Đáp án D
Electron thuộc lớp nào liên kết chặt chẽ với hạt nhân nhất?
-
A.
Lớp N
-
B.
Lớp L
-
C.
Lớp M
-
D.
Lớp K
Đáp án : D
Các lớp càng gần hạt nhân càng liên kết chặt chẽ.
Lớp K gần hạt nhân nhất nên liên kết chặt chẽ nhất.
Đáp án D
X và Y (Z X < Z Y ) là hai kim loại thuộc cùng nhóm A, ở hai chu kì liên tiếp. Biết Z X + Z Y = 32.
Hiệu số hạt mang điện trong hạt nhân của Y và X là 8.
Tính kim loại của X mạnh hơn của Y.
X và Y đều có 2 electron ở lớp ngoài cùng
X có độ âm điện lớn hơn Y.
Hiệu số hạt mang điện trong hạt nhân của Y và X là 8.
Tính kim loại của X mạnh hơn của Y.
X và Y đều có 2 electron ở lớp ngoài cùng
X có độ âm điện lớn hơn Y.
Xác định Z X ; Z Y .
Ta có: \(\left\{ \begin{array}{l}{Z_Y} - {Z_X} = 1\\{Z_{\rm{X}}} + {Z_Y} = 32\end{array} \right.(L)\) hoặc \(\left\{ \begin{array}{l}{Z_Y} - {Z_X} = 8\\{Z_{\rm{X}}} + {Z_Y} = 32\end{array} \right. \to \left\{ \begin{array}{l}{Z_Y} = 20\\{Z_X} = 12\end{array} \right.(TM)\)
a. đúng
b. sai, tính kim loại của Y mạnh hơn X.
c. đúng
d. đúng
Cho 3 nguyên tố: \(_8^{16}X,_6^{16}Y,_9^{18}Z,_9^{19}T\)
X và Y là 2 đồng vị của nhau
X với Y có cùng số khối.
Có ba nguyên tố hóa học
Z và T thuộc cùng nguyên tố hóa học.
X và Y là 2 đồng vị của nhau
X với Y có cùng số khối.
Có ba nguyên tố hóa học
Z và T thuộc cùng nguyên tố hóa học.
Dựa vào nguyên tố hóa học.
a. Sai, vì X và Y không thuộc cùng nguyên tố hóa học.
b. đúng
c. đúng, X, Y, Z là nguyên tố hóa học
d. đúng
Cho kí hiệu nguyên tố: \(_{24}^{52}X\)
Nguyên tử X có tổng các hạt mang điện nhiều hơn số hạt không mang điện là 20.
Nguyên tử X có 4 lớp electron.
Cấu hình electron của nguyên tử X là [Ar]3d 4 4s 2
X là kim loại.
Nguyên tử X có tổng các hạt mang điện nhiều hơn số hạt không mang điện là 20.
Nguyên tử X có 4 lớp electron.
Cấu hình electron của nguyên tử X là [Ar]3d 4 4s 2
X là kim loại.
Dựa vào kí hiệu nguyên tố hóa học.
a. đúng, tổng số hạt mang điện của X là 48, hạt không mang điện là 28.
b. đúng
c. sai, cấu hình electron của X là [Ar]3d 5 4s 1
d. đúng
Chọn phát biểu đúng, sai
Các nguyên tử có 2 electron lớp ngoài cùng đều là nguyên tử của nguyên tố kim loại.
Trong nguyên tử, các electron nằm trên cùng một lớp có mức năng lượng gần bằng nhau.
Trong các nguyên tử, lớp K là lớp có mức năng lượng cao nhất và liên kết bền chặt nhất với hạt nhân.
Tất cả các nguyên tử của nguyên tố khí hiếm đều có cấu hình electron lớp ngoài cùng là ns 2 np 6 .
Các nguyên tử có 2 electron lớp ngoài cùng đều là nguyên tử của nguyên tố kim loại.
Trong nguyên tử, các electron nằm trên cùng một lớp có mức năng lượng gần bằng nhau.
Trong các nguyên tử, lớp K là lớp có mức năng lượng cao nhất và liên kết bền chặt nhất với hạt nhân.
Tất cả các nguyên tử của nguyên tố khí hiếm đều có cấu hình electron lớp ngoài cùng là ns 2 np 6 .
Dựa vào lớp và phân lớp.
a. sai, vì He có 2 electron lớp ngoài cùng nhưng thuộc khí hiếm.
b. đúng
c. sai, lớp K có mức năng lượng thấp nhất.
d. sai, He có cấu hình 1s 2 2s 2
Dựa vào công thức tính nguyên tử khối trung bình.
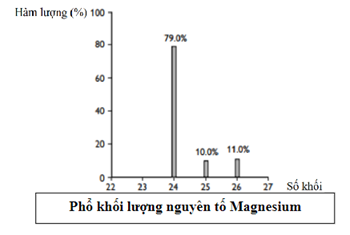
\({\bar A_{Mg}} = \frac{{24.79 + 25.10 + 26.11}}{{100}} = 24,32\) Số mol của 25 Mg = \(\frac{{5,{{418.10}^{22}}}}{{6,{{02.10}^{23}}}} = 0,09mol\)
Số mol của MgCO 3 = 0,09:10% = 0,9 mol
Khối lượng MgCO 3 = 0,9.84,32 = 75,888 \( \approx \)76
\({\bar A_{Cl}} = \frac{{35.75,77 + 37.24,23}}{{100}} = 35,4846\)
n NaCl = 0,1.0,2 = 0,02 mol
m NaCl = 0,02.(58 + 35,4846) = 1,88g
Đáp án 1,88
Theo dữ kiện đề bài ta có:
2(2Z M + N M ) + 2Z O + N O =140 => 4Z M + 2N M + 2.8 + 8 = 140 (1)
=>4Z M + 2.8 – (2N M + 8) = 44 (2)
Giải hệ (1) và (2) => Z M = 19 (K), N M = 20.
Công thức M 2 O: K 2 O
d đĩa =7,8 µm; d He = 0,62 Å = 0,62.10 -4 µm
=>Số nguyên tử He) sắp xếp thẳng hàng và khít nhau = \(\frac{{7,8}}{{0,{{62.10}^{ - 4}}}}\)≈ 125806 nguyên tử.