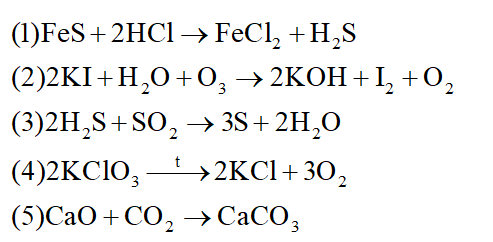Đề thi giữa kì 2 Hóa 10 - Cánh diều - Đề số 1
Số oxi hóa của S trong SO2 và SO42- lần lượt là:
Đề bài
Số oxi hóa của S trong SO 2 và SO 4 2- lần lượt là:
-
A.
+2, +4
-
B.
-2, -4
-
C.
+4, +6
-
D.
-4, +6
Chất khử là chất
-
A.
Nhường e, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
-
B.
Nhường e, chứa nguyên tố có số oxi hóa giảm sau phản ứng
-
C.
Nhận e, chứa nguyên tố có số oxi hóa tăng sau phản ứng
-
D.
Nhận e, chứa nguyên tố có số oxi hóa giảm sau phản ứng
Trong phản ứng hóa học: Mg + H 2 SO 4 \( \to \)MgSO 4 + H 2 , mỗi nguyên tử Mg đã
-
A.
nhường 2 electron
-
B.
nhận 2 electron
-
C.
nhường 1 electron
-
D.
nhận 1 electron
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Cho phương trình hóa học:
6FeSO 4 + K 2 Cr 2 O 7 + 7H 2 SO 4 →3Fe 2 (SO 4 ) 3 + Cr 2 (SO 4 ) 3 + K 2 SO 4 + 7H 2 O
Trong phản ứng trên, chất oxi hóa và chất khử lần lượt là
-
A.
K 2 Cr 2 O 7 và FeSO 4 .
-
B.
K 2 Cr 2 O 7 và H 2 SO 4 .
-
C.
H 2 SO 4 và FeSO 4 .
-
D.
FeSO 4 và K 2 Cr 2 O 7 .
Cho phản ứng hóa học: Cl 2 + KOH \( \to \) KCl + KClO 3 + H 2 O
Tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tử chlorine đóng vai trò chất khử trong phương trình hóa học của phản ứng đã cho tương ứng là
-
A.
1: 5.
-
B.
5: 1.
-
C.
3: 1.
-
D.
1: 3.
Hòa tan hoàn toàn 1,6 gam Cu bằng dung dịch HNO 3 , thu được x mol NO 2 (là sản phẩm khử duy nhất của N +5 ). Giá trị của x là
-
A.
0,05.
-
B.
0,10.
-
C.
0,15.
-
D.
0,25.
Dãy chất nào sau đây trong đó N có số oxi hóa tăng dần:
-
A.
NH 4 Cl, NO, NO 2 , N 2 O 3 , HNO 3
-
B.
NH 3 , N 2 , NO, N 2 O, AlN
-
C.
NH 4 Cl, N 2 O 5 , HNO 3 , Ca 3 N 2 , NO
-
D.
NH 4 Cl, N 2 O, N 2 O 3 , NO 2 , HNO 3
Cho phương trình phản ứng hoá học sau:
1. 4HClO 3 + 3H 2 S → 4HCl + 3H 2 SO 4
2. 8Fe + 30 HNO 3 → 8Fe(NO 3 ) 3 + 3N 2 O + 15H 2 O
3. 16HCl + 2KMnO 4 → 2KCl + 2MaCl 2 + 8H 2 O + 5Cl 2
4. Mg + CuSO 4 → MgSO 4 + Cu
5. 2NH 3 + 3Cl 2 → N 2 + 6HCl
Trong các phản ứng trên các chất khử là:
-
A.
H 2 S, Fe, KMnO 4 , Mg, NH 3
-
B.
H 2 S, Fe, HCl, Mg, NH 3
-
C.
HClO 3 , Fe, HCl, Mg, Cl 2
-
D.
H 2 S, HNO 3 , HCl, CuSO 4 , Cl 2
Điều kiện nào sau đây là điều kiện chuẩn đối với chất khí?
-
A.
Áp suất 1 bar và nhiệt độ 25 0 C hay 298K.
-
B.
Áp suất 1 bar và nồng độ 1 mol/L.
-
C.
Áp suất 1 bar và nhiệt độ 0C.
-
D.
Áp suất 1 bar và nhiệt độ 25K.
Kí hiệu biến thiên enthalpy (nhiệt phản ứng) của phản ứng ở điều kiện chuẩn là:
-
A.
\({\Delta _r}H_{298}^0\)
-
B.
\({\Delta _f}H_{298}^0\)
-
C.
\({\Delta _r}H\)
-
D.
\({\Delta _f}H\)
Nhiệt tạo thành chuẩn của một chất là nhiệt lượng tạo thành 1 mol chất đó từ chất nào ở điều kiện chuẩn?
-
A.
những hợp chất bền vững nhất.
-
B.
những đơn chất bền vững nhất.
-
C.
những oxide có hóa trị cao nhất.
-
D.
những dạng tồn tại bền nhất trong tự nhiên
Quy ước về dấu của nhiệt phản ứng (\({\Delta _r}H_{298}^0\)) nào sau đây là đúng?
-
A.
Phản ứng tỏa nhiệt có \({\Delta _r}H_{298}^0\)> 0
-
B.
Phản ứng thu nhiệt có \({\Delta _r}H_{298}^0\)<0
-
C.
Phản ứng tỏa nhiệt có \({\Delta _r}H_{298}^0\)<0
-
D.
Phản ứng thu nhiệt có \({\Delta _r}H_{298}^0\)= 0
Nung KNO 3 lên 550 o C xảy ra: KNO 3 (s) \( \to \)KNO 2 (s) + \(\frac{1}{2}{O_2}(g)\); \({\Delta _r}H_{298}^0\)=?
Phản ứng nhiệt phân KNO 3 là phản ứng
-
A.
tỏa nhiệt, có \({\Delta _r}H_{298}^0\)< 0
-
B.
thu nhiệt, có \({\Delta _r}H_{298}^0\)> 0
-
C.
tỏa nhiệt, có \({\Delta _r}H_{298}^0\)> 0
-
D.
thu nhiệt, có \({\Delta _r}H_{298}^0\)< 0
-
A.
Phản ứng tỏa nhiệt
-
B.
Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm
-
C.
Biến thiên enthalpy của phản ứng là a KJ/mol
-
D.
Phản ứng thu nhiệt
Cho phương trình phản ứng sau: 2H 2 (g) + O 2 (g) \( \to \) 2H 2 O(l) \({\Delta _r}H_{298}^0\) = -572 kJ
Khi cho 2 g khí H 2 tác dụng hoàn toàn với 32 g khí O 2 thì phản ứng
-
A.
toả ra nhiệt lượng 286 kJ.
-
B.
thu vào nhiệt lượng 286 kJ.
-
C.
toả ra nhiệt lượng 572 kJ.
-
D.
thu vào nhiệt lượng 572 kJ.
Giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn như sau:

Biến thiên enthalpy của phản ứng: C 3 H 8 (g) \( \to \)CH 4 (g) + C 2 H 4 (g) có giá trị là:
-
A.
103 kJ
-
B.
-103 kJ
-
C.
80 kJ
-
D.
-80 kJ
Dựa vào phương trình nhiệt hoá học của phản ứng sau:
\(3{H_2}(g) + {N_2}(g) \to 2N{H_3}(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 91,8kJ\)
Lượng nhiệt tỏa ra hay thu vào khi dùng 9g H 2 (g) để tạo thành NH 3 (g) là
-
A.
Thu vào 275,40 kJ
-
B.
Tỏa ra 137,70 kJ
-
C.
Thu vào 137,70 kJ
-
D.
Tỏa ra 413,1 kJ
Dựa vào phương trình nhiệt hóa học của phản ứng sau:
2NaHCO 3 (s) \( \to \)Na 2 CO 3 (s) + CO 2 (g) + H 2 O (l) \({\Delta _r}H_{298}^0\)= -91,46 kJ
Giá trị \({\Delta _r}H_{298}^0\)của phản ứng: Na 2 CO 3 (s) + CO 2 (g) + H 2 O (l) \( \to \)2NaHCO 3 (s) là
-
A.
-45,73 kJ
-
B.
45,73 kJ
-
C.
-91,46 kJ
-
D.
91,46 kJ
Cho biết phản ứng tạo thành 2 mol HCl(g) ở điều kiện chuẩn tỏa ra 184,6 kJ
\({H_2}(g) + C{l_2}(g) \to 2HCl(g)\)(1)
(a) Nhiệt tạo thành chuẩn của HCl (g) là -184,6 kJ/mol
(b) Biến thiên enthalpy chuẩn của phản ứng (1) là -184,6 kJ
(c) Nhiệt tạo thành chuẩn của HCl(g) là -92,3 kJ/mol
(d) Biến thiên enthalpy chuẩn của phản ứng (1) là -92,3 kJ.
Số phát biểu đúng là:
-
A.
4
-
B.
3
-
C.
2
-
D.
1
Lời giải và đáp án
Số oxi hóa của S trong SO 2 và SO 4 2- lần lượt là:
-
A.
+2, +4
-
B.
-2, -4
-
C.
+4, +6
-
D.
-4, +6
Đáp án : C
Dựa vào quy tắc xác định số oxi hóa
Gọi số oxi hóa của S trong SO 2 là x => x + -2.2 = 0 => x = +4
Gọi số oxi hóa của S trong SO 4 2- là y => y + 4.-2 = -2 => y = + 6
Đáp án C
Chất khử là chất
-
A.
Nhường e, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
-
B.
Nhường e, chứa nguyên tố có số oxi hóa giảm sau phản ứng
-
C.
Nhận e, chứa nguyên tố có số oxi hóa tăng sau phản ứng
-
D.
Nhận e, chứa nguyên tố có số oxi hóa giảm sau phản ứng
Đáp án : A
Dựa vào khái niệm của chất khử
Chất khử là chất nhường e, chứa nguyên tố có số oxi hóa tăng sau phản ứng
Đáp án A
Trong phản ứng hóa học: Mg + H 2 SO 4 \( \to \)MgSO 4 + H 2 , mỗi nguyên tử Mg đã
-
A.
nhường 2 electron
-
B.
nhận 2 electron
-
C.
nhường 1 electron
-
D.
nhận 1 electron
Đáp án : A
Dựa vào sự thay đổi số oxi hóa của Mg
Mg đã nhường 2 electron để thành ion Mg 2+
Đáp án A
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Đáp án : B
Phản ứng oxi hóa – khử xảy ra khi có sự cho và nhận electron
(1) sai vì không có sự thay đổi số oxi hóa
(2) đúng vì có sự thay đổi số oxi hóa của nguyên tử I và O
(3) đúng vì có sự thay đổi số oxi hóa của S
(4) đúng vì có sự thay đổi số oxi hóa của Cl và O
(5) sai vì không có sự thay đổi số oxi hóa
Đáp án B
Cho phương trình hóa học:
6FeSO 4 + K 2 Cr 2 O 7 + 7H 2 SO 4 →3Fe 2 (SO 4 ) 3 + Cr 2 (SO 4 ) 3 + K 2 SO 4 + 7H 2 O
Trong phản ứng trên, chất oxi hóa và chất khử lần lượt là
-
A.
K 2 Cr 2 O 7 và FeSO 4 .
-
B.
K 2 Cr 2 O 7 và H 2 SO 4 .
-
C.
H 2 SO 4 và FeSO 4 .
-
D.
FeSO 4 và K 2 Cr 2 O 7 .
Đáp án : A
Dựa vào sự thay đổi số oxi hóa của các nguyên tử
\(\begin{array}{l}F{e^{ + 2}} \to F{e^{ + 3}}\\C{r^{ + 6}} \to C{r^{ + 3}}\end{array}\)
Chất oxi hóa: K 2 Cr 2 O 7 , chất khử là FeSO 4
Đáp án A
Cho phản ứng hóa học: Cl 2 + KOH \( \to \) KCl + KClO 3 + H 2 O
Tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tử chlorine đóng vai trò chất khử trong phương trình hóa học của phản ứng đã cho tương ứng là
-
A.
1: 5.
-
B.
5: 1.
-
C.
3: 1.
-
D.
1: 3.
Đáp án : B
Cân bằng phương trình theo phương pháp bảo toàn electron
\(\begin{array}{l}C{l_2}^0 + 2{\rm{e}} \to 2C{l^{ - 1}}|x5{\rm{e}}\\C{l_2} \to 2C{l^{ + 5}} + 10{\rm{e|x1e}}\end{array}\)
3Cl 2 + 6KOH \( \to \) 5KCl + KClO 3 + 3H 2 O
Vậy tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tử chlorine đóng vai trò chất khử là: 5:1
Đáp án B
Hòa tan hoàn toàn 1,6 gam Cu bằng dung dịch HNO 3 , thu được x mol NO 2 (là sản phẩm khử duy nhất của N +5 ). Giá trị của x là
-
A.
0,05.
-
B.
0,10.
-
C.
0,15.
-
D.
0,25.
Đáp án : A
Dựa vào phương pháp bảo toàn electron
n Cu = 1,6: 64 = 0,025 mol
\(\begin{array}{l}C{u^0} \to C{u^{ + 2}} + 2{\rm{e}}\\0,025 \to {\rm{ 0,05}}\\{{\rm{N}}^{ + 5}} + 1e \to {N^{ + 4}}\\{\rm{ x x}}\end{array}\)
Theo bảo toàn electron: n e nhường = n e nhận => x = 0,05
Đáp án A
Dãy chất nào sau đây trong đó N có số oxi hóa tăng dần:
-
A.
NH 4 Cl, NO, NO 2 , N 2 O 3 , HNO 3
-
B.
NH 3 , N 2 , NO, N 2 O, AlN
-
C.
NH 4 Cl, N 2 O 5 , HNO 3 , Ca 3 N 2 , NO
-
D.
NH 4 Cl, N 2 O, N 2 O 3 , NO 2 , HNO 3
Đáp án : D
Dựa vào quy tắc xác định số oxi hóa
\(\mathop N\limits^{ - 3} {H_4}Cl,{\mathop N\limits^{ + 1} _2}{\rm{O}},{\mathop N\limits^{ + 3} _2}{{\rm{O}}_3},\mathop N\limits^{ + 4} {O_2},H\mathop N\limits^{ + 5} {O_3}\)
Đáp án D
Cho phương trình phản ứng hoá học sau:
1. 4HClO 3 + 3H 2 S → 4HCl + 3H 2 SO 4
2. 8Fe + 30 HNO 3 → 8Fe(NO 3 ) 3 + 3N 2 O + 15H 2 O
3. 16HCl + 2KMnO 4 → 2KCl + 2MaCl 2 + 8H 2 O + 5Cl 2
4. Mg + CuSO 4 → MgSO 4 + Cu
5. 2NH 3 + 3Cl 2 → N 2 + 6HCl
Trong các phản ứng trên các chất khử là:
-
A.
H 2 S, Fe, KMnO 4 , Mg, NH 3
-
B.
H 2 S, Fe, HCl, Mg, NH 3
-
C.
HClO 3 , Fe, HCl, Mg, Cl 2
-
D.
H 2 S, HNO 3 , HCl, CuSO 4 , Cl 2
Đáp án : B
Chất khử là chất nhường electron
1. \({S^{ - 2}} \to {S^{ + 6}}\)=> H 2 S là chất khử
2. Fe là chất khử
3. HCl là chất khử
4. Mg là chất khử
5. NH 3 là chất khử
Đáp án B
Điều kiện nào sau đây là điều kiện chuẩn đối với chất khí?
-
A.
Áp suất 1 bar và nhiệt độ 25 0 C hay 298K.
-
B.
Áp suất 1 bar và nồng độ 1 mol/L.
-
C.
Áp suất 1 bar và nhiệt độ 0C.
-
D.
Áp suất 1 bar và nhiệt độ 25K.
Đáp án : A
Điều kiện chuẩn đối với chất khí là áp suất 1 bar và nhiệt độ 25 0 C hay 298K
Đáp án A
Kí hiệu biến thiên enthalpy (nhiệt phản ứng) của phản ứng ở điều kiện chuẩn là:
-
A.
\({\Delta _r}H_{298}^0\)
-
B.
\({\Delta _f}H_{298}^0\)
-
C.
\({\Delta _r}H\)
-
D.
\({\Delta _f}H\)
Đáp án : A
Biến thiên enthalpy phản ứng ở điều kiện chuẩn có kí hiệu: \({\Delta _r}H_{298}^0\)
Đáp án A
Nhiệt tạo thành chuẩn của một chất là nhiệt lượng tạo thành 1 mol chất đó từ chất nào ở điều kiện chuẩn?
-
A.
những hợp chất bền vững nhất.
-
B.
những đơn chất bền vững nhất.
-
C.
những oxide có hóa trị cao nhất.
-
D.
những dạng tồn tại bền nhất trong tự nhiên
Đáp án : B
Dựa vào khái niệm nhiệt tạo thành chuẩn của chất
Nhiệt tạo thành chuẩn của một chất là nhiệt lượng tạo thành 1 mol chất đó từ những đơn chất bền vững nhất ở điều kiện chuẩn
Đáp án B
Quy ước về dấu của nhiệt phản ứng (\({\Delta _r}H_{298}^0\)) nào sau đây là đúng?
-
A.
Phản ứng tỏa nhiệt có \({\Delta _r}H_{298}^0\)> 0
-
B.
Phản ứng thu nhiệt có \({\Delta _r}H_{298}^0\)<0
-
C.
Phản ứng tỏa nhiệt có \({\Delta _r}H_{298}^0\)<0
-
D.
Phản ứng thu nhiệt có \({\Delta _r}H_{298}^0\)= 0
Đáp án : C
Dựa vào quy ước về dấu của nhiệt phản ứng \({\Delta _r}H_{298}^0\)
\({\Delta _r}H_{298}^0\)> 0 => phản ứng thu nhiệt
\({\Delta _r}H_{298}^0\)< 0 => phản ứng tỏa nhiệt
Đáp án C
Nung KNO 3 lên 550 o C xảy ra: KNO 3 (s) \( \to \)KNO 2 (s) + \(\frac{1}{2}{O_2}(g)\); \({\Delta _r}H_{298}^0\)=?
Phản ứng nhiệt phân KNO 3 là phản ứng
-
A.
tỏa nhiệt, có \({\Delta _r}H_{298}^0\)< 0
-
B.
thu nhiệt, có \({\Delta _r}H_{298}^0\)> 0
-
C.
tỏa nhiệt, có \({\Delta _r}H_{298}^0\)> 0
-
D.
thu nhiệt, có \({\Delta _r}H_{298}^0\)< 0
Đáp án : B
Dựa vào kiến thức về phản ứng tỏa nhiệt và thu nhiệt
Phản ứng nung KNO 3 cần cung cấp nhiệt cho cả quá trình phản ứng nên phản ứng nung KNO 3 là phản ứng thu nhiệt => \({\Delta _r}H_{298}^0\)> 0
Đáp án B
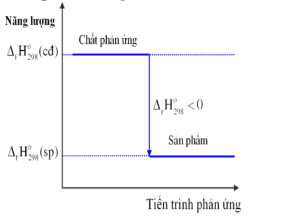
-
A.
Phản ứng tỏa nhiệt
-
B.
Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm
-
C.
Biến thiên enthalpy của phản ứng là a KJ/mol
-
D.
Phản ứng thu nhiệt
Đáp án : A
Dựa vào sơ đồ năng lượng của phản ứng
Phản ứng trên có \({\Delta _r}H_{298}^0\)< 0 => phản ứng tỏa nhiệt
Đáp án A
Cho phương trình phản ứng sau: 2H 2 (g) + O 2 (g) \( \to \) 2H 2 O(l) \({\Delta _r}H_{298}^0\) = -572 kJ
Khi cho 2 g khí H 2 tác dụng hoàn toàn với 32 g khí O 2 thì phản ứng
-
A.
toả ra nhiệt lượng 286 kJ.
-
B.
thu vào nhiệt lượng 286 kJ.
-
C.
toả ra nhiệt lượng 572 kJ.
-
D.
thu vào nhiệt lượng 572 kJ.
Đáp án : A
Tính số mol của H 2 và O 2 để xác định biến thiên năng lượng của phản ứng
n H2 = 2 : 2 = 1 mol
n O2 = 32 : 32 = 1 mol
=> H 2 hết, O 2 dư.
Nhiệt lượng tỏa ra khi đốt cháy 1 mol H 2 là: -572 : 2 = -286 KJ
Đáp án A
Giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn như sau:

Biến thiên enthalpy của phản ứng: C 3 H 8 (g) \( \to \)CH 4 (g) + C 2 H 4 (g) có giá trị là:
-
A.
103 kJ
-
B.
-103 kJ
-
C.
80 kJ
-
D.
-80 kJ
Đáp án : C
Dựa vào năng lượng liên kết để xác định biến thiên enthalpy
\({\Delta _r}H_{298}^0 = \sum {E(c{\rm{d}}) - \sum {E(sp) = {E_{C3H8}} - {E_{CH4}} - {E_{C2H4}}} } \)
= 2.E C-C + 3.E C-H – 4 E C-H – E C=C – 4. E C- H = 2.346 + 8.418 – 4.418 – 612 – 4.418 = 80 KJ
Đáp án C
Dựa vào phương trình nhiệt hoá học của phản ứng sau:
\(3{H_2}(g) + {N_2}(g) \to 2N{H_3}(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 91,8kJ\)
Lượng nhiệt tỏa ra hay thu vào khi dùng 9g H 2 (g) để tạo thành NH 3 (g) là
-
A.
Thu vào 275,40 kJ
-
B.
Tỏa ra 137,70 kJ
-
C.
Thu vào 137,70 kJ
-
D.
Tỏa ra 413,1 kJ
Đáp án : A
Dựa vào biến thiên enthalpy của phản ứng
n H2 = 9 : 2 = 4,5 mol
n NH3 = 4,5.2 : 3 = 3 mol
Q = 3. \({\Delta _r}H_{298}^0\)= 3. – 91,8 = 275,40 kJ
Đáp án A
Dựa vào phương trình nhiệt hóa học của phản ứng sau:
2NaHCO 3 (s) \( \to \)Na 2 CO 3 (s) + CO 2 (g) + H 2 O (l) \({\Delta _r}H_{298}^0\)= -91,46 kJ
Giá trị \({\Delta _r}H_{298}^0\)của phản ứng: Na 2 CO 3 (s) + CO 2 (g) + H 2 O (l) \( \to \)2NaHCO 3 (s) là
-
A.
-45,73 kJ
-
B.
45,73 kJ
-
C.
-91,46 kJ
-
D.
91,46 kJ
Đáp án : D
Dựa vào biến thiên enthalpy của phản ứng 1
Phản ứng (2) là phản ứng nghịch so với phản ứng (1) => \({\Delta _r}H_{298}^0\)(2) = 91,46 kJ
Đáp án D
Cho biết phản ứng tạo thành 2 mol HCl(g) ở điều kiện chuẩn tỏa ra 184,6 kJ
\({H_2}(g) + C{l_2}(g) \to 2HCl(g)\)(1)
(a) Nhiệt tạo thành chuẩn của HCl (g) là -184,6 kJ/mol
(b) Biến thiên enthalpy chuẩn của phản ứng (1) là -184,6 kJ
(c) Nhiệt tạo thành chuẩn của HCl(g) là -92,3 kJ/mol
(d) Biến thiên enthalpy chuẩn của phản ứng (1) là -92,3 kJ.
Số phát biểu đúng là:
-
A.
4
-
B.
3
-
C.
2
-
D.
1
Đáp án : C
(a) sai vì nhiệt tạp thành chuẩn của HCl là -92,3 kJ
(b) đúng
(c) đúng
(d) sai vì biến thiên enthalpy chuẩn của phản ứng (1) là -184,6 kJ