Đề thi giữa kì 1 Hóa 10 Cánh diều - Đề số 13
Nếu hình dung nguyên tử như một khối cầu
Đề bài
Nếu hình dung nguyên tử như một khối cầu thì nó có đường kính khoảng 10 - 10 m. Đường kính của hạt nhân nguyên tử còn nhỏ hơn, vào khoảng 10 -14 m, như vậy đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng bao nhiêu lần?
-
A.
1000 .
-
B.
100000.
-
C.
10 .
-
D.
10000.
X là nguyên tố phi kim khi có số hiệu nguyên tử
-
A.
Z X = 11.
-
B.
Z X = 15.
-
C.
Z X = 12
-
D.
Z X = 10.
Hợp kim cobalt được sử dụng rộng rãi trong các động cơ máy bay vì độ bền nhiệt độ cao là một yếu tố quan trọng. Nguyên tử cobalt có cấu hình thu gọn ở trạng thái cơ bản là [Ar]3d 7 4s 2 . Số thứ tự cobalt trong bảng tuần hoàn là
-
A.
25.
-
B.
24.
-
C.
27.
-
D.
29.
-
A.
(2).
-
B.
(1).
-
C.
(3).
-
D.
(4).
Kết luận nào sau đây là đúng khi biết kí hiệu 3 nguyên tử sau \(_{29}^{63}X\), \(_{29}^{65}Y\)và \(_{30}^{65}Z\)?
-
A.
X và Z là hai đồng vị của cùng một nguyên tố hóa học và có cùng số neutron.
-
B.
X và Y là hai đồng vị của cùng một nguyên tố hóa học và có cùng số khối.
-
C.
Z và Y là hai đồng vị của cùng một nguyên tố hóa học và có cùng số khối.
-
D.
X và Y là hai đồng vị của cùng một nguyên tố hóa học và có cùng số hiệu.
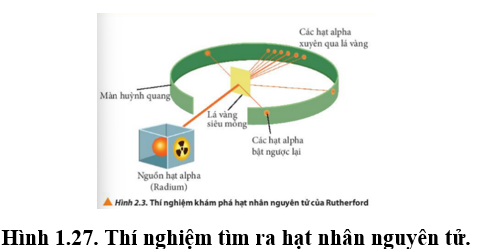
Quan sát hình vẽ sau mô tả thí nghiệm tìm ra hạt nhân nguyên tử vào năm 1911 của nhà vật lý người New Zealand là E. Rutherford. Hãy cho biết phát biểu đúng?
-
A.
Nguyên tử có cấu tạo rỗng nên các hạt α bật ngược trở lại.
-
B.
Hạt nhân nguyên tử mang điện tích âm nên hầu hết các hạt α xuyên qua lá vàng.
-
C.
Hạt nhân nguyên tử có kích thước rất lớn hơn với kích thước nguyên tử
-
D.
Nguyên tử có cấu tạo rỗng nên hầu hết các hạt α xuyên qua lá vàng.
Nguyên tố Y là một khoáng chất thiết yếu đối với sự phát triển của xương và răng, trong cơ thể Y tham gia vào quá trình co cơ, đông máu, điều hòa chức năng thận, thần kinh, tái tạo mô, tế bào và đảm bảo quá trình hoạt động của tim. Trong nguyên tử của nguyên tố A có tổng số các hạt là 46. Biết số hạt mang điện dương ít hơn số hạt không mang điện là 1. Khẳng định nào sau đây đúng ?
-
A.
Nguyên tử Y có điện tích hạt nhân của Y là +2,4.10 -18 C, có 5 electron lớp ngoài cùng
-
B.
Y là nguyên tố phi kim, có số hiệu nguyên tử là 17, có 5 electron ở phân lớp p.
-
C.
Nguyên tử Y có 31 hạt mang điện, có 5 electron lớp ngoài cùng
-
D.
Y là nguyên tố phi kim, có số hiệu nguyên tử là 15, có 2 electron độc thân.
Nguyên tử oxygen (O) có số hiệu nguyên tử Z = 8 khi nhận thêm 2 electron thì tạo ion có cấu hình electron là
-
A.
1s 2 2s 2 2p 6 3s 1 .
-
B.
1s 2 2s 2 2p 6 3s 2 3p 6 .
-
C.
1s 2 2s 2 2p 6 3s 3 .
-
D.
1s 2 2s 2 2p 6 .
Một nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 12, số electron ở lớp ngoài cùng là 1. Nguyên tố X là
-
A.
K (Z = 19).
-
B.
Ar (Z = 18).
-
C.
S (Z = 16).
-
D.
Ca (Z = 20).
Tổng số hạt neutron, proton, electron trong ion \({}_{24}^{52}{\rm{Cr}}_{}^{3 + }\) là
-
A.
73.
-
B.
52.
-
C.
79.
-
D.
76.
Biễu diễn electron vào AO ở lớp vỏ ngoài cùng của một nguyên tử nguyên tố X có dạng sau đây

X là nguyên tử nguyên tố nào sau đây?
-
A.
Nitrogen (Z = 7).
-
B.
Carbon (Z = 6).
-
C.
Magnesium (Z = 12).
-
D.
Silicon (Z = 14).
Zinc (Zn) có 2 đồng vị là \({}_{30}^{65}Zn\) và \({}_{30}^{67}Zn\). Nguyên tử khối trung bình của zinc là 65,38. Phần trăm số nguyên tử \({}_{30}^{65}Zn\) là
-
A.
91.
-
B.
18.
-
C.
81.
-
D.
19.
Nguyên tử X có tổng số electron điền vào phân lớp p là 11. Nguyên tử X có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của nguyên tử Y là 8 . Nhận định nào sau đây sai khi nói về X,Y?
-
A.
Y có số thứ tự 13, chu kì 3, nhóm IIIA.
-
B.
X có số thứ tự 17, chu kì 3, nhóm VIIA.
-
C.
Hợp chất được tạo từ X và Y là YX 3 .
-
D.
X là kim loại, Y là phi kim.
Cấu hình electron của một nguyên tử được biểu diễn dưới dạng các ô orbital như sau:

Số electron ở lớp ngoài cùng và tính chất đặc trưng của nguyên tố hóa học này là
-
A.
3, tính kim loại.
-
B.
5, tính phi kim.
-
C.
7, tính phi kim.
-
D.
4, tính kim loại.
Các đám mây gây hiện tượng sấm sét tạo bởi những hạt nước nhỏ li ti mang điện tích. Một phép đo thực nghiệm cho thấy một giọt nước có đường kính 50 μm, mang một lượng điện tích âm là -3,204 × 10 -17 C. Điện tích âm của giọt nước trên tương đương với điện tích của bao nhiêu electron?
-
A.
200.
-
B.
40.
-
C.
400.
-
D.
3,52.10 13
Sự khác biệt cơ bản giữa mô hình Rutherford – Bohr và mô hình hiện đại về nguyên tử là
-
A.
electron chuyển động (Rutherford – Bohr) và electron không chuyển động (mô hình hiện đại).
-
B.
electron chuyển động theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt trời (mô hình hiện đại) và electron chuyển động không theo quỹ đạo xác định (mô hình Rutherford – Bohr).
-
C.
electron chuyển động theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt trời (mô hình Rutherford – Bohr) và electron chuyển động không theo quỹ đạo xác định (mô hình hiện đại).
-
D.
electron chuyển động xung quanh hạt nhân (mô hình Rutherford – Bohr) và electron chỉ chuyển động ở một khu vực nhất định bên ngoài hạt nhân (mô hình hiện đại).
Nguyên tử của một nguyên tố có tổng số hạt là 115. Số hạt mang điện nhiều hơn số hạt không mang điện là 25. Kí hiệu nguyên tử của nguyên tố đó là:
-
A.
\({}_{79}^{35}Br\)
-
B.
\({}_{35}^{80}Br\)
-
C.
\({}_{44}^{81}Br\)
-
D.
\({}_{81}^{44}Br\)
Các electron của anion X 3- được phân bố trên 3 lớp, lớp thứ 3 có 8e. Số đơn vị điện tích hạt nhân nguyên tử của nguyên tố X là:
-
A.
15
-
B.
18
-
C.
21
-
D.
16
Xét thành phần cấu tạo của nguyên tử
Nguyên tử có cấu tạo đặc.
Nguyên tử gồm hai phần là hạt nhân nguyên tử và lớp vỏ nguyên tử.
Hạt nhân nguyên tử chứa proton (không mang điện) và neutron (mang điện dương).
Lớp vỏ nguyên tử chứa các electron (mang điện âm).
Nguyên tử R có điện tích lớp vỏ nguyên tử là -41,6.10 -19 C. Biết điện tích của 1 electron là – 1,602.10 -19 C.
Lớp vỏ nguyên tử R có 26 electron.
Hạt nhân nguyên tử R có 26 proton.
Hạt nhân nguyên tử R có 26 neutron.
Nguyên tử R trung hòa về điện
X là một trong những thành phần điều chế nước Javel tẩy trắng quần áo, sợi vải. Y là một khoáng chất có ý nghĩa quan trọng đối với sự phát triển của hệ xương khớp. Anion X - và cation Y 2+ đều có cấu hình electron lớp ngoài cùng 3s 2 3p 6 .
Cấu trúc electron của X là [Ar]4s 1 .
Cấu hình electron của Y là [Ar]4s 2 .
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 1 electron độc thân.
Ở trạng thái cơ bản, nguyên tử của nguyên tố Y có 2 electron độc thân.
Cho 2 nguyên tố X và Y cùng nằm trong một nhóm A của hai chu kì nhỏ liên tiếp (Z X < Z Y ). Tổng số đơn vị điện tích hạt nhân của X và Y là 24. Phát biểu đúng về X và Y là
X và Y đều là nguyên tố kim loại
X có 6 electron hóa trị và Y thuộc chu kì 2 trong bảng tuần hoàn.
X là nguyên tố p và hạt nhân Y có điện tích là 16+
X là nguyên tố phi kim và Y thuộc nhóm IVA trong bảng tuần hoàn.
Lời giải và đáp án
Nếu hình dung nguyên tử như một khối cầu thì nó có đường kính khoảng 10 - 10 m. Đường kính của hạt nhân nguyên tử còn nhỏ hơn, vào khoảng 10 -14 m, như vậy đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng bao nhiêu lần?
-
A.
1000 .
-
B.
100000.
-
C.
10 .
-
D.
10000.
Đáp án : D
Dựa vào kích thước nguyên tử.
Đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng: \(\frac{{{{10}^{ - 10}}}}{{{{10}^{ - 14}}}} = 1000\)
Đáp án D
X là nguyên tố phi kim khi có số hiệu nguyên tử
-
A.
Z X = 11.
-
B.
Z X = 15.
-
C.
Z X = 12
-
D.
Z X = 10.
Đáp án : B
Dựa vào cấu tạo của bảng tuần hoàn.
X là nguyên tố phi kim khi số hiệu nguyên tử là : Z X = 15.
Đáp án B
Hợp kim cobalt được sử dụng rộng rãi trong các động cơ máy bay vì độ bền nhiệt độ cao là một yếu tố quan trọng. Nguyên tử cobalt có cấu hình thu gọn ở trạng thái cơ bản là [Ar]3d 7 4s 2 . Số thứ tự cobalt trong bảng tuần hoàn là
-
A.
25.
-
B.
24.
-
C.
27.
-
D.
29.
Đáp án : C
Dựa vào cấu hình của Co.
Cấu hình của Co là : [Ar]3d 7 4s 2 .
Số hiệu nguyên tử : 18 + 7 + 2 = 27.
Đáp án C
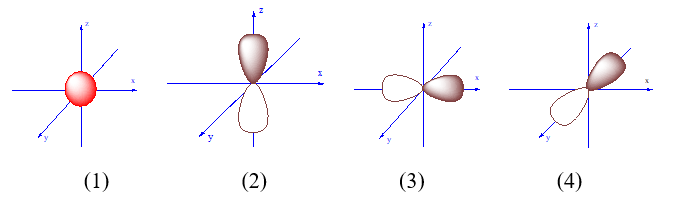
-
A.
(2).
-
B.
(1).
-
C.
(3).
-
D.
(4).
Đáp án : C
Dựa vào mô hình nguyên tử.
AO p y là hình vẽ (3)
Đáp án C
Kết luận nào sau đây là đúng khi biết kí hiệu 3 nguyên tử sau \(_{29}^{63}X\), \(_{29}^{65}Y\)và \(_{30}^{65}Z\)?
-
A.
X và Z là hai đồng vị của cùng một nguyên tố hóa học và có cùng số neutron.
-
B.
X và Y là hai đồng vị của cùng một nguyên tố hóa học và có cùng số khối.
-
C.
Z và Y là hai đồng vị của cùng một nguyên tố hóa học và có cùng số khối.
-
D.
X và Y là hai đồng vị của cùng một nguyên tố hóa học và có cùng số hiệu.
Đáp án : D
Dựa vào nguyên tố hóa học.
X và Y có cùng số proton nên X và Y là hai đồng vị của cùng một nguyên tố hóa học và có cùng số hiệu.
Đáp án D
Quan sát hình vẽ sau mô tả thí nghiệm tìm ra hạt nhân nguyên tử vào năm 1911 của nhà vật lý người New Zealand là E. Rutherford. Hãy cho biết phát biểu đúng?

-
A.
Nguyên tử có cấu tạo rỗng nên các hạt α bật ngược trở lại.
-
B.
Hạt nhân nguyên tử mang điện tích âm nên hầu hết các hạt α xuyên qua lá vàng.
-
C.
Hạt nhân nguyên tử có kích thước rất lớn hơn với kích thước nguyên tử
-
D.
Nguyên tử có cấu tạo rỗng nên hầu hết các hạt α xuyên qua lá vàng.
Đáp án : D
Dựa vào cách tìm ra hạt nhân nguyên tử.
A sai, vì nguyên tử có cấu tạo rỗng nên các hạt xuyên qua.
B sai, hạt nhân nguyên tử mang điện tích dương.
C sai, hạt nhân nguyên tử nhỏ hơn.
D đúng
Đáp án D
Nguyên tố Y là một khoáng chất thiết yếu đối với sự phát triển của xương và răng, trong cơ thể Y tham gia vào quá trình co cơ, đông máu, điều hòa chức năng thận, thần kinh, tái tạo mô, tế bào và đảm bảo quá trình hoạt động của tim. Trong nguyên tử của nguyên tố A có tổng số các hạt là 46. Biết số hạt mang điện dương ít hơn số hạt không mang điện là 1. Khẳng định nào sau đây đúng ?
-
A.
Nguyên tử Y có điện tích hạt nhân của Y là +2,4.10 -18 C, có 5 electron lớp ngoài cùng
-
B.
Y là nguyên tố phi kim, có số hiệu nguyên tử là 17, có 5 electron ở phân lớp p.
-
C.
Nguyên tử Y có 31 hạt mang điện, có 5 electron lớp ngoài cùng
-
D.
Y là nguyên tố phi kim, có số hiệu nguyên tử là 15, có 2 electron độc thân.
Đáp án : C
Dựa vào cấu hình electron của Y.
Ta có: P + N + E = 46
N – P = 1
\( \to \)P = E = 15; N = 16.
Cấu hình Y là: 1s 2 2s 2 2p 6 3s 2 3p 3 .
A. sai vì điện tích hạt nhân của Y là +15.
B. sai, Y có số hiệu nguyên tử là 15.
C. đúng
D. sai, Y có 5 electron độc thân.
Đáp án C
Nguyên tử oxygen (O) có số hiệu nguyên tử Z = 8 khi nhận thêm 2 electron thì tạo ion có cấu hình electron là
-
A.
1s 2 2s 2 2p 6 3s 1 .
-
B.
1s 2 2s 2 2p 6 3s 2 3p 6 .
-
C.
1s 2 2s 2 2p 6 3s 3 .
-
D.
1s 2 2s 2 2p 6 .
Đáp án : D
Dựa vào cấu hình của oxygen.
Khi nhận thêm 2 electron nguyên tử O có tổng 10 electron.
Vậy cấu hình ion O là: 1s 2 2s 2 2p 6 .
Đáp án D
Một nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 12, số electron ở lớp ngoài cùng là 1. Nguyên tố X là
-
A.
K (Z = 19).
-
B.
Ar (Z = 18).
-
C.
S (Z = 16).
-
D.
Ca (Z = 20).
Đáp án : A
Dựa vào cấu hình của X.
Cấu hình X là: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
Số hiệu nguyên tử X là 19
Đáp án A
Tổng số hạt neutron, proton, electron trong ion \({}_{24}^{52}{\rm{Cr}}_{}^{3 + }\) là
-
A.
73.
-
B.
52.
-
C.
79.
-
D.
76.
Đáp án : C
Dựa vào kí hiệu nguyên tố hóa học.
Tổng số hạt neutron, proton, electron trong ion \({}_{24}^{52}{\rm{Cr}}_{}^{3 + }\)là: 24 + 24 + 28 + 3 = 79.
Đáp án C
Biễu diễn electron vào AO ở lớp vỏ ngoài cùng của một nguyên tử nguyên tố X có dạng sau đây

X là nguyên tử nguyên tố nào sau đây?
-
A.
Nitrogen (Z = 7).
-
B.
Carbon (Z = 6).
-
C.
Magnesium (Z = 12).
-
D.
Silicon (Z = 14).
Đáp án : C
Dựa vào biểu diễn orbital nguyên tử.
Cấu hình X là: 1s 2 2s 2 2p 6 3s 2 .
Nguyên tử X là Mg.
Đáp án C
Zinc (Zn) có 2 đồng vị là \({}_{30}^{65}Zn\) và \({}_{30}^{67}Zn\). Nguyên tử khối trung bình của zinc là 65,38. Phần trăm số nguyên tử \({}_{30}^{65}Zn\) là
-
A.
91.
-
B.
18.
-
C.
81.
-
D.
19.
Đáp án : C
Dựa vào công thức tính nguyên tử khối trung bình.
\({\bar A_{Zn}} = \frac{{a.65 + (100 - a).67}}{{100}} = 65,38 \to a = 81\% \)
Đáp án C
Nguyên tử X có tổng số electron điền vào phân lớp p là 11. Nguyên tử X có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của nguyên tử Y là 8 . Nhận định nào sau đây sai khi nói về X,Y?
-
A.
Y có số thứ tự 13, chu kì 3, nhóm IIIA.
-
B.
X có số thứ tự 17, chu kì 3, nhóm VIIA.
-
C.
Hợp chất được tạo từ X và Y là YX 3 .
-
D.
X là kim loại, Y là phi kim.
Đáp án : D
Dựa vào vị trí nguyên tố trong bảng tuần hoàn.
Cấu hình X là: 1s 2 2s 2 2p 6 3s 2 3p 5 .
\( \to \)P = E = 17; N = 18
Ta có: 2P X – 2P Y = 8 \( \to \)P Y = 13.
D sai, X là phi kim, Y là kim loại.
Đáp án D
Cấu hình electron của một nguyên tử được biểu diễn dưới dạng các ô orbital như sau:

Số electron ở lớp ngoài cùng và tính chất đặc trưng của nguyên tố hóa học này là
-
A.
3, tính kim loại.
-
B.
5, tính phi kim.
-
C.
7, tính phi kim.
-
D.
4, tính kim loại.
Đáp án : B
Dựa vào biểu diễn orbital nguyên tử.
Số electron lớp ngoài là 5, thể hiện tính phi kim
Đáp án B
Các đám mây gây hiện tượng sấm sét tạo bởi những hạt nước nhỏ li ti mang điện tích. Một phép đo thực nghiệm cho thấy một giọt nước có đường kính 50 μm, mang một lượng điện tích âm là -3,204 × 10 -17 C. Điện tích âm của giọt nước trên tương đương với điện tích của bao nhiêu electron?
-
A.
200.
-
B.
40.
-
C.
400.
-
D.
3,52.10 13
Đáp án : A
Dựa vào kích thước nguyên tử.
Số electron tương ứng với điện tích âm là: \(\frac{{ - 3,{{204.10}^{ - 17}}}}{{ - 1,{{062.10}^{ - 19}}}} \approx 200\)
Đáp án A
Sự khác biệt cơ bản giữa mô hình Rutherford – Bohr và mô hình hiện đại về nguyên tử là
-
A.
electron chuyển động (Rutherford – Bohr) và electron không chuyển động (mô hình hiện đại).
-
B.
electron chuyển động theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt trời (mô hình hiện đại) và electron chuyển động không theo quỹ đạo xác định (mô hình Rutherford – Bohr).
-
C.
electron chuyển động theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt trời (mô hình Rutherford – Bohr) và electron chuyển động không theo quỹ đạo xác định (mô hình hiện đại).
-
D.
electron chuyển động xung quanh hạt nhân (mô hình Rutherford – Bohr) và electron chỉ chuyển động ở một khu vực nhất định bên ngoài hạt nhân (mô hình hiện đại).
Đáp án : C
Dựa vào mô hình nguyên tử.
Electron chuyển động theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt trời (mô hình Rutherford – Bohr) và electron chuyển động không theo quỹ đạo xác định (mô hình hiện đại).
Đáp án C
Nguyên tử của một nguyên tố có tổng số hạt là 115. Số hạt mang điện nhiều hơn số hạt không mang điện là 25. Kí hiệu nguyên tử của nguyên tố đó là:
-
A.
\({}_{79}^{35}Br\)
-
B.
\({}_{35}^{80}Br\)
-
C.
\({}_{44}^{81}Br\)
-
D.
\({}_{81}^{44}Br\)
Đáp án : B
Dựa vào thành phần nguyên tử.
Ta có: P + N + E = 115
P + E – N = 25
\( \to \)P = E = 35; N = 45
Số khối của X là: 35 + 45 = 80
Kí hiệu nguyên tố là: \({}_{35}^{80}Br\)
Đáp án B
Các electron của anion X 3- được phân bố trên 3 lớp, lớp thứ 3 có 8e. Số đơn vị điện tích hạt nhân nguyên tử của nguyên tố X là:
-
A.
15
-
B.
18
-
C.
21
-
D.
16
Đáp án : A
Dựa vào lớp và phân lớp.
Cấu hình X là: 1s 2 2s 2 2p 6 3s 2 3p 3
Số điện tích hạt nhân là 15.
Đáp án A
Xét thành phần cấu tạo của nguyên tử
Nguyên tử có cấu tạo đặc.
Nguyên tử gồm hai phần là hạt nhân nguyên tử và lớp vỏ nguyên tử.
Hạt nhân nguyên tử chứa proton (không mang điện) và neutron (mang điện dương).
Lớp vỏ nguyên tử chứa các electron (mang điện âm).
Nguyên tử có cấu tạo đặc.
Nguyên tử gồm hai phần là hạt nhân nguyên tử và lớp vỏ nguyên tử.
Hạt nhân nguyên tử chứa proton (không mang điện) và neutron (mang điện dương).
Lớp vỏ nguyên tử chứa các electron (mang điện âm).
Dựa vào thành phần nguyên tử.
a. sai, nguyên tử có cấu tạo rỗng.
b. đúng
c. sai, proton mang điện dương và neutron mang điện âm.
d. đúng
Nguyên tử R có điện tích lớp vỏ nguyên tử là -41,6.10 -19 C. Biết điện tích của 1 electron là – 1,602.10 -19 C.
Lớp vỏ nguyên tử R có 26 electron.
Hạt nhân nguyên tử R có 26 proton.
Hạt nhân nguyên tử R có 26 neutron.
Nguyên tử R trung hòa về điện
Lớp vỏ nguyên tử R có 26 electron.
Hạt nhân nguyên tử R có 26 proton.
Hạt nhân nguyên tử R có 26 neutron.
Nguyên tử R trung hòa về điện
Dựa vào điện tích hạt nhân nguyên tử R.
a. Đúng vì số e = \(\frac{{ - 41,{{6.10}^{ - 19}}}}{{ - 1,{{602.10}^{ - 19}}}} \approx 26\)
b. Đúng vì số e = số p
c. Sai vì neutron không suy được ra từ số electron.
d. Đúng
X là một trong những thành phần điều chế nước Javel tẩy trắng quần áo, sợi vải. Y là một khoáng chất có ý nghĩa quan trọng đối với sự phát triển của hệ xương khớp. Anion X - và cation Y 2+ đều có cấu hình electron lớp ngoài cùng 3s 2 3p 6 .
Cấu trúc electron của X là [Ar]4s 1 .
Cấu hình electron của Y là [Ar]4s 2 .
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 1 electron độc thân.
Ở trạng thái cơ bản, nguyên tử của nguyên tố Y có 2 electron độc thân.
Cấu trúc electron của X là [Ar]4s 1 .
Cấu hình electron của Y là [Ar]4s 2 .
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 1 electron độc thân.
Ở trạng thái cơ bản, nguyên tử của nguyên tố Y có 2 electron độc thân.
Dựa vào cấu hình electron.
a. Sai vì cấu hình electron của X là [Ne]3s 2 3p 5 .
b. Đúng
c. Đúng
X: 1s 2 2s 2 2p 6 3s 2 3p 5 :
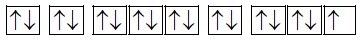 có 1e độc thân.
có 1e độc thân.
d. Sai vì Y không có electron độc thân
Y: 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
:
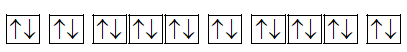 không có e độc thân.
không có e độc thân.
Cho 2 nguyên tố X và Y cùng nằm trong một nhóm A của hai chu kì nhỏ liên tiếp (Z X < Z Y ). Tổng số đơn vị điện tích hạt nhân của X và Y là 24. Phát biểu đúng về X và Y là
X và Y đều là nguyên tố kim loại
X có 6 electron hóa trị và Y thuộc chu kì 2 trong bảng tuần hoàn.
X là nguyên tố p và hạt nhân Y có điện tích là 16+
X là nguyên tố phi kim và Y thuộc nhóm IVA trong bảng tuần hoàn.
X và Y đều là nguyên tố kim loại
X có 6 electron hóa trị và Y thuộc chu kì 2 trong bảng tuần hoàn.
X là nguyên tố p và hạt nhân Y có điện tích là 16+
X là nguyên tố phi kim và Y thuộc nhóm IVA trong bảng tuần hoàn.
Dựa vào thành phần nguyên tử.
Ta có: \(\left\{ \begin{array}{l}{Z_Y} - {Z_{\rm{X}}} = 8\\{Z_{\rm{X}}} + {Z_Y} = 24\end{array} \right. \to \left\{ \begin{array}{l}{Z_Y} = 16\\{Z_{\rm{X}}} = 8\end{array} \right.\)
a. Sai, X và Y đều là phi kim
b. Đúng
c. Sai, hạt nhân Y có điện tích +16.
d. Sai, X và Y thuộc nhóm VIA trong bảng tuần hoàn
Dựa vào công thức tính nguyên tử khối trung bình.
Gọi thành phần % của \(_3^7Li\)là a% và \(_3^6Li\)là 100 – a%
\[{\bar A_{Li}} = \frac{{7.a + 6.(100 - a)}}{{100}} = 6,94 \to a = 94\% \]
Vậy % là 94% và \(_3^6Li\)là 6%
Dựa vào thành phần nguyên tử.
Ta có: P + N + E = 49
N = 53,125%.(P + E)
\( \to \)P = E = 16; N = 17
Điện tích hạt nhân của X là +16.
r Fe = 1,28\(\mathop A\limits^o \)- 1,28.10 -8 cm \( \to \)V Fe = 8,78.10 -24 cm 3
m Fe = 56u = 56.1,6605.10 -24 gam = 92,988.10 -24 gam \( \to \)d Fe = \(\frac{m}{V}\)= 10,59 g/cm 3
vì các nguyên tử Fe chỉ chiếm 74% thể tích tinh thể nên d thực = d.74% = 7,84 g/cm 3
Dựa vào công thức tính nguyên tử khối trung bình.
\({\bar A_{Ar}} = \frac{{40.99,6 + 38.0,063 + 36.0,337}}{{100}} = 39,98\)
Thể tích của 20 gam Ar ở điều kiện chuẩn là: \(\frac{{20}}{{39,98}}.24,79 = 12,4L\)