Đề thi giữa kì 2 Hóa 10 - Cánh diều - Đề số 5
Tính số oxi hóa của S trong các hợp chất sau (viết đúng thứ tự hợp chất):
Đề bài
Tính số oxi hóa của S trong các hợp chất sau (viết đúng thứ tự hợp chất): Cu 2 S, FeS 2 , NaHSO 4 , (NH 4 ) 2 S 2 O 8 , Na 2 SO 3
-
A.
-4; -2; +6: +7; +4
-
B.
-4: -1; +6; +7; +4
-
C.
-2; -1; +6;+6; +4
-
D.
-2; -1; +6; +7; +4
Cho biết trong phản ứng sau: 4HNO 3đặc nóng + Cu → Cu(NO 3 ) 2 + 2NO 2 + 2H 2 O. HNO 3 đóng vai trò là:
-
A.
chất oxi hóa
-
B.
Acid.
-
C.
môi trường.
-
D.
Cả A và C.
Cho phương trình phản ứng hoá học sau:
1. 4HClO 3 + 3H 2 S → 4HCl + 3H 2 SO 4
2. 8Fe + 30 HNO 3 → 8Fe(NO 3 ) 3 + 3N 2 O + 15H 2 O
3. 16HCl + 2KMnO 4 → 2KCl + 2MaCl 2 + 8H 2 O + 5Cl 2
4. Mg + CuSO 4 → MgSO 4 + Cu
5. 2NH 3 + 3Cl 2 → N 2 + 6HCl
Trong các phản ứng trên các chất khử là:
-
A.
H 2 S, Fe, KMnO 4 , Mg, NH 3
-
B.
H 2 S, Fe, HCl, Mg, NH 3
-
C.
HClO 3 , Fe, HCl, Mg, Cl 2
-
D.
H 2 S, HNO 3 , HCl, CuSO 4 , Cl 2
Phát biểu nào dưới đây không đúng?
-
A.
Phản ứng oxi hoá - khử là phản ứng luôn xảy ra đồng thời sự oxi hoá và sự khử.
-
B.
Phản ứng oxi hoá - khử là phản ứng trong đó có sự thay đổi số oxi hoá của tất cả các nguyên tố.
-
C.
Phản ứng oxi hoá - khử là phản ứng trong đó xảy ra sự trao đổi electron giữa các chất.
-
D.
Phản ứng oxi hoá - khử là phản ứng trong đó có sự thay đổi số oxi hoá của một số nguyên tố
KMnO 4 + FeSO 4 + H 2 SO 4 → Fe 2 (SO 4 ) 3 + K 2 SO 4 + MnSO 4 + H 2 O. Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
-
A.
10 và 2.
-
B.
1 và 5.
-
C.
2 và 10.
-
D.
5 và 1.
Cho 20,4 gam hỗn hợp A gồm Al, Zn và Fe tác dụng với dung dịch HCl dư, thu được 11,15 lít H 2 . Mặt khác 0,2 mol A tác dụng vừa đủ với 6,817 lít Cl 2 . Tính khối lượng của Al trong hỗn hợp A (biết khí đo được ở đktc)
-
A.
1,35 gam.
-
B.
4,05 gam.
-
C.
5,4 gam.
-
D.
2,7 gam.
Phản ứng tỏa nhiệt có
-
A.
\(\Delta H \ne 0\)
-
B.
\(\Delta H = 0\)
-
C.
\(\Delta H < 0\)
-
D.
\(\Delta H > 0\)
Cho phương trình nhiệt hóa học sau: \({H_2}(g) + {I_2}(g) \to 2HI(g){\rm{ }}\Delta {\rm{H = 11,3kJ}}\)
Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là đúng?
-
A.
Phản ứng giải phóng nhiệt lượng 11,3 kJ khi 2 mol HI được tạo thành.
-
B.
Tổng nhiệt phá vỡ liên kết của chất phản ứng lớn hơn nhiệt tỏa ra khi tạo thành sản phẩm
-
C.
Năng lượng chứa trong H 2 và I 2 cao hơn trong HI
-
D.
Phản ứng xảy ra với tốc độ chậm
Phản ứng nào sau đây là phản ứng tỏa nhiệt
-
A.
Phản ứng nhiệt phân muối KNO 3
-
B.
Phản ứng phân hủy khí NH 3
-
C.
Phản ứng oxi hóa glucose trong cơ thể
-
D.
Phản ứng hòa tan NH 4 Cl trong nước
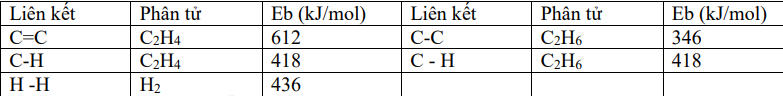
Cho phản ứng hydrogen hóa ethylene sau: \({H_2}C = C{H_2}(g) + {H_2}(g) \to {H_3}C - C{H_3}(g)\). Biết năng lượng liên kết trong các chất cho trong bảng sau:
Biến thiên enthalpy (kJ) của phản ứng có giá trị là:
-
A.
134
-
B.
-134
-
C.
478
-
D.
284
Khí hydrogen và khí oxygen sẽ gây nổ theo tỉ lệ mol tương ứng là 2:1 khi xảy ra phản ứng như sau: 2H 2 (g) + O 2 (g) \( \to \)2H 2 O(l) \({\Delta _r}H_{298}^0\) của phản ứng năng lượng liên kết là:
-
A.
\({\Delta _r}H_{298}^0 = {E_b}({H_2}) + {E_b}({O_2}) - {E_b}({H_2}{\rm{O}})\)
-
B.
\({\Delta _r}H_{298}^0 = 2.{E_b}({H_2}) + {E_b}({O_2}) - 2.{E_b}({H_2}{\rm{O}})\)
-
C.
\({\Delta _r}H_{298}^0 = {E_b}({H_2}) - {E_b}({O_2}) - .{E_b}({H_2}{\rm{O}})\)
-
D.
\({\Delta _r}H_{298}^0 = 2.{E_b}({H_2}O) - 2.{E_b}({H_2}) - 2.{E_b}({{\rm{O}}_{\rm{2}}})\)
Cho phương trình nhiệt hóa học sau:
P(s, đỏ) \( \to \)P(s, trắng) \({\Delta _r}H_{298}^0 = 17,6kJ\)
Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là không đúng?
-
A.
Năng lượng chứa trong P trắng cao hơn trong P đỏ
-
B.
Nhiệt tạo thành chuẩn của P đỏ cao hơn P trắng
-
C.
Phản ứng hấp thụ giải phóng nhiệt lượng 17,6 kJ khi chuyển hóa từ P đỏ sang P trắng
-
D.
P đỏ bền hơn P trắng
Phản ứng tổng hợp ammonia: \({N_2}(g) + 3{H_2}(g) \to 2N{H_3}(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 92kJ\)
Biết năng lượng liên kết (kJ/mol) của \(N \equiv N\)và H – H lần lượt là 946 và 436. Năng lượng liên kết của N – H trong ammonia là:
-
A.
391 kJ/mol
-
B.
361 kJ/mol
-
C.
245 kJ/mol
-
D.
490 kJ/mol
: Cho phương trình nhiệt hóa học của phản ứng ứng: \(2{H_2}(g) + {O_2}(g) \to 2{H_2}{\rm{O}}(l){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 571,68kJ\)
Lượng nhiệt tỏa ra hay thu vào khi dùng 5g H 2 (g) để tạo thành H 2 O(l) là:
-
A.
Thu vào 1429,2 kJ
-
B.
Tỏa ra 714,6 kJ
-
C.
Thu vào 714,6 kJ
-
D.
Tỏa ra 1429,2 kJ
Cho 16,5g Zn vào 500g dung dịch HCl 1M, dung dịch thu được có nhiệt độ tăng thêm 5 o C. Giả thiết không có sự thất thoát nhiệt ra ngoài môi trường, nhiệt dung của dung dịch loãng bằng nhiệt dung của nước (4,2 J/g.K). Nhiệt lượng của phản ứng (KJ) của phản ứng giữa Zn và HCl trong dung dịch có giá trị là
-
A.
84
-
B.
21
-
C.
42
-
D.
24
Lời giải và đáp án
Tính số oxi hóa của S trong các hợp chất sau (viết đúng thứ tự hợp chất): Cu 2 S, FeS 2 , NaHSO 4 , (NH 4 ) 2 S 2 O 8 , Na 2 SO 3
-
A.
-4; -2; +6: +7; +4
-
B.
-4: -1; +6; +7; +4
-
C.
-2; -1; +6;+6; +4
-
D.
-2; -1; +6; +7; +4
Đáp án : D
Dựa vào quy tắc xác định số oxi hóa
Số oxi hóa của S trong Cu 2 S là: 2.(+1) + x = 0 => x = -2
Số oxi hóa của S trong FeS 2 là: (+2).1 + 2.x = 0 => x = -1
Số oxi hóa của S trong NaHSO 4 là: (+1) + (+1) + x + 4.(-2) = 0 => x = +6
Số oxi hóa của S trong (NH 4 ) 2 S 2 O 8 là: (+1).2 + 2.x + 8.(-2) = 0 => x = +7
Số oxi hóa của S trong Na 2 SO 3 là: 2.(+1) + x + 3.(-2) = 0 => x = +4
Đáp án D
Cho biết trong phản ứng sau: 4HNO 3đặc nóng + Cu → Cu(NO 3 ) 2 + 2NO 2 + 2H 2 O. HNO 3 đóng vai trò là:
-
A.
chất oxi hóa
-
B.
Acid.
-
C.
môi trường.
-
D.
Cả A và C.
Đáp án : D
Dựa vào sự thay đổi số oxi hóa của HNO 3
Trong phản ứng, HNO 3 đóng vai trò là chất oxi hóa và là môi trường để thực hiện phản ứng
Đáp án D
Cho phương trình phản ứng hoá học sau:
1. 4HClO 3 + 3H 2 S → 4HCl + 3H 2 SO 4
2. 8Fe + 30 HNO 3 → 8Fe(NO 3 ) 3 + 3N 2 O + 15H 2 O
3. 16HCl + 2KMnO 4 → 2KCl + 2MaCl 2 + 8H 2 O + 5Cl 2
4. Mg + CuSO 4 → MgSO 4 + Cu
5. 2NH 3 + 3Cl 2 → N 2 + 6HCl
Trong các phản ứng trên các chất khử là:
-
A.
H 2 S, Fe, KMnO 4 , Mg, NH 3
-
B.
H 2 S, Fe, HCl, Mg, NH 3
-
C.
HClO 3 , Fe, HCl, Mg, Cl 2
-
D.
H 2 S, HNO 3 , HCl, CuSO 4 , Cl 2
Đáp án : B
Chất khử là chất nhường electron
1. \({H_2}\mathop S\limits^{ - 2} \to {H_2}\mathop S\limits^{ + 6} {O_4} + 4e\)
2. \(F{e^0} \to F{e^{ + 3}} + 3{\rm{e}}\)
3. \(H\mathop {Cl}\limits^{ - 1} \to C{l^0} + 1{\rm{e}}\)
4. \(M{g^0} \to M{g^{ + 2}} + 2{\rm{e}}\)
5. \(\mathop N\limits^{ - 3} {H_3} \to {N^0} + 3e\)
Đáp án B
Phát biểu nào dưới đây không đúng?
-
A.
Phản ứng oxi hoá - khử là phản ứng luôn xảy ra đồng thời sự oxi hoá và sự khử.
-
B.
Phản ứng oxi hoá - khử là phản ứng trong đó có sự thay đổi số oxi hoá của tất cả các nguyên tố.
-
C.
Phản ứng oxi hoá - khử là phản ứng trong đó xảy ra sự trao đổi electron giữa các chất.
-
D.
Phản ứng oxi hoá - khử là phản ứng trong đó có sự thay đổi số oxi hoá của một số nguyên tố
Đáp án : B
Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của một số nguyên tố hoặc sự trao đổi electron giữa các chất
Đáp án B
KMnO 4 + FeSO 4 + H 2 SO 4 → Fe 2 (SO 4 ) 3 + K 2 SO 4 + MnSO 4 + H 2 O. Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
-
A.
10 và 2.
-
B.
1 và 5.
-
C.
2 và 10.
-
D.
5 và 1.
Đáp án : C
Cân bằng phương trình theo phương pháp thăng bằng electron
\(\begin{array}{l}F{e^{ + 2}} \to F{e^{ + 3}} + 1{\rm{e|x5}}\\M{n^{ + 7}} + 5{\rm{e}} \to M{n^{ + 2}}|x1\end{array}\)
2KMnO 4 + 10FeSO 4 + 18H 2 SO 4 → 5Fe 2 (SO 4 ) 3 + K 2 SO 4 + 2MnSO 4 + 18H 2 O
Hệ số của chất oxi hóa 2 và hệ số chất khử là 10
Đáp án C
Cho 20,4 gam hỗn hợp A gồm Al, Zn và Fe tác dụng với dung dịch HCl dư, thu được 11,15 lít H 2 . Mặt khác 0,2 mol A tác dụng vừa đủ với 6,817 lít Cl 2 . Tính khối lượng của Al trong hỗn hợp A (biết khí đo được ở đktc)
-
A.
1,35 gam.
-
B.
4,05 gam.
-
C.
5,4 gam.
-
D.
2,7 gam.
Đáp án : D
Dựa vào phương pháp bảo toàn electron
Đặt số mol của Fe, Zn, Al lần lượt là x, y, z
Ta có: 56x + 65y + 27z = 20,4 (1)
Fe + 2HCl \( \to \) FeCl 2 + H 2
x \( \to \) x
Zn + 2HCl \( \to \)ZnCl 2 + H 2
y \( \to \) y
2Al + 6HCl \( \to \)2AlCl 3 + 3H 2
z \( \to \) 3z/2
n H2 = 11,15 : 24,79 = 0,45 = x + y + 3z/2 (2)
Mặt khác: số mol của X là: kx + ky + kz = 0,2 (3)
2Fe + 3Cl 2 \( \to \)2FeCl 3
kx\( \to \) 1,5kx
Zn + Cl 2 \( \to \)ZnCl 2
ky \( \to \)ky
2Al + 3Cl 2 \( \to \)2AlCl 3
kz \( \to \)1,5kz
n Cl2 = 6,817 : 24,79 = 0,275 = 1,5kx + ky + 1,5kz (4)
Từ (1), (2), (3), (4) ta có: \(\left\{ \begin{array}{l}x = 0,2\\y = 0,1\\z = 0,1\end{array} \right.\)
m Al = 0,1 . 27 = 2,7g
Đáp án D
Phản ứng tỏa nhiệt có
-
A.
\(\Delta H \ne 0\)
-
B.
\(\Delta H = 0\)
-
C.
\(\Delta H < 0\)
-
D.
\(\Delta H > 0\)
Đáp án : C
Phản ứng tỏa nhiệt có \(\Delta H < 0\)
Đáp án C
Cho phương trình nhiệt hóa học sau: \({H_2}(g) + {I_2}(g) \to 2HI(g){\rm{ }}\Delta {\rm{H = 11,3kJ}}\)
Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là đúng?
-
A.
Phản ứng giải phóng nhiệt lượng 11,3 kJ khi 2 mol HI được tạo thành.
-
B.
Tổng nhiệt phá vỡ liên kết của chất phản ứng lớn hơn nhiệt tỏa ra khi tạo thành sản phẩm
-
C.
Năng lượng chứa trong H 2 và I 2 cao hơn trong HI
-
D.
Phản ứng xảy ra với tốc độ chậm
Đáp án : B
Dựa vào năng lượng hóa học của phản ứng
Phản ứng trên là phản ứng thu nhiệt, nên năng lượng chứa trong HI lớn hơn hỗn hợp H 2 và I 2 và tổng nhiệt phá vỡ liên kết của chất phản ứng lớn hơn nhiệt tỏa ra khi tạo thành sản phẩm
Đáp án B
Phản ứng nào sau đây là phản ứng tỏa nhiệt
-
A.
Phản ứng nhiệt phân muối KNO 3
-
B.
Phản ứng phân hủy khí NH 3
-
C.
Phản ứng oxi hóa glucose trong cơ thể
-
D.
Phản ứng hòa tan NH 4 Cl trong nước
Đáp án : C
Phản ứng tỏa nhiệt là phản ứng tỏa ra năng lượng dưới dạng nhiệt
Phản ứng oxi hóa glucose trong cơ thể là phản ứng tỏa nhiệt
Đáp án C
Cho phản ứng hydrogen hóa ethylene sau: \({H_2}C = C{H_2}(g) + {H_2}(g) \to {H_3}C - C{H_3}(g)\). Biết năng lượng liên kết trong các chất cho trong bảng sau:

Biến thiên enthalpy (kJ) của phản ứng có giá trị là:
-
A.
134
-
B.
-134
-
C.
478
-
D.
284
Đáp án : B
Dựa vào năng lượng liên kết của các chất để tính biến thiên enthalpy của phản ứng
\({\Delta _r}H_{298}^0 = {E_{H2C = CH2}} + {E_{H2}} - {E_{H3C - CH3}}\)= E C=C + 4. E C – H + E H – H – E C – C – 6. E C – H
= 612 + 4. 418 + 436 – 346 – 6. 418 = - 134 kJ
Đáp án B
Khí hydrogen và khí oxygen sẽ gây nổ theo tỉ lệ mol tương ứng là 2:1 khi xảy ra phản ứng như sau: 2H 2 (g) + O 2 (g) \( \to \)2H 2 O(l) \({\Delta _r}H_{298}^0\) của phản ứng năng lượng liên kết là:
-
A.
\({\Delta _r}H_{298}^0 = {E_b}({H_2}) + {E_b}({O_2}) - {E_b}({H_2}{\rm{O}})\)
-
B.
\({\Delta _r}H_{298}^0 = 2.{E_b}({H_2}) + {E_b}({O_2}) - 2.{E_b}({H_2}{\rm{O}})\)
-
C.
\({\Delta _r}H_{298}^0 = {E_b}({H_2}) - {E_b}({O_2}) - .{E_b}({H_2}{\rm{O}})\)
-
D.
\({\Delta _r}H_{298}^0 = 2.{E_b}({H_2}O) - 2.{E_b}({H_2}) - 2.{E_b}({{\rm{O}}_{\rm{2}}})\)
Đáp án : B
Dựa vào công thức tính \({\Delta _r}H_{298}^0\)theo năng lượng liên kết
\({\Delta _r}H_{298}^0 = 2.{E_b}({H_2}) + {E_b}({O_2}) - 2.{E_b}({H_2}{\rm{O}})\)
Đáp án B
Cho phương trình nhiệt hóa học sau:
P(s, đỏ) \( \to \)P(s, trắng) \({\Delta _r}H_{298}^0 = 17,6kJ\)
Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là không đúng?
-
A.
Năng lượng chứa trong P trắng cao hơn trong P đỏ
-
B.
Nhiệt tạo thành chuẩn của P đỏ cao hơn P trắng
-
C.
Phản ứng hấp thụ giải phóng nhiệt lượng 17,6 kJ khi chuyển hóa từ P đỏ sang P trắng
-
D.
P đỏ bền hơn P trắng
Đáp án : B
Dựa vào kiến thức về năng lượng hóa học của phản ứng
Phản ứng trên là phản ứng thu nhiệt nên năng lượng chứa trong P trắng lớn hơn P đỏ => P đỏ bền hơn P trắng.
Vì cả P đỏ và P trắng đều là đơn chất nên nhiệt tạo thành chuẩn = 0
Đáp án B
Phản ứng tổng hợp ammonia: \({N_2}(g) + 3{H_2}(g) \to 2N{H_3}(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 92kJ\)
Biết năng lượng liên kết (kJ/mol) của \(N \equiv N\)và H – H lần lượt là 946 và 436. Năng lượng liên kết của N – H trong ammonia là:
-
A.
391 kJ/mol
-
B.
361 kJ/mol
-
C.
245 kJ/mol
-
D.
490 kJ/mol
Đáp án : B
Dựa vào công thức tính \({\Delta _r}H_{298}^0\)theo năng lượng liên kết của các chất
\({\Delta _r}H_{298}^0\)= E N2 + 3. E H2 – 2. E NH3 = E N2 + 3. E H-H – 2.3. E N-H = 92
=> 6E N – H = 946 + 3.436 – 92 = 2162 => E N-H = 2162 : 6 = 361 KJ/mol
Đáp án B
: Cho phương trình nhiệt hóa học của phản ứng ứng: \(2{H_2}(g) + {O_2}(g) \to 2{H_2}{\rm{O}}(l){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 571,68kJ\)
Lượng nhiệt tỏa ra hay thu vào khi dùng 5g H 2 (g) để tạo thành H 2 O(l) là:
-
A.
Thu vào 1429,2 kJ
-
B.
Tỏa ra 714,6 kJ
-
C.
Thu vào 714,6 kJ
-
D.
Tỏa ra 1429,2 kJ
Đáp án : D
Dựa vào \({\Delta _r}H_{298}^0\)của phản ứng
n H2 = 5: 2 = 2,5 mol
Lượng nhiệt tỏa ra khi dùng 2,5 mol H 2 (g) để tạo thành 2,5 mol H 2 O(l) là: 2,5 . 571,68 = 1429,2 kJ
Đáp án D
Cho 16,5g Zn vào 500g dung dịch HCl 1M, dung dịch thu được có nhiệt độ tăng thêm 5 o C. Giả thiết không có sự thất thoát nhiệt ra ngoài môi trường, nhiệt dung của dung dịch loãng bằng nhiệt dung của nước (4,2 J/g.K). Nhiệt lượng của phản ứng (KJ) của phản ứng giữa Zn và HCl trong dung dịch có giá trị là
-
A.
84
-
B.
21
-
C.
42
-
D.
24
Đáp án : C
Dựa vào công thức Q = m.C.\(\Delta T\)
n Zn = 16,5 : 65 = 0,254 mol
n HCl = 0,5 mol
Zn + 2HCl \( \to \)ZnCl 2 + H 2
0,254 0,5
n HCl < n Zn
Q = 500.4,2.5 = 10500 J
\(\Delta H = \frac{{10500}}{{0,25}} = 42000J = 42kJ\)
Đáp án C
a) Vì SO 2 đóng vai trò chất oxi hóa trong phản ứng trên nên gọi là phản ứng khử sulfur
b) \({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0(CaS{O_3}) + {\Delta _f}H_{298}^0(C{O_2}) - {\Delta _f}H_{298}^0(CaC{O_3}) - {\Delta _f}H_{298}^0(S{O_2})\)
= -1634,9 + (-393,5) – (-1207,6) – (-296,8) = -524 kJ. Phản ứng tỏa nhiệt nên thuận lợi về mặt năng lượng
c) Là phản ứng oxi hóa khử vì làm tăng số oxi hóa của sulfur từ +4 lên +6
- a) Theo định luật bảo toàn khối lượng: m hỗn hợp Mg và Al + m X = m chất rắn
=> m X = 8,84 – 2,52 = 6,32g
Đặt số mol của O 2 và Cl 2 là x và y
n X = 2,479 : 24,79 = 0,1 mol => x + y = 0,1 mol (1)
m X = 32x + 71y = 6,32 (2)
Từ (1) và (2) => \(\left\{ \begin{array}{l}x = 0,02\\y = 0,08\end{array} \right.\)
%V O2 = \(\frac{{0,02}}{{0,1}}.100 = 20\% \); V Cl2 = 80%
b) gọi số mol Mg và Al lần lượt là a và b mol
Theo quá trình cho – nhận electron ta có:
\(\begin{array}{l}M{g^0} \to M{g^{ + 2}} + 2{\rm{e}}\\A{l^o} \to A{l^{ + 3}} + 3e\end{array}\) \(\begin{array}{l}O_2^o + 4e \to {O^{ - 2}}\\Cl_2^0 + 2e \to C{l^{ - 1}}\end{array}\)
Ta có: m hỗn hợp = 24a + 27b = 2,52g
Theo bảo toàn electron: 2a + 3b = 0,02.4 + 0,08.2 = 0,24
=> a = 0,06; b = 0,04 mol
