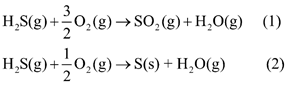Đề thi giữa kì 2 Hóa 10 - Chân trời sáng tạo - Đề số 5
Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
Đề bài
Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O( l )
\({\Delta _r}H_{298}^0\) = – 890,3 kJ
Biết nhiệt tạo thành chuẩn của CO 2 (g) và H 2 O( l ) tương ứng là –393,5 ; –285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
-
A.
\({\Delta _f}H_{298}^0\) (CH 4 (g)) = –74,8 kJ/mol.
-
B.
\({\Delta _r}H_{298}^0\) (CH 4 (g)) = +748 kJ/mol
-
C.
\({\Delta _r}H_{298}^0\) (CH 4 (g)) = –748 kJ/mol
-
D.
\({\Delta _r}H_{298}^0\) (CH 4 (g)) = +74,8 kJ/mol
Cho phương trình hóa học: aAl + b H 2 SO 4 → c Al 2 (SO 4 ) 3 + d SO 2 + e H 2 O
Tỉ lệ a: b là
-
A.
1: 1.
-
B.
2: 3.
-
C.
1: 3.
-
D.
1: 2.
Phát biểu nào sau đây đúng ?
-
A.
Biến thiên enthalpy chuẩn của một phản ứng hoá học là lượng nhiệt kèm theo phản ứng đó ở áp suất 1 atm và 25 o C.
-
B.
Nhiệt (toả ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298 K là biến thiên enthalpy chuẩn của phản ứng đó.
-
C.
Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt.
-
D.
Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường
Ở điều kiện chuẩn, cần phải cung cấp 26,48 kJ nhiệt lượng cho quá trình ½ mol H 2 (thể khí) phản ứng với ½ mol I 2 (thể rắn) để thu được 1 mol HI (thể khí). Ta nói enthalpy tạo thành của HI khí ở điều kiện chuẩn là 26,48 kJ mol -1 . Phản ứng trên được biểu diễn như sau:
\(\frac{1}{2}\)H 2 (g) + \(\frac{1}{2}\)I 2 (g) \( \to \)HI(g) \({\Delta _f}H_{298}^0 = 26,48\;{\rm{kJ/mol}}\;{\rm{(kJ}}\;{\rm{mo}}{{\rm{l}}^{ - 1}})\)
Ở cùng điều kiện phản ứng, nếu thu được 3 mol HI thì lượng nhiệt cần thu vào là bao nhiêu kJ?
-
A.
26,48 kJ.
-
B.
52,96 kJ.
-
C.
79,44 kJ.
-
D.
794,4 kJ.
Hoà tan hoàn toàn 19,2 gam một kim loại M trong dung dịch HNO 3 ta thu được 4,958 L NO (ở 25 o C và 1 bar). Kim loại M là
-
A.
Zn = 65.
-
B.
Fe = 56.
-
C.
Mg = 24.
-
D.
Cu = 64.
Cho sơ đồ phản ứng sau:
S \( \to \)SO 2 \( \to \) SO 3 \( \to \)H 2 SO 4 \( \to \)SO 2 \( \to \)S\( \to \)H 2 S
Mỗi mũi tên là một phản ứng hóa học. Số phản ứng mà sulfur đóng vai trò chất oxi hóa là
-
A.
3
-
B.
2
-
C.
4
-
D.
1
Cho phương trình hóa học (a, b, c, d, e, g là các hệ số nguyên tối giản).
aKMnO 4 + bHCl \( \to \)cKCl + dMnCl 2 + eCl 2 + gH 2 O
Tỉ lệ b: e là
-
A.
8: 1
-
B.
16: 5
-
C.
8: 3
-
D.
12: 5
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:

Biến thiên enthalpy của phản ứng C 3 H 8 (g) → CH 4 (g) + C 2 H 4 (g) có giá trị là
-
A.
+103 kJ.
-
B.
– 103 kJ.
-
C.
+80 kJ.
-
D.
– 80 kJ.
Cho các phát biểu sau :
(1) Phản ứng phân huỷ Fe(OH) 3 (s) không cần cung cấp nhiệt độ liên tục.
(2) Số oxi hóa của hydrogen trong các hydride kim loại bằng +1.
(3) Trộn potassium chloride (KCl) vào nước là quá trình thu nhiệt.
(4) Phản ứng của Fe(OH) 2 với dung dịch HNO 3 loãng không có sự thay đổi số oxi hóa của Fe.
(5) Để giữ ấm cơ thể, trước khi lặn, người ta thường uống nước mắm cốt.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
5
-
D.
4
Cho phương trình hoá học: Fe 3 O 4 + HNO 3 → Fe(NO 3 ) 3 + N x O y + H 2 O
Sau khi cân bằng phương trình hoá học trên với hệ số của các chất là những số nguyên, tối giản thì hệ số của HNO 3 là :
-
A.
46x - 18y
-
B.
13x - 9y.
-
C.
45x - 18y.
-
D.
23x - 9y.
Cho phản ứng hoá học: \(C{l_2} + KOH \to KCl + KCl{O_3} + {H_2}O.\)
Tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tử chlorine đóng vai trò
chất khử trong phương trình hoá học của phản ứng đã cho tương ứng là
-
A.
1:5.
-
B.
5:1.
-
C.
1:3.
-
D.
3:1.
-
A.
4
-
B.
2
-
C.
3
-
D.
1
Phản ứng tổng hợp ammonia:
N 2 (g) + 3H 2 (g) → 2NH 3 (g) \( {\Delta _r}H_{298}^0 \) = -92 kJ.
Biết năng lượng liên kết (kJ/mol) của N ≡ N và H - H lần lượt là 946 và 436. Năng lượng liên kết
của N – H trong ammonia là
-
A.
391 kJ/mol.
-
B.
361 kJ/mol.
-
C.
245 kJ/mol.
-
D.
490 kJ/mol
Cho 3,16 gam KMnO 4 tác dụng với dung dịch HCl (dư), sau khi phản ứng xảy ra hoàn
toàn thì số mol HCl bị oxi hóa là
-
A.
0,02
-
B.
0,16
-
C.
0,10
-
D.
0,05
Cho các phát biểu sau :
(1) Nhỏ sulfuric acid đặc (H 2 SO 4 đặc) vào đường saccarose (C 12 H 22 O 11 ) có \(\Delta H < 0\)
(2) Số oxi hóa của nitrogen trong ion NH 4 + bằng +5.
(3) Phản ứng toả nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(4) Sự oxi hóa là sự nhường electron.
(5) Phản ứng khi CO khử FeO ở nhiệt độ phòng có thể tự diễn ra.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
5
-
D.
4
Lời giải và đáp án
Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O( l )
\({\Delta _r}H_{298}^0\) = – 890,3 kJ
Biết nhiệt tạo thành chuẩn của CO 2 (g) và H 2 O( l ) tương ứng là –393,5 ; –285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
-
A.
\({\Delta _f}H_{298}^0\) (CH 4 (g)) = –74,8 kJ/mol.
-
B.
\({\Delta _r}H_{298}^0\) (CH 4 (g)) = +748 kJ/mol
-
C.
\({\Delta _r}H_{298}^0\) (CH 4 (g)) = –748 kJ/mol
-
D.
\({\Delta _r}H_{298}^0\) (CH 4 (g)) = +74,8 kJ/mol
Đáp án : A
Dựa vào biến thiên enthalpy của phản ứng
\({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0(C{O_2}) + 2.{\Delta _f}H_{298}^0({H_2}{\rm{O}}) - {\Delta _f}H_{298}^0(C{H_4})\)= - 890,3
=> \({\Delta _f}H_{298}^0\) (CH 4 (g)) = –74,8 kJ/mol.
Đáp án A
Cho phương trình hóa học: aAl + b H 2 SO 4 → c Al 2 (SO 4 ) 3 + d SO 2 + e H 2 O
Tỉ lệ a: b là
-
A.
1: 1.
-
B.
2: 3.
-
C.
1: 3.
-
D.
1: 2.
Đáp án : C
Dựa vào phương pháp thăng bằng electron
\(\begin{array}{l}A{l^o} \to A{l^{ + 3}} + 3{\rm{e|x2}}\\{S^{ + 6}} + 2e \to {S^{ + 4}}|x3\end{array}\)
2Al + 6H 2 SO 4 → Al 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O
Tỉ lệ a:b = 1:3
Đáp án C
Phát biểu nào sau đây đúng ?
-
A.
Biến thiên enthalpy chuẩn của một phản ứng hoá học là lượng nhiệt kèm theo phản ứng đó ở áp suất 1 atm và 25 o C.
-
B.
Nhiệt (toả ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298 K là biến thiên enthalpy chuẩn của phản ứng đó.
-
C.
Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt.
-
D.
Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường
Đáp án : D
Dựa vào kiến thức về biến thiên enthalpy của phản ứng
A, B sai vì phản ứng hóa học được xảy ra ở áp suất không đổi
C sai vì phản ứng làm môi trường xung quanh nóng lên là phản ứng tỏa nhiệt
Đáp án D
Ở điều kiện chuẩn, cần phải cung cấp 26,48 kJ nhiệt lượng cho quá trình ½ mol H 2 (thể khí) phản ứng với ½ mol I 2 (thể rắn) để thu được 1 mol HI (thể khí). Ta nói enthalpy tạo thành của HI khí ở điều kiện chuẩn là 26,48 kJ mol -1 . Phản ứng trên được biểu diễn như sau:
\(\frac{1}{2}\)H 2 (g) + \(\frac{1}{2}\)I 2 (g) \( \to \)HI(g) \({\Delta _f}H_{298}^0 = 26,48\;{\rm{kJ/mol}}\;{\rm{(kJ}}\;{\rm{mo}}{{\rm{l}}^{ - 1}})\)
Ở cùng điều kiện phản ứng, nếu thu được 3 mol HI thì lượng nhiệt cần thu vào là bao nhiêu kJ?
-
A.
26,48 kJ.
-
B.
52,96 kJ.
-
C.
79,44 kJ.
-
D.
794,4 kJ.
Đáp án : C
Enthalpy tạo thành chuẩn xét cho 1 mol chất được tạo thành
Nếu thu được 3 mol HI thì lượng nhiệt cần thu vào là: 3.26,48 = 79,44 kJ
Đáp án C
Hoà tan hoàn toàn 19,2 gam một kim loại M trong dung dịch HNO 3 ta thu được 4,958 L NO (ở 25 o C và 1 bar). Kim loại M là
-
A.
Zn = 65.
-
B.
Fe = 56.
-
C.
Mg = 24.
-
D.
Cu = 64.
Đáp án : D
Dựa vào phương pháp bảo toàn electron
n NO = 4,958 : 24,79 = 0,2 mol
Giả sử hóa trị của M là x
\(\begin{array}{l}{M^o} \to {M^{ + x}} + x.e\\{N^{ + 5}} + 3e \to {N^{ + 2}}\end{array}\)
Theo bảo toàn electron: n M = \(\frac{{0,6}}{x}\)=> M M = 19,2 : \(\frac{{0,6}}{x}\)= 32x
Chọn x = 2 => M = 64 (Cu)
Đáp án D
Cho sơ đồ phản ứng sau:
S \( \to \)SO 2 \( \to \) SO 3 \( \to \)H 2 SO 4 \( \to \)SO 2 \( \to \)S\( \to \)H 2 S
Mỗi mũi tên là một phản ứng hóa học. Số phản ứng mà sulfur đóng vai trò chất oxi hóa là
-
A.
3
-
B.
2
-
C.
4
-
D.
1
Đáp án : A
Chất oxi hóa là chất nhận electron
H 2 SO 4 \( \to \)SO 2 \( \to \)S\( \to \)H 2 S
Có 3 phản ứng đóng vai trò chất oxi hóa
Đáp án A
Cho phương trình hóa học (a, b, c, d, e, g là các hệ số nguyên tối giản).
aKMnO 4 + bHCl \( \to \)cKCl + dMnCl 2 + eCl 2 + gH 2 O
Tỉ lệ b: e là
-
A.
8: 1
-
B.
16: 5
-
C.
8: 3
-
D.
12: 5
Đáp án : B
Dựa vào phương pháp bảo toàn electron
\(\begin{array}{l}M{n^{ + 7}} + 5{\rm{e}} \to M{n^{ + 2}}|x2\\C{l^{ - 1}} \to 2C{l^o} + 2{\rm{e|x5}}\end{array}\)
2KMnO 4 + 16HCl\( \to \)2KCl + 2MnCl 2 + 5Cl 2 + 8H 2 O
Tỉ lệ b: e = 16:5
Đáp án B
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:

Biến thiên enthalpy của phản ứng C 3 H 8 (g) → CH 4 (g) + C 2 H 4 (g) có giá trị là
-
A.
+103 kJ.
-
B.
– 103 kJ.
-
C.
+80 kJ.
-
D.
– 80 kJ.
Đáp án : C
Dựa vào công thức tính enthalpy của phản ứng dựa vào liên kết của chất
\({\Delta _r}H_{298}^0\)= E C3H8 – E CH4 – E C2H4 = 2. E C-C + 8. E C-H – 4. E C-H – E C=C – 4. E C-H
= 2.346 + 8. 418 – 4.418 – 612 – 4.418 = 80 kJ
Đáp án C
Cho các phát biểu sau :
(1) Phản ứng phân huỷ Fe(OH) 3 (s) không cần cung cấp nhiệt độ liên tục.
(2) Số oxi hóa của hydrogen trong các hydride kim loại bằng +1.
(3) Trộn potassium chloride (KCl) vào nước là quá trình thu nhiệt.
(4) Phản ứng của Fe(OH) 2 với dung dịch HNO 3 loãng không có sự thay đổi số oxi hóa của Fe.
(5) Để giữ ấm cơ thể, trước khi lặn, người ta thường uống nước mắm cốt.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
5
-
D.
4
Đáp án : A
Dựa vào kiến thức về năng lượng hóa học
(3), (5) đúng
Đáp án A
Cho phương trình hoá học: Fe 3 O 4 + HNO 3 → Fe(NO 3 ) 3 + N x O y + H 2 O
Sau khi cân bằng phương trình hoá học trên với hệ số của các chất là những số nguyên, tối giản thì hệ số của HNO 3 là :
-
A.
46x - 18y
-
B.
13x - 9y.
-
C.
45x - 18y.
-
D.
23x - 9y.
Đáp án : A
Dựa vào phương pháp thăng bằng electron
\(\begin{array}{l}3F{e^{ + 8/3}} \to 3F{e^{ + 3}} + 1e|x(5y - 2{\rm{x}})\\x{N^{ + 5}} + (5{\rm{x}} - 2y) \to x{N^{ + 2y/x}}|x1\end{array}\)
(5x-2y)Fe 3 O 4 + (46x-18y)HNO 3 → 3.(5x-2y)Fe(NO 3 ) 3 + N x O y + (23x-9y)H 2 O
Đáp án A
Cho phản ứng hoá học: \(C{l_2} + KOH \to KCl + KCl{O_3} + {H_2}O.\)
Tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tử chlorine đóng vai trò
chất khử trong phương trình hoá học của phản ứng đã cho tương ứng là
-
A.
1:5.
-
B.
5:1.
-
C.
1:3.
-
D.
3:1.
Đáp án : B
Dựa vào phương pháp thăng bằng electron
\(\begin{array}{l}C{l_2} + 2{\rm{e}} \to 2C{l^{ - 1}}|x5\\C{l_2} \to 2C{l^{ + 5}} + 10{\rm{e|x1}}\end{array}\)
Tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tủ chlorine đóng vai trò chất khử là 5 :1
Đáp án B
-
A.
4
-
B.
2
-
C.
3
-
D.
1
Đáp án : B
Chất oxi hóa là chất nhận electron
Phản ứng (c), (b) S đóng vai trò là chất oxi hóa
Đáp án B
Phản ứng tổng hợp ammonia:
N 2 (g) + 3H 2 (g) → 2NH 3 (g) \( {\Delta _r}H_{298}^0 \) = -92 kJ.
Biết năng lượng liên kết (kJ/mol) của N ≡ N và H - H lần lượt là 946 và 436. Năng lượng liên kết
của N – H trong ammonia là
-
A.
391 kJ/mol.
-
B.
361 kJ/mol.
-
C.
245 kJ/mol.
-
D.
490 kJ/mol
Đáp án : A
Dựa vào công thức tính \({\Delta _r}H_{298}^0\)của phản ứng theo năng lượng liên kết
\({\Delta _r}H_{298}^0\)= E N2 + 3. E H2 – 2. E NH3 = E N ≡ N + 3. E H-H – 2.3. E N-H = -92
=> E N – H = 391 kJ/mol
Đáp án A
Cho 3,16 gam KMnO 4 tác dụng với dung dịch HCl (dư), sau khi phản ứng xảy ra hoàn
toàn thì số mol HCl bị oxi hóa là
-
A.
0,02
-
B.
0,16
-
C.
0,10
-
D.
0,05
Đáp án : C
Viết phương trình phản ứng oxi hóa của KMnO 4 và HCl
n KMnO4 = 3,16 : 158 = 0,02 mol
2KMnO 4 + 16HCl \( \to \)2KCl + 2MnCl 2 + 5Cl 2 + 8H 2 O
Theo bảo toàn electron: n HCl bị oxi hóa = 0,1 mol
Đáp án C
Cho các phát biểu sau :
(1) Nhỏ sulfuric acid đặc (H 2 SO 4 đặc) vào đường saccarose (C 12 H 22 O 11 ) có \(\Delta H < 0\)
(2) Số oxi hóa của nitrogen trong ion NH 4 + bằng +5.
(3) Phản ứng toả nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(4) Sự oxi hóa là sự nhường electron.
(5) Phản ứng khi CO khử FeO ở nhiệt độ phòng có thể tự diễn ra.
Số phát biểu đúng là
-
A.
2
-
B.
3
-
C.
5
-
D.
4
Đáp án : B
Dựa vào kiến thức hóa học về phản ứng oxi hóa khử
(1) đúng
(2) sai vì số oxi hóa của N là -3
(3) đúng
(4) đúng
(5) sai, phản ứng diễn ra ở nhiệt độ cao
Đáp án B
n Mg = 2,4 : 24 = 0,1 mol
\(\begin{array}{l}M{g^o} \to M{g^{ + 2}} + 2{\rm{e|x4}}\\2{N^{ + 5}} + 8e \to 2{N^{ + 1}}\end{array}\)
Theo bảo toàn electron: 2n Mg = 8.n N2O => n N2O = 0,025 mol => V N2O = 0,025.24,79 = 0,62l
(a) \({\Delta _r}H_{298}^0(1) = {\Delta _f}H_{298}^0(S{O_2}) + {\Delta _f}H_{298}^0({H_2}{\rm{O}}) - {\Delta _f}H_{298}^0({H_2}{\rm{S}})\)
= -296,8 + (-241,8) – (-20,7) = -517,9 kJ
\({\Delta _r}H_{298}^0(2) = {\Delta _f}H_{298}^0({H_2}{\rm{O}}) - {\Delta _f}H_{298}^0({H_2}{\rm{S}})\)= (-241,8) – (-20,7) = -221,1 kJ
Phản ứng (1) (2) đều thuận lợi về mặt năng lượng.
b) trong môi trường không khí mà nồng độ oxygen bị suy giảm, hydrogen sulfide dễ chuyển hóa thành sulfur vì phản ứng (2) cần ít oxygen hơn.