Đề thi giữa kì 2 Hóa 10 - Chân trời sáng tạo - Đề số 1
Chromium có số oxi hóa +2 trong hợp chất nào sau đây?
Đề bài
Chromium có số oxi hóa +2 trong hợp chất nào sau đây?
-
A.
Cr(OH) 3
-
B.
Na 2 CrO 4
-
C.
CrCl 2
-
D.
Cr 2 O 3
Hệ số cân bằng (nguyên, tối giản) của Cu 2 S và HNO 3 trong phản ứng:
Cu 2 S + HNO 3 → Cu(NO 3 ) 2 + H 2 SO 4 + NO + H 2 O là
-
A.
3 và 22.
-
B.
3 và 18.
-
C.
3 và 10.
-
D.
3 và 12.
Cho các phản ứng sau:
(a) 4HCl + PbO 2 \( \to \)PbCl 2 + Cl 2 + 2H 2 O
(b) HCl + NH 4 HCO 3 \( \to \)NH 4 Cl + CO 2 + H 2 O
(c) 2HCl + 2HNO 3 \( \to \)2NO 2 + Cl 2 + 2H 2 O
(d) 2HCl + Zn \( \to \)ZnCl 2 + H 2
Số phản ứng trong đó HCl thể hiện tính khử là
-
A.
2
-
B.
4
-
C.
1
-
D.
3
Thuốc tím chứa ion permanganate (MnO 4 - ) có tính oxi hóa mạnh, được dùng để sát trùng, diệt khuẩn trong y học, đời sống và nuôi trồng thủy sản. Số oxi hóa của mangase trong ion permanganate là:
-
A.
+ 2
-
B.
+3
-
C.
+7
-
D.
+6
Dẫn khí SO 2 vào 100ml dung dịch KMnO 4 0,02M đến khi dung dịch vừa mất màu tím. Phản ứng xảy ra theo sơ đồ sau: SO 2 + KMnO 4 + H 2 O → H 2 SO 4 + K 2 SO 4 + MnSO 4
Thể tích khí SO 2 đã tham gia phản ứng ở điều kiện chuẩn là:
-
A.
1,24 lít
-
B.
12,4 lít
-
C.
0,124 lít
-
D.
0,2479 lít
Số quá trình thu nhiệt trong các quá trình sau:
(1) Nước hóa rắn
(2) Sự tiêu hóa thức ăn
(3) Qúa trình chạy của con người
(4) Khí CH 4 đốt ở trong lò
(5) Hòa tan KBr vào nước làm cho nước trở nên lạnh
(6) Sulfuric acid đặc khi thêm vào nước làm cho nước nóng lên.
-
A.
4
-
B.
2
-
C.
5
-
D.
6
Điều kiện nào sau đây không phải là điều kiện chuẩn?
-
A.
Áp suất 1 bar và nhiệt độ 25 o C hay 298K
-
B.
Áp suất 1 bar và nhiệt độ 298K
-
C.
Áp suất 1 bar và nhiệt độ 25 o C
-
D.
Áp suất 1 bar và nhiệt độ 25K
Dựa vào phương trình hóa học của các phản ứng sau:
(1) CS 2 (l) + 3O 2 (g) \( \to \)CO 2 (g) + 2SO 2 (g) \({\Delta _r}H_{298}^0\)= -1110,21 kJ
(2) CO 2 (g) \( \to \)CO(g) + ½ O 2 (g) \({\Delta _r}H_{298}^0\)=280,00 kJ
(3) Na(s) + 2H 2 O(l) \( \to \)NaOH(aq) + H 2 (g) \({\Delta _r}H_{298}^0\)= -367,50 kJ
(4) ZnSO 4 (s) \( \to \)ZnO(s) + SO 3 (g) \({\Delta _r}H_{298}^0\) = 235,21 kJ
Cặp phản ứng thu nhiệt là:
-
A.
1 và 2
-
B.
3 và 4
-
C.
1 và 3
-
D.
2 và 4
Bình “ga” loại 12 cân sử dụng trong hộ gia đình Y có chứa 12 kg khí hóa lỏng (LPG) gồm propane và butane với tỉ lệ mol tương ứng là 2 : 3. Khi đốt cháy hoàn toàn, 1 mol propane (C3H8) tỏa ra lượng nhiệt là 2220 kJ và 1 mol butane (C4H10) tỏa ra lượng nhiệt là 2850 kJ. Trung bình, lượng nhiệt tiêu thụ từ đốt khí “ga” của hộ gia đình Y là 10 000 kJ/ngày và hiệu suất sử dụng nhiệt là 67,3%. Sau bao nhiêu ngày hộ gia đình Y sử dụng hết bình ga trên?
-
A.
30 ngày.
-
B.
60 ngày.
-
C.
40 ngày.
-
D.
20 ngày.
Để xác định hàm lượng S trong một loại nhiên liệu, người ta tiến hành đốt cháy 10 gam mẫu nhiên liệu đó, sau đó cho toàn bộ lượng khí SO 2 sinh ra vào dung dịch KMnO 4 0,1M, thì thấy thể tích dung dịch KMnO 4 phản ứng vừa đủ là 5 mL. Biết trong phản ứng trên, Mn +7 đã bị khử thành Mn +2 . Phần trăm khối lượng S trong loại nhiên liệu trên là:
-
A.
0,40%.
-
B.
0,60%.
-
C.
0,75%.
-
D.
1,00%.
Cho phản ứng: C 2 H 6 (g) + Cl 2 (g) \( \to \)C 2 H 5 Cl(g) + HCl (g). Biết

\({\Delta _r}H_{298}^0\)của phản ứng là:
-
A.
-215 kJ
-
B.
114 J
-
C.
-114 kJ
-
D.
215 kJ
Phản ứng của 1 mol ethanol lỏng với oxygen xảy ra theo phương trình:
\({C_2}{H_5}{\rm{O}}H(l) + {O_2}(g) \to C{O_2}(g) + {H_2}{\rm{O}}(l)(1)\)
Những nhận định nào sau đây là đúng?
(1) Đây là phản ứng tỏa nhiệt vì nó tạo ra khí CO 2 và nước lỏng
(2) Đây là phản ứng oxi hóa – khử với tổng số hệ số cân bằng trong phương trình là 9
(3) Biến thiên enthalpy chuẩn của phản ứng sẽ thay đổi nếu nước tạo ra ở thể khí
(4) Sản phẩm của phản ứng chiếm một thể tích lớn hơn so với chất phản ứng
-
A.
(1), (2)
-
B.
(1), (2), (3)
-
C.
(1), (3), (4)
-
D.
(2), (3)
Kim loại nhôm có thể khử được oxide của nhiều nguyên tố. Dựa vào bảng enthalpy tạo thành chuẩn của các chất biết \({\Delta _f}H_{298}^0\)của Fe 3 O 4 và Al 2 O 3 lần lượt là -1118,4 và -1675,7 kJ/mol biến thiên enthalpy của phản ứng nhôm khử 1 mol Fe 3 O 4 (s) là:
-
A.
3341,00 kJ
-
B.
– 3347,6 kJ
-
C.
1113,67 kJ
-
D.
-1113,67 kJ
Phản ứng giữa 2 mol khí hydrogen và 1 mol khí oxygen tạo thành 2 mol H 2 O lỏng, giải phóng nhiệt lượng 571,68 kJ. Phương trình nhiệt hóa học được biểu diễn là
-
A.
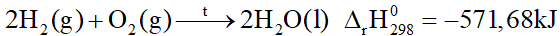
-
B.
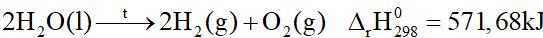
-
C.
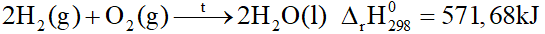
-
D.

Ở điều kiện chuẩn, cần phải cung cấp 26,48 kJ nhiệt lượng cho quá trình ½ mol H 2 (g) phản ứng với ½ mol I 2 (s) để thu được 1 mol HI(s). Ta nói enthalpy tạo thành của HI (g) ở điều kiện chuẩn là 26,48 kJ/mol. Phản ứng trên được biểu diễn như sau: \(\frac{1}{2}{H_2}(g) + \frac{1}{2}{I_2}(s) \to HI(g){\rm{ }}{\Delta _{\rm{f}}}{\rm{H}}_{298}^0 = 26,48kJ/mol\)
ở cùng điều kiện phản ứng, nếu thu được 3 mol HI thì lượng nhiệt cần thu vào là:
-
A.
26,48 kJ
-
B.
52,96 kJ
-
C.
794,4 kJ
-
D.
79,44 kJ
Lời giải và đáp án
Chromium có số oxi hóa +2 trong hợp chất nào sau đây?
-
A.
Cr(OH) 3
-
B.
Na 2 CrO 4
-
C.
CrCl 2
-
D.
Cr 2 O 3
Đáp án : C
Dựa vào quy tắc xác định số oxi hóa
Cr có số oxi hóa + 2 trong hợp chất CrCl 2
Đáp án C
Hệ số cân bằng (nguyên, tối giản) của Cu 2 S và HNO 3 trong phản ứng:
Cu 2 S + HNO 3 → Cu(NO 3 ) 2 + H 2 SO 4 + NO + H 2 O là
-
A.
3 và 22.
-
B.
3 và 18.
-
C.
3 và 10.
-
D.
3 và 12.
Đáp án : A
Dựa vào phương pháp thăng bằng electron
\(\begin{array}{l}{(C{u_2}S)^o} \to 2C{u^{ + 2}} + {S^{ + 6}} + 10e|x3\\{N^{ + 5}} + 3e \to {N^{ + 2}}|x10\end{array}\)
3Cu 2 S + 22HNO 3 → 6Cu(NO 3 ) 2 + 3H 2 SO 4 + 10NO + 8H 2 O
Hệ số cân bằng tối giẩn của Cu 2 S và HNO 3 là 3 và 22
Đáp án A
Cho các phản ứng sau:
(a) 4HCl + PbO 2 \( \to \)PbCl 2 + Cl 2 + 2H 2 O
(b) HCl + NH 4 HCO 3 \( \to \)NH 4 Cl + CO 2 + H 2 O
(c) 2HCl + 2HNO 3 \( \to \)2NO 2 + Cl 2 + 2H 2 O
(d) 2HCl + Zn \( \to \)ZnCl 2 + H 2
Số phản ứng trong đó HCl thể hiện tính khử là
-
A.
2
-
B.
4
-
C.
1
-
D.
3
Đáp án : A
Chất khử là chất nhường electron
(a), (c) HCl thể hiện tính khử
Đáp án A
Thuốc tím chứa ion permanganate (MnO 4 - ) có tính oxi hóa mạnh, được dùng để sát trùng, diệt khuẩn trong y học, đời sống và nuôi trồng thủy sản. Số oxi hóa của mangase trong ion permanganate là:
-
A.
+ 2
-
B.
+3
-
C.
+7
-
D.
+6
Đáp án : C
Dựa vào quy tắc xác định số oxi hóa
Số oxi hóa của Mn trong MnO 4 - là: x + 4.(-2) = -1 => x = +7
Đáp án C
Dẫn khí SO 2 vào 100ml dung dịch KMnO 4 0,02M đến khi dung dịch vừa mất màu tím. Phản ứng xảy ra theo sơ đồ sau: SO 2 + KMnO 4 + H 2 O → H 2 SO 4 + K 2 SO 4 + MnSO 4
Thể tích khí SO 2 đã tham gia phản ứng ở điều kiện chuẩn là:
-
A.
1,24 lít
-
B.
12,4 lít
-
C.
0,124 lít
-
D.
0,2479 lít
Đáp án : C
Dựa vào phương pháp thăng bằng electron
\(\begin{array}{l}{S^{ + 4}} \to {S^{ + 6}} + 2e|x5\\M{n^{ + 7}} + 5{\rm{e}} \to M{n^{ + 2}}|x2\end{array}\)
5SO 2 + 2KMnO 4 + 2H 2 O → 2H 2 SO 4 + K 2 SO 4 + 2MnSO 4
n KMnO4 = 0,1 . 0,02 = 0,002 mol
Theo phản ứng: n SO2 = 5/2 n KMnO4 = 5/2 . 0,002 = 0,005 mol
V SO2 = 0,005 . 24,79 = 0,124 lít
Đáp án C
Số quá trình thu nhiệt trong các quá trình sau:
(1) Nước hóa rắn
(2) Sự tiêu hóa thức ăn
(3) Qúa trình chạy của con người
(4) Khí CH 4 đốt ở trong lò
(5) Hòa tan KBr vào nước làm cho nước trở nên lạnh
(6) Sulfuric acid đặc khi thêm vào nước làm cho nước nóng lên.
-
A.
4
-
B.
2
-
C.
5
-
D.
6
Đáp án : B
Quá trình thu nhiệt là quá trình hấp thu năng lượng dưới dạng nhiệt
(1), (5) là quá trình thu nhiệt
Đáp án B
Điều kiện nào sau đây không phải là điều kiện chuẩn?
-
A.
Áp suất 1 bar và nhiệt độ 25 o C hay 298K
-
B.
Áp suất 1 bar và nhiệt độ 298K
-
C.
Áp suất 1 bar và nhiệt độ 25 o C
-
D.
Áp suất 1 bar và nhiệt độ 25K
Đáp án : D
Điều kiện chuẩn được thực hiện ở áp suất 1 bar và nhiệt độ 25 o C hay 298K
Áp suất 1 bar và nhiệt độ 25K không phải là điều kiện chuẩn
Đáp án D
Dựa vào phương trình hóa học của các phản ứng sau:
(1) CS 2 (l) + 3O 2 (g) \( \to \)CO 2 (g) + 2SO 2 (g) \({\Delta _r}H_{298}^0\)= -1110,21 kJ
(2) CO 2 (g) \( \to \)CO(g) + ½ O 2 (g) \({\Delta _r}H_{298}^0\)=280,00 kJ
(3) Na(s) + 2H 2 O(l) \( \to \)NaOH(aq) + H 2 (g) \({\Delta _r}H_{298}^0\)= -367,50 kJ
(4) ZnSO 4 (s) \( \to \)ZnO(s) + SO 3 (g) \({\Delta _r}H_{298}^0\) = 235,21 kJ
Cặp phản ứng thu nhiệt là:
-
A.
1 và 2
-
B.
3 và 4
-
C.
1 và 3
-
D.
2 và 4
Đáp án : D
Phản ứng thu nhiệt có \({\Delta _r}H_{298}^0\)> 0
(2), (4) có \({\Delta _r}H_{298}^0\)> 0 => phản ứng thu nhiệt
Đáp án D
Bình “ga” loại 12 cân sử dụng trong hộ gia đình Y có chứa 12 kg khí hóa lỏng (LPG) gồm propane và butane với tỉ lệ mol tương ứng là 2 : 3. Khi đốt cháy hoàn toàn, 1 mol propane (C3H8) tỏa ra lượng nhiệt là 2220 kJ và 1 mol butane (C4H10) tỏa ra lượng nhiệt là 2850 kJ. Trung bình, lượng nhiệt tiêu thụ từ đốt khí “ga” của hộ gia đình Y là 10 000 kJ/ngày và hiệu suất sử dụng nhiệt là 67,3%. Sau bao nhiêu ngày hộ gia đình Y sử dụng hết bình ga trên?
-
A.
30 ngày.
-
B.
60 ngày.
-
C.
40 ngày.
-
D.
20 ngày.
Đáp án : C
Gọi số mol của C 3 H 8 và C 4 H 10 lần lượt là 2a và 3a
m C3H8 + m C4H10 = 12.10 3 => 44.2a + 56.3a = 12.10 3 => a = 46,875 mol
=> n C3H8 = 93,75 mol; n C4H10 = 140,625 mol
Nhiệt lượng tỏa ra khi đốt cháy khí gas trong bình là:
93,75.2220 + 140,625.2850 = 608906,25 kJ
Số ngày sử dụng hộ gia đình hết bình gas là: 608906,25.67,3% : 10 000 = 41 ngày
Đáp án C
Để xác định hàm lượng S trong một loại nhiên liệu, người ta tiến hành đốt cháy 10 gam mẫu nhiên liệu đó, sau đó cho toàn bộ lượng khí SO 2 sinh ra vào dung dịch KMnO 4 0,1M, thì thấy thể tích dung dịch KMnO 4 phản ứng vừa đủ là 5 mL. Biết trong phản ứng trên, Mn +7 đã bị khử thành Mn +2 . Phần trăm khối lượng S trong loại nhiên liệu trên là:
-
A.
0,40%.
-
B.
0,60%.
-
C.
0,75%.
-
D.
1,00%.
Đáp án : A
Dựa vào phản ứng oxi hóa khử
n KMnO4 = 5.10 -3 . 0,1 = 5.10 -4 mol
5SO 2 + 2KMnO 4 + 2H 2 O → 2H 2 SO 4 + K 2 SO 4 + 2MnSO 4
12,5.10 -4 5.10 -4
%S = \(\frac{{12,{{5.10}^{ - 4}}.32}}{{10}}.100 = 0,4\% \)
Đáp án A
Cho phản ứng: C 2 H 6 (g) + Cl 2 (g) \( \to \)C 2 H 5 Cl(g) + HCl (g). Biết

\({\Delta _r}H_{298}^0\)của phản ứng là:
-
A.
-215 kJ
-
B.
114 J
-
C.
-114 kJ
-
D.
215 kJ
Đáp án : C
Dựa vào công thức tính \({\Delta _r}H_{298}^0\)theo năng lượng liên kết của các chất
\({\Delta _r}H_{298}^0\)= E C2H6 + E Cl2 – E C2H5Cl – E HCl
= E C-C + 6. E C-H + E Cl – Cl – E C-C – E C – Cl – 5. E C – H - E H-Cl
= 347 + 6. 414 + 243 – 347 – 339 – 5.414 – 432 = - 114 kJ.
Đáp án C
Phản ứng của 1 mol ethanol lỏng với oxygen xảy ra theo phương trình:
\({C_2}{H_5}{\rm{O}}H(l) + {O_2}(g) \to C{O_2}(g) + {H_2}{\rm{O}}(l)(1)\)
Những nhận định nào sau đây là đúng?
(1) Đây là phản ứng tỏa nhiệt vì nó tạo ra khí CO 2 và nước lỏng
(2) Đây là phản ứng oxi hóa – khử với tổng số hệ số cân bằng trong phương trình là 9
(3) Biến thiên enthalpy chuẩn của phản ứng sẽ thay đổi nếu nước tạo ra ở thể khí
(4) Sản phẩm của phản ứng chiếm một thể tích lớn hơn so với chất phản ứng
-
A.
(1), (2)
-
B.
(1), (2), (3)
-
C.
(1), (3), (4)
-
D.
(2), (3)
Đáp án : D
Dựa vào kiến thức về năng lượng hóa học
Cân bằng phương trình oxi hóa khử đốt cháy ethanol:
\({C_2}{H_5}{\rm{O}}H(l) + 3{O_2}(g) \to 2C{O_2}(g) + 3{H_2}{\rm{O}}(l)(1)\)
Tổng hệ số phương trình là 9
Biến thiên enthalpy chuẩn của phản ứng thay đổi nếu tạo ra nước ở thể khí vì nhiệt tạo thành của nước ở 2 thể khác nhau
(1) sai vì phản ứng tỏa nhiệt hay thu nhiệt dựa vào \({\Delta _r}H_{298}^0\)của phản ứng
(4) sai vì tổng thể tích sản phẩm lớn hơn tổng thể tích chất tham gia
Đáp án D
Kim loại nhôm có thể khử được oxide của nhiều nguyên tố. Dựa vào bảng enthalpy tạo thành chuẩn của các chất biết \({\Delta _f}H_{298}^0\)của Fe 3 O 4 và Al 2 O 3 lần lượt là -1118,4 và -1675,7 kJ/mol biến thiên enthalpy của phản ứng nhôm khử 1 mol Fe 3 O 4 (s) là:
-
A.
3341,00 kJ
-
B.
– 3347,6 kJ
-
C.
1113,67 kJ
-
D.
-1113,67 kJ
Đáp án : B
Dựa vào nhiệt tạo thành chuẩn của chất
8Al + 3Fe 3 O 4 \( \to \) 4Al 2 O 3 + 9Fe
\({\Delta _r}H_{298}^0\)= \(4.{\Delta _f}H_{298}^0(A{l_2}{O_3}) - 3.{\Delta _f}H_{298}^0(F{e_3}{O_4})\)= 4. (-1675,7) – 3.(-1118,4) = -3347,6 kJ
Đáp án B
Phản ứng giữa 2 mol khí hydrogen và 1 mol khí oxygen tạo thành 2 mol H 2 O lỏng, giải phóng nhiệt lượng 571,68 kJ. Phương trình nhiệt hóa học được biểu diễn là
-
A.
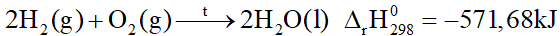
-
B.
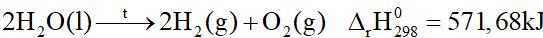
-
C.
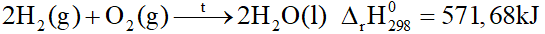
-
D.

Đáp án : A
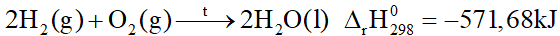
Đáp án A
Ở điều kiện chuẩn, cần phải cung cấp 26,48 kJ nhiệt lượng cho quá trình ½ mol H 2 (g) phản ứng với ½ mol I 2 (s) để thu được 1 mol HI(s). Ta nói enthalpy tạo thành của HI (g) ở điều kiện chuẩn là 26,48 kJ/mol. Phản ứng trên được biểu diễn như sau: \(\frac{1}{2}{H_2}(g) + \frac{1}{2}{I_2}(s) \to HI(g){\rm{ }}{\Delta _{\rm{f}}}{\rm{H}}_{298}^0 = 26,48kJ/mol\)
ở cùng điều kiện phản ứng, nếu thu được 3 mol HI thì lượng nhiệt cần thu vào là:
-
A.
26,48 kJ
-
B.
52,96 kJ
-
C.
794,4 kJ
-
D.
79,44 kJ
Đáp án : D
Dựa vào kiến thức về năng lượng hóa học
Để thu được 3 mol HI thì lượng nhiệt cần thu vào là: 3.26,48 = 79,44 kJ
Đáp án D
Khối lượng carbon trong 1,6 kg than là: 90%.1,6 = 1,44kg
n C = 1,44 : 12 = 0,12 k.mol = 120 mol
Lượng nhiệt cung cấp khi đốt cháy 120 mol carbon là: 120 . 393,5 = 47220 kJ
Số điện tương đương với lượng nhiệt đốt cháy là: 47220 : 3600 = 13 số điện
5CaC 2 O 4 + 2KMnO 4 + 8H 2 SO 4 → 5CaSO 4 + K 2 SO 4 + 2MnSO 4 + 8H 2 O + 10CO 2
Số mol KMnO 4 cần dùng để phản ứng hết với calcium oxalate kết tủa từ 1 mL máu là:
2,05.10 -3 .4,88.10 -4 = 10 -6 mol
Số mol CaSO 4 = 5/2. Số mol KMnO 4 = 2,5x10 -6 mol
Khối lượng ion calcium (mg) trong 100 mL máu là: 2,5.10 -6 .40.10 3 . 100 = 10mg/100 mL.