Đề thi giữa kì 2 Hóa 10 - Chân trời sáng tạo - Đề số 6
Dấu hiệu để nhận ra một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của
Đề bài
Dấu hiệu để nhận ra một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
-
A.
Số khối
-
B.
Số oxi hóa
-
C.
Số hiệu
-
D.
Số mol
Cho các phân tử có công thức cấu tạo sau:
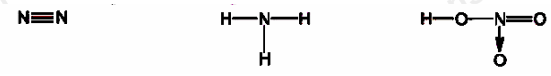
Số oxi hóa của nguyên tử N trong các phân tử lần lượt từ trái qua phải là
-
A.
0,-3, -4
-
B.
0, +3, +5
-
C.
-3, -3, +4
-
D.
0, -3, +5
Cho phản ứng hóa học sau đây:
 . Phát biểu nào sau đây không đúng?
. Phát biểu nào sau đây không đúng?
-
A.
O 2 là chất oxi hóa
-
B.
Sự khử là: C o \( \to \)C +4 + 4e
-
C.
Sự khử là: \(\mathop {{O_2}}\limits^o + 4{\rm{e}} \to 2\mathop O\limits^{ - 2} \)
-
D.
C là chất khử
Trong phản ứng: 2NO 2 + 2NaOH \( \to \)NaNO 3 + NaNO 2 + H 2 O. Vai trò của NO 2 là
-
A.
chỉ bị oxi hóa
-
B.
vừa bị oxi hóa, vừa bị khử
-
C.
acid oxide
-
D.
chỉ bị khử
Cho phản ứng hóa học: Fe + CuSO 4 \( \to \) FeSO 4 + Cu. Trong phản ứng xảy ra
-
A.
sự khử Fe 2+ và sự oxi hóa Cu
-
B.
sự khử Fe 2+ và sự khử Cu 2+
-
C.
sự oxi hóa Fe và sự khử Cu 2+
-
D.
sự oix hóa Fe và sự oxi hóa Cu
Cho sơ đồ phản ứng oxi hóa – khử: Cu + HNO 3 \( \to \) Cu(NO 3 ) 2 + NO + H 2 O. Tỉ lệ mol giữa chất khử và chất oxi hóa là:
-
A.
8:3
-
B.
1:4
-
C.
3:8
-
D.
4:1
Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
-
A.
6HNO 3 + Fe 2 O 3 \( \to \) 2Fe(NO 3 ) 3 + 3H 2 O
-
B.
2Al + 6HCl \( \to \) 2AlCl 3 + 3H 2
-
C.
2H 2 S + SO 2 \( \to \) 3S + 2H 2 O
-
D.
3Cu + 8HNO 3 \( \to \) 3Cu(NO 3 ) 2 + 2NO + 4H 2 O
Hòa tan 9,6 gam magnesium trong dung dịch HNO 3 thu được dung dịch muối và 2,479 lít (đkc) khí X (sản phẩm khử duy nhất). Khí X là
-
A.
NO 2
-
B.
N 2 O
-
C.
N 2
-
D.
NO
Cho 8,6765 lít (đkc) hỗn hợp khí O 2 và Cl 2 tác dụng vừa đủ với hỗn hợp chứa 0,2 mol Mg và 0,2 mol Al thu được m gam hỗn hợp muối chloride và oxide. Giá trị của m là
-
A.
21,7
-
B.
35,35
-
C.
27,55
-
D.
29,20
Phản ứng nào sau đây là phản ứng tỏa nhiệt?
-
A.
phản ứng nhiệt phân muối KNO 3
-
B.
phản ứng phân hủy khí NH 3
-
C.
phản ứng oxi hóa glucose trong cơ thể
-
D.
phản ứng hòa tan NH 4 Cl trong nước
Phương trình nhiệt hóa học: 3H 2 (g) + N 2 (g) \( \to \) 2NH 3 (g) \({\Delta _r}H_{298}^o = - 91,80kJ\)
Lượng nhiệt tỏa ra khi dùng 9 gam H 2 (g) để tạo thành NH 3 (g) là
-
A.
-275,40 kJ
-
B.
-137,80 kJ
-
C.
-45,90 kJ
-
D.
-183,60 kJ
Phát biểu nào sau đây đúng?
-
A.
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol L -1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K.
-
B.
Điều kiện chuẩn là điều kiện ứng với nhiệt độ 298 K.
-
C.
Áp suất 760 mmHg là áp suất ở điều kiện chuẩn.
-
D.
Điều kiện chuẩn là điều kiện ứng với áp suất 1 atm, nhiệt độ 0 0 C.
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
-
A.
2C (than chì) + O 2 (g) \( \to \) 2CO(g)
-
B.
C (than chì) + O(g) \( \to \) CO(g)
-
C.
C (than chì) + ½ O 2 (g) \( \to \) CO(g)
-
D.
C (than chì) + CO 2 (g) \( \to \) 2CO(g)
-
A.
Phản ứng tỏa nhiệt
-
B.
Phản ứng thu nhiệt
-
C.
Vừa thu, vừa tỏa nhiệt
-
D.
Không thuộc loại nào
Cho các phản ứng dưới đây:
(1) CO(g) + ½ O 2 (g) \( \to \) CO 2 (g) \({\Delta _r}H_{298}^o = - 283kJ\)
(2) C(s) + H 2 O(g) \( \to \)CO(g) + H 2 (g) \({\Delta _r}H_{298}^o = 131,25kJ\)
(3) H 2 (g) + F 2 (g) \( \to \) 2HF(g) \({\Delta _r}H_{298}^o = - 546kJ\)
(4) H 2 (g) + Cl 2 (g) \( \to \) 2HCl(g) \({\Delta _r}H_{298}^o = - 184,62kJ\)
Phản ứng xảy ra thuận lợi nhất là
-
A.
phản ứng (1)
-
B.
phản ứng (2)
-
C.
phản ứng (3)
-
D.
phản ứng (4)
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn
4FeS 2 (s) + 11O 2 (g) \( \to \) 2Fe 2 O 3 (s) + 8SO 2 (g)
Cho nhiệt tạo thành của các chất trong bảng sau:
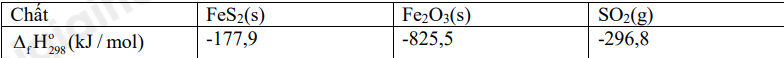
Cho các mệnh đều sau:
a) \({\Delta _f}H_{298}^o({O_2},g) = 0kJ\)
b) \({\Delta _f}H_{298}^o(sp) = - 4025,4kJ\)
c) \({\Delta _f}H_{298}^o(c{\rm{d}}) = - 711,6kJ\)
d) Đây là phản ứng tỏa nhiệt
Số mệnh đề đúng là
-
A.
3
-
B.
4
-
C.
2
-
D.
1
Cho các đơn chất sau đây: C(graphite,s), Br 2 (g), Na(s), Na(g), Hg(l), Hg(s). Số đơn chất có \( {\Delta _f}H_{298}^o = 0kJ \) là
-
A.
5
-
B.
6
-
C.
4
-
D.
3
Tiến hành quá trình ozone hóa 100gam oxygen theo phản ứng sau: 3O 2 (g) \( \to \)2O 3 (g)
Hỗn hợp thu được có chứa 24% ozone về khối lượng, tiêu tốn 71,2 kJ. Nhiệt tạo thành \( {\Delta _f}H_{298}^o \) của ozone (kJ/mol) có giá trị là
-
A.
142,4
-
B.
282,8
-
C.
-142,4
-
D.
-284,8
Cho 2 phương trình nhiệt hóa học sau:
0,5H 2 (g) + 0,5I 2 (g) \( \to \) HI(g) (1) \({\Delta _r}H_{298}^o(1) = 25,9kJ\)
HI(g) \( \to \) 0,5H 2 + 0,5I 2 (2)
Biến thiên enthalpy của phản ứng (2) là
-
A.
-51,8 kJ
-
B.
51,8 kJ
-
C.
25,9 kJ
-
D.
-25,9 kJ
Thành phần chính của đa số các loại đá dùng trong xây dựng là CaCO
3
, chúng vừa có tác dụng chịu nhiệt, vừa chịu được lực. Cho phản ứng sau:

Biết \({\Delta _f}H_{298}^o\)(CaCO 3 (s) = -1206,09 (kJ/mol); \({\Delta _f}H_{298}^o\)(CaO(s)) = -635,10 (kJ/mol); \({\Delta _f}H_{298}^o\)(CO 2 ,g) = -393,50 (kJ/mol). Giá trị \({\Delta _r}H_{298}^o\)của phản ứng tính theo kJ là
-
A.
178,3
-
B.
-178,3
-
C.
138,7
-
D.
-138,7
Lời giải và đáp án
Dấu hiệu để nhận ra một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
-
A.
Số khối
-
B.
Số oxi hóa
-
C.
Số hiệu
-
D.
Số mol
Đáp án : B
Dựa vào lý thuyết về phản ứng oxi hóa – khử
Dấu hiệu để nhận ra một phản ứng oxi hóa – khử là dựa trên sự thay đổi số oxi hóa của nguyên tử
Đáp án B
Cho các phân tử có công thức cấu tạo sau:

Số oxi hóa của nguyên tử N trong các phân tử lần lượt từ trái qua phải là
-
A.
0,-3, -4
-
B.
0, +3, +5
-
C.
-3, -3, +4
-
D.
0, -3, +5
Đáp án : D
Cách xác định số oxi hóa
Số oxi hóa của nguyên tử N trong các phân tử trên lần lượt từ trái qua phải là 0, -3, +5
Cho phản ứng hóa học sau đây:
 . Phát biểu nào sau đây không đúng?
. Phát biểu nào sau đây không đúng?
-
A.
O 2 là chất oxi hóa
-
B.
Sự khử là: C o \( \to \)C +4 + 4e
-
C.
Sự khử là: \(\mathop {{O_2}}\limits^o + 4{\rm{e}} \to 2\mathop O\limits^{ - 2} \)
-
D.
C là chất khử
Đáp án : B
Khái niệm chất khử, chất oxi hóa, sự khử, sự oxi hóa:
- Chất khử (bị oxi hóa) là chất cho electron ⟹ số oxi hóa tăng.
- Chất oxi hóa (bị khử) là chất nhận eletron ⟹ số oxi hóa giảm.
- Sự khử (quá trình khử) là quá trình nhận electron.
- Sự oxi hóa (quá trình oxi hóa) là quá trình cho electron.
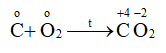
Sự oxi hóa: C o \( \to \)C +4 + 4e => C là chất khử
Sự khử: \(\mathop {{O_2}}\limits^o + 4{\rm{e}} \to 2\mathop O\limits^{ - 2} \) => O 2 là chất oxi hóa
Đáp án B
Trong phản ứng: 2NO 2 + 2NaOH \( \to \)NaNO 3 + NaNO 2 + H 2 O. Vai trò của NO 2 là
-
A.
chỉ bị oxi hóa
-
B.
vừa bị oxi hóa, vừa bị khử
-
C.
acid oxide
-
D.
chỉ bị khử
Đáp án : B
Dựa vào sự thay đổi số oxi hóa của N để xác định vai trò NO2 trong phản ứng
\(2\mathop N\limits^{ + 4} {O_2} + 2NaOH \to Na\mathop N\limits^{ + 5} {O_3} + Na\mathop N\limits^{ + 3} {O_2} + {H_2}{\rm{O}}\)
Ta thấy N trong NO 2 vừa tăng lên +5 trong NaNO3, vừa giảm xuống +3 trong NaNO 2
=> NO 2 vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa
Đáp án B
Cho phản ứng hóa học: Fe + CuSO 4 \( \to \) FeSO 4 + Cu. Trong phản ứng xảy ra
-
A.
sự khử Fe 2+ và sự oxi hóa Cu
-
B.
sự khử Fe 2+ và sự khử Cu 2+
-
C.
sự oxi hóa Fe và sự khử Cu 2+
-
D.
sự oix hóa Fe và sự oxi hóa Cu
Đáp án : C
Xác định số oxi hóa của các chất => chất khử, chất oxi hóa (sự oxi hóa, sự khử)
\(\mathop {Fe}\limits^o + \mathop {Cu}\limits^{ + 2} S{O_4} \to \mathop {Fe}\limits^{ + 2} S{O_4} + \mathop {Cu}\limits^o \)
Fe là chất khử và CuSO 4 là chất oxi hóa
Vậy trong phản ứng xảy ra sự oxi hóa Fe và sự khử Cu 2+
Đáp án C
Cho sơ đồ phản ứng oxi hóa – khử: Cu + HNO 3 \( \to \) Cu(NO 3 ) 2 + NO + H 2 O. Tỉ lệ mol giữa chất khử và chất oxi hóa là:
-
A.
8:3
-
B.
1:4
-
C.
3:8
-
D.
4:1
Đáp án : C
- Dựa vào sự thay đổi số oxi hóa ⟹ Xác định chất khử (số oxi hóa của nguyên tố tăng sau phản ứng) và chất oxi hóa (số oxi hóa của nguyên tố giảm sau phản ứng).
- Cân bằng phương trình theo phương pháp thăng bằng electron.
Chất khử: \(C{u^o} \to C{u^{ + 2}} + 2{\rm{e}}|x3\)
Chất oxi hóa: \({N^{ + 5}} + 3e \to {N^{ + 2}}|x2\)
PTHH: 3Cu + 8HNO 3 \( \to \)3Cu(NO 3 ) 2 + 2NO + 4H 2 O
=> Tỉ lệ số mol giữa chất khử và chất oxi hóa là: n Cu : n HNO3 = 3: 8
Đáp án C
Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
-
A.
6HNO 3 + Fe 2 O 3 \( \to \) 2Fe(NO 3 ) 3 + 3H 2 O
-
B.
2Al + 6HCl \( \to \) 2AlCl 3 + 3H 2
-
C.
2H 2 S + SO 2 \( \to \) 3S + 2H 2 O
-
D.
3Cu + 8HNO 3 \( \to \) 3Cu(NO 3 ) 2 + 2NO + 4H 2 O
Đáp án : A
Phản ứng oxi hóa - khử là phản ứng hóa học có sự thay đổi số oxi hóa của các nguyên tố.
Phản ứng 6HNO 3 + Fe 2 O 3 → 2Fe(NO 3 ) 3 + 3H 2 O không phải là phản ứng oxi hóa - khử do không có sự thay đổi số oxi hóa của các nguyên tố.
Đáp án A
Hòa tan 9,6 gam magnesium trong dung dịch HNO 3 thu được dung dịch muối và 2,479 lít (đkc) khí X (sản phẩm khử duy nhất). Khí X là
-
A.
NO 2
-
B.
N 2 O
-
C.
N 2
-
D.
NO
Đáp án : B
Giả sử 1 mol khí trao đổi n mol electron. Áp dụng bảo toàn e:
2n Mg = n. nkhí ⟹ giá trị của n
+ Nếu n = 1 ⟹ NO 2 .
+ Nếu n = 3 ⟹ NO.
+ Nếu n = 8 ⟹ N 2 O.
+ Nếu n = 10 ⟹ N 2 .
n Mg = 9,6/24 = 0,4 mol và nkhí = 0,1 mol
Áp dụng bảo toàn e: 2nMg = n.nkhí ⇔ 2.0,4 = n.0,1 ⇔ n = 8
⟹ Khí X là N 2 O.
Đáp án B
Cho 8,6765 lít (đkc) hỗn hợp khí O 2 và Cl 2 tác dụng vừa đủ với hỗn hợp chứa 0,2 mol Mg và 0,2 mol Al thu được m gam hỗn hợp muối chloride và oxide. Giá trị của m là
-
A.
21,7
-
B.
35,35
-
C.
27,55
-
D.
29,20
Đáp án : D
- Đặt n Cl2 = x mol; n O2 = y mol.
- Lập hệ phương trình:
+) Tổng số mol hỗn hợp khí
+) Bảo toàn electron
Giải tìm được x, y.
- Áp dụng BTKL → m = mKL + mkhí
Đặt n Cl2 = x mol; n O2 = y mmol
n X = 0,35 mol => x + y = 0,35 (1)
Các quá trình nhường – nhận e:
Mg \( \to \) Mg +2 + 2e Cl 2 + 2e \( \to \) 2Cl -1
Al \( \to \) Al +3 + 3e O 2 + 4e \( \to \)2O -2
Bảo toàn electron => 2 n Mg + 3 n Al = 2n Cl2 + 4n O2
=> 2x + 4y = 2.0,2 + 3.0,2 = 1 (2)
Từ (1) và (2) => x = 0,2; y = 0,15
=> m = m KL + m khí = (0,2.24 + 0,2.27) + (0,2.71 + 0,15.32) = 29,2
Đáp án D
Phản ứng nào sau đây là phản ứng tỏa nhiệt?
-
A.
phản ứng nhiệt phân muối KNO 3
-
B.
phản ứng phân hủy khí NH 3
-
C.
phản ứng oxi hóa glucose trong cơ thể
-
D.
phản ứng hòa tan NH 4 Cl trong nước
Đáp án : B
Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt ra môi trường. Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt từ môi trường.
Oxi hóa glucose thành CO 2 và H 2 O tương tự phản ứng đốt cháy glucose
⟹ Phản ứng là phản ứng tỏa nhiệt là phản ứng oxi hóa glucose trong cơ thể.
Phương trình nhiệt hóa học: 3H 2 (g) + N 2 (g) \( \to \) 2NH 3 (g) \({\Delta _r}H_{298}^o = - 91,80kJ\)
Lượng nhiệt tỏa ra khi dùng 9 gam H 2 (g) để tạo thành NH 3 (g) là
-
A.
-275,40 kJ
-
B.
-137,80 kJ
-
C.
-45,90 kJ
-
D.
-183,60 kJ
Đáp án : B
Dựa vào lý thuyết về enthalpy.
n H2 = 9:2 = 4,5 (mol)
3 mol H 2 ⟶ 2NH 3 ⟶ ∆ r H 0 298 = -91,80 kJ ⟹ 4,5 mol H 2
⟶ Lượng nhiệt tỏa ra là: 4,5.(-91,80):3 = -137,70 kJ
Phát biểu nào sau đây đúng?
-
A.
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol L -1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K.
-
B.
Điều kiện chuẩn là điều kiện ứng với nhiệt độ 298 K.
-
C.
Áp suất 760 mmHg là áp suất ở điều kiện chuẩn.
-
D.
Điều kiện chuẩn là điều kiện ứng với áp suất 1 atm, nhiệt độ 0 0 C.
Đáp án : A
Dựa vào quy ước về điều kiện chuẩn.
A đúng. B, C, D sai.
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
-
A.
2C (than chì) + O 2 (g) \( \to \) 2CO(g)
-
B.
C (than chì) + O(g) \( \to \) CO(g)
-
C.
C (than chì) + ½ O 2 (g) \( \to \) CO(g)
-
D.
C (than chì) + CO 2 (g) \( \to \) 2CO(g)
Đáp án : C
Dựa vào lý thuyết về enthalpy.
Phương trình hóa học biểu thị enthalpy tạo thành chuẩn của CO (g) là:
C (than chì) + ½ O 2 (g) ⟶ CO (g)
-
A.
Phản ứng tỏa nhiệt
-
B.
Phản ứng thu nhiệt
-
C.
Vừa thu, vừa tỏa nhiệt
-
D.
Không thuộc loại nào
Đáp án : B
Dựa vào lý thuyết về năng lượng hóa học
Vì \({\Delta _r}H_{298}^o = 9,0kJ\)> 0 => phản ứng thu nhiệt
Đáp án B
Cho các phản ứng dưới đây:
(1) CO(g) + ½ O 2 (g) \( \to \) CO 2 (g) \({\Delta _r}H_{298}^o = - 283kJ\)
(2) C(s) + H 2 O(g) \( \to \)CO(g) + H 2 (g) \({\Delta _r}H_{298}^o = 131,25kJ\)
(3) H 2 (g) + F 2 (g) \( \to \) 2HF(g) \({\Delta _r}H_{298}^o = - 546kJ\)
(4) H 2 (g) + Cl 2 (g) \( \to \) 2HCl(g) \({\Delta _r}H_{298}^o = - 184,62kJ\)
Phản ứng xảy ra thuận lợi nhất là
-
A.
phản ứng (1)
-
B.
phản ứng (2)
-
C.
phản ứng (3)
-
D.
phản ứng (4)
Đáp án : C
Dựa vào lý thuyết về năng lượng hoá học.
Phản ứng xảy ra thuận lợi nhất là phản ứng (3).
Đáp án C
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn
4FeS 2 (s) + 11O 2 (g) \( \to \) 2Fe 2 O 3 (s) + 8SO 2 (g)
Cho nhiệt tạo thành của các chất trong bảng sau:
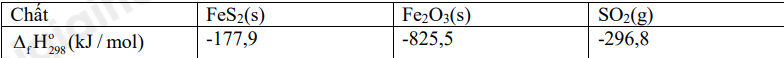
Cho các mệnh đều sau:
a) \({\Delta _f}H_{298}^o({O_2},g) = 0kJ\)
b) \({\Delta _f}H_{298}^o(sp) = - 4025,4kJ\)
c) \({\Delta _f}H_{298}^o(c{\rm{d}}) = - 711,6kJ\)
d) Đây là phản ứng tỏa nhiệt
Số mệnh đề đúng là
-
A.
3
-
B.
4
-
C.
2
-
D.
1
Đáp án : B
Dựa vào lý thuyết về năng lượng hóa học
a), b), c), d) đúng.
\(\begin{array}{l}{\Delta _r}H_{298}^o = 2.{\Delta _f}H_{298}^o(F{e_2}{O_3},s) + 8.{\Delta _f}H_{298}^o(S{O_2},g) - 11.{\Delta _f}H_{298}^o({O_2},g) - 4.{\Delta _f}H_{298}^o(Fe{S_2},s)\\ = 2.( - 825,5) + 8.( - 296,8) - 11.0 - 4.( - 1779) = - 3313,8kJ/mol < 0\end{array}\)
=> Phản ứng tỏa nhiệt
Đáp án B
Cho các đơn chất sau đây: C(graphite,s), Br 2 (g), Na(s), Na(g), Hg(l), Hg(s). Số đơn chất có \( {\Delta _f}H_{298}^o = 0kJ \) là
-
A.
5
-
B.
6
-
C.
4
-
D.
3
Đáp án : C
Đơn chất bền có \( {\Delta _f}H_{298}^o = 0kJ \)
Các đơn chất C(graphite,s) Br 2 (l), Na(s), Hg(l) bền đều có \( {\Delta _f}H_{298}^o = 0kJ \)
Đáp án C
Tiến hành quá trình ozone hóa 100gam oxygen theo phản ứng sau: 3O 2 (g) \( \to \)2O 3 (g)
Hỗn hợp thu được có chứa 24% ozone về khối lượng, tiêu tốn 71,2 kJ. Nhiệt tạo thành \( {\Delta _f}H_{298}^o \) của ozone (kJ/mol) có giá trị là
-
A.
142,4
-
B.
282,8
-
C.
-142,4
-
D.
-284,8
Đáp án : A
Dựa vào lý thuyết enthalpy
n O3 = 0,24.100:48 = 0,5 mol
0,5 mol O 3 tiêu tốn 71,2 kJ năng lượng
=> 2 mol O 3 tiêu tốn 71,2 : 0,5.2 = 284,8 KJ => \({\Delta _r}H_{298}^o\)=284,8 kJ
=> \({\Delta _r}H_{298}^o\)= 2. \({\Delta _f}H_{298}^o({O_3},g) - 3.\Delta fH_{298}^o({O_2},g) = 2.284,8 - 3,0 = 142,4kJ/mol\)
Đáp án A
Cho 2 phương trình nhiệt hóa học sau:
0,5H 2 (g) + 0,5I 2 (g) \( \to \) HI(g) (1) \({\Delta _r}H_{298}^o(1) = 25,9kJ\)
HI(g) \( \to \) 0,5H 2 + 0,5I 2 (2)
Biến thiên enthalpy của phản ứng (2) là
-
A.
-51,8 kJ
-
B.
51,8 kJ
-
C.
25,9 kJ
-
D.
-25,9 kJ
Đáp án : D
Dựa vào lý thuyết về biến thiên enthalpy của phản ứng hóa học
\(\begin{array}{l}{\Delta _r}H_{298}^o(1) = {\Delta _f}H_{298}^o(HI) - 0,5.{\Delta _r}H_{298}^o({H_2}) - 0,5.{\Delta _r}H_{298}^o({I_2}) = {\Delta _f}H_{298}^o(HI)\\{\Delta _r}H_{298}^o(2) = 0,5.{\Delta _f}H_{298}^o({H_2}) + 0,5.{\Delta _f}H_{298}^o({I_2}) - {\Delta _f}H_{298}^o(HI) = - {\Delta _f}H_{298}^o(HI)\\ \to {\Delta _r}H_{298}^o(2) = - {\Delta _r}H_{298}^o(1) = - 25,9kJ\end{array}\)
Đáp án D
Thành phần chính của đa số các loại đá dùng trong xây dựng là CaCO
3
, chúng vừa có tác dụng chịu nhiệt, vừa chịu được lực. Cho phản ứng sau:

Biết \({\Delta _f}H_{298}^o\)(CaCO 3 (s) = -1206,09 (kJ/mol); \({\Delta _f}H_{298}^o\)(CaO(s)) = -635,10 (kJ/mol); \({\Delta _f}H_{298}^o\)(CO 2 ,g) = -393,50 (kJ/mol). Giá trị \({\Delta _r}H_{298}^o\)của phản ứng tính theo kJ là
-
A.
178,3
-
B.
-178,3
-
C.
138,7
-
D.
-138,7
Đáp án : B
\({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(sp) - {\Delta _f}H_{298}^o(c{\rm{d}})\)
\({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(CaO) + {\Delta _f}H_{298}^o(C{O_2}) - {\Delta _f}H_{298}^o(CaC{O_3}) = - 635,1 + ( - 393,5) - ( - 1206,90) = 178,3kJ\)
