Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề số 4
Các hạt cấu tạo nên hầu hết các hạt nhân nguyên tử là
Đề bài
Các hạt cấu tạo nên hầu hết các hạt nhân nguyên tử là
-
A.
Electron và neutron
-
B.
Electron và proton
-
C.
Neutron và proton
-
D.
Electron, neutron và proton
Có các nhận định sau:
(1) Nguyên tố hóa học là tập hợp các nguyên tử có cùng số neutron.
(2) Đồng vị của nguyên tố là những nguyên tử có cùng số proton nhưng khác số neutron.
(3) Tất cả những nguyên tử có 1, 2 hoặc 3 electron lớp ngoài cùng đều là nguyên tố kim loại.
(4) Lớp M có tối đa 18 electron.
Số nhận định sai là:
-
A.
4.
-
B.
1.
-
C.
2.
-
D.
3.
Chất nào sau đây có liên kết cộng hóa trị không phân cực?
-
A.
H 2 S.
-
B.
P 2 O 5 .
-
C.
O 3 .
-
D.
NaF.
Số chu kì nhỏ trong tuần hoàn các nguyên tố hóa học là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Cặp nguyên tố nào sau đây không có khả năng tạo thành liên kết cộng hóa trị trong hợp chất của chúng?
-
A.
Oxygen và chlorine.
-
B.
Sodium và fluorine.
-
C.
Carbon và hydrogen.
-
D.
Nitrogen và hydrogen.
Nhóm nào sau đây còn có tên là nhóm kim loại kiềm ?
-
A.
VIIA.
-
B.
IIA.
-
C.
VIIIA.
-
D.
IA.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân thì
-
A.
bán kính nguyên tử giảm dần, tính kim loại tăng dần.
-
B.
bán kính nguyên tử giảm dần, tính phi kim tăng dần.
-
C.
bán kính nguyên tử tăng dần, tính phi kim tăng dần.
-
D.
bán kính nguyên tử tăng dần, tính kim loại giảm dần.
Nitrogen trong thiên nhiên là hỗn hợp gồm hai đồng vị là \({}_7^{14}{\rm{N}}\) (99,63%) và \({}_7^{15}{\rm{N}}\) (0,37%). Nguyên tử khối trung bình của nitrogen là
-
A.
14,7.
-
B.
14,0.
-
C.
14,4.
-
D.
13,7.
Liên kết nào sau đây thường được tạo thành giữa 1 nguyên tử kim loại điển hình và 1 phi kim điển hình:
-
A.
Liên kết cộng hóa trị phân cực.
-
B.
Liên kết ion.
-
C.
Liên kết cộng hóa trị không phân cực.
-
D.
Liên kết cho – nhận.
Chất nào sau đây có thể tạo liên kết hydrogen?
-
A.
PH 3 .
-
B.
C 6 H 6 .
-
C.
HF.
-
D.
H 2 S.
Sự biểu diễn về orbital (AO) 3p 4 nào sau đây là đúng ?
-
A.

-
B.
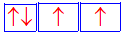
-
C.
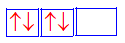
-
D.

Hợp hất nào sau đây có không chứa liên kết ion trong phân tử ?
-
A.
NaBr.
-
B.
PH 3 .
-
C.
KF.
-
D.
Al 2 O 3 .
Trong một liên kết đôi có chứa :
-
A.
1 liên kết \(\sigma \) và 1 liên kết π.
-
B.
2 liên kết π.
-
C.
2 liên kết \(\sigma \) .
-
D.
Tất cả đều sai.
Tương tác van der Waals được hình thành do
-
A.
tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử.
-
B.
tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các phân tử.
-
C.
tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
-
D.
lực hút tĩnh điện giữa các phân tử phân cực.
Phát biểu nào sau đây đúng ?
-
A.
Chu kỳ mở đầu là một kim loại điển hình và kết thúc là một phi kim điển hình.
-
B.
Số khối A là khối lượng tuyệt đối của nguyên tử.
-
C.
Để thỏa mãn quy tắc octet, nguyên tử của nguyên tố F (Z = 9) phải nhận thêm 2 electron.
-
D.
Electron thuộc lớp K (n =1) liên kết chặt chẽ nhất với hạt nhân.
Nguyên tử của nguyên tố A có tổng số hạt là 40. Trong đó, số hạt không mang điện nhiều hơn số hạt mang điện dương là 1 hạt. Số hạt không mang điện trong A là :
-
A.
1
-
B.
14
-
C.
13
-
D.
27
Cấu hình electron nào sau đây là của nguyên tử kim loại ?
-
A.
1s 2 2s 2 2p 6 3s 2 3p 4
-
B.
1s 2 2s 2 2p 6 3s 2 3p 5
-
C.
1s 2 2s 2 2p 6 3s 1
-
D.
1s 2 2s 2 2p 6
Nguyên tố R có cấu hình electron: 1s 2 2s 2 2p 3 . Công thức hợp chất oxide ứng với hóa trị cao nhất của R và hydride (hợp chất của R với hydrogen) tương ứng là. Lưu ý: Hóa trị của nguyên tố R trong hợp chất khí với hydrogen = 8 – số nhóm (nhóm IVA → VIIA)
-
A.
R 2 O 5 , RH 5 .
-
B.
R 2 O 3 , RH.
-
C.
R 2 O 7 , RH.
-
D.
R 2 O 5 , RH 3 .
Nguyên tố X có cấu hình electron là 1s 2 2s 2 2p 3 . Vậy vị trí X trong bảng tuần hoàn và công thức hợp chất khí với hydrogen của X là:
-
A.
Chu kì 2, nhóm VA, HXO 3 .
-
B.
Chu kì 2, nhóm VA, XH 4 .
-
C.
Chu kì 2, nhóm VA, XH 3 .
-
D.
Chu kì 2, nhóm VA, XH 2 .
Xét 3 nguyên tố có cấu hình electron lần lượt: X: 1s 2 2s 2 2p 6 3s 1 ; Q: 1s 2 2s 2 2p 6 3s 2 ; Z: 1s 2 2s 2 2p 6 3s 2 3p 1 . Tính base tăng dần của các hydroxide là
-
A.
XOH < Q(OH) 2 < Z(OH) 3
-
B.
Z(OH) 3 < XOH< Q(OH) 2
-
C.
Z(OH) 3 < Q(OH) 2 < XOH
-
D.
XOH < Z(OH) 3 < Q(OH) 2
Liên kết trong phân tử nào dưới đây không được hình thành do sự xen phủ giữa các obital cùng loại (ví dụ cùng là obital s, hoặc cùng là obital p)?
-
A.
Cl 2
-
B.
H 2
-
C.
NH 3
-
D.
Br 2
Cho 9,6 gam một kim loại M hóa trị II tác dụng hết với nước thu được 5,94936 lít khí H 2 (ở 25 o C, 1 bar). Kim loại M cần tìm là:
-
A.
Mg.
-
B.
Zn.
-
C.
Ca.
-
D.
Ba.
Dãy nguyên tố nào sau đây được xếp theo chiều tăng dần tính phi kim?
-
A.
N, P, As, Bi.
-
B.
F, Cl, Br, I.
-
C.
C, Si, Ge, Sn.
-
D.
Te, Se, S, O.
Trong các phân tử NCl 3 , H 2 S, KOH, CaF 2 , Al 2 O 3 , HNO 3 , NaCl, PCl 5 , NH 4 NO 3 , số chất có liên kết ion là
-
A.
3
-
B.
4
-
C.
5
-
D.
6
Cho Cấu hình electron của ion X 2+ là 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 . Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X thuộc
-
A.
chu kì 4, nhóm VIIIB.
-
B.
chu kì 4, nhóm VIIIA.
-
C.
chu kì 3, nhóm VIB.
-
D.
chu kì 4, nhóm IIA.
Lời giải và đáp án
Các hạt cấu tạo nên hầu hết các hạt nhân nguyên tử là
-
A.
Electron và neutron
-
B.
Electron và proton
-
C.
Neutron và proton
-
D.
Electron, neutron và proton
Đáp án : C
Dựa vào cấu tạo của nguyên tử
Hạt nhân nguyên tử được cấu tạo từ neutron và proton
Đáp án C
Có các nhận định sau:
(1) Nguyên tố hóa học là tập hợp các nguyên tử có cùng số neutron.
(2) Đồng vị của nguyên tố là những nguyên tử có cùng số proton nhưng khác số neutron.
(3) Tất cả những nguyên tử có 1, 2 hoặc 3 electron lớp ngoài cùng đều là nguyên tố kim loại.
(4) Lớp M có tối đa 18 electron.
Số nhận định sai là:
-
A.
4.
-
B.
1.
-
C.
2.
-
D.
3.
Đáp án : C
Dựa vào cấu tạo của nguyên tử
(1) sai vì nguyên tố hóa học là tập hợp các nguyên tử có cùng số proton
(2) đúng
(3) sai vì Hydrogen có 1 electron lớp ngoài cùng nhưng không phải kim loại
(4) đúng
Đáp án C
Chất nào sau đây có liên kết cộng hóa trị không phân cực?
-
A.
H 2 S.
-
B.
P 2 O 5 .
-
C.
O 3 .
-
D.
NaF.
Đáp án : C
Dựa vào hiệu độ âm điện
Đáp án C
Số chu kì nhỏ trong tuần hoàn các nguyên tố hóa học là
-
A.
1
-
B.
2
-
C.
3
-
D.
4
Đáp án : C
Số chu kì nhỏ là 3
Đáp án C
Cặp nguyên tố nào sau đây không có khả năng tạo thành liên kết cộng hóa trị trong hợp chất của chúng?
-
A.
Oxygen và chlorine.
-
B.
Sodium và fluorine.
-
C.
Carbon và hydrogen.
-
D.
Nitrogen và hydrogen.
Đáp án : B
Liên kết cộng hóa trị thường được hình thành từ nguyên tử phim kim – phi kim
Sodium và fluorine có khả năng tạo liên kết ion
Đáp án B
Nhóm nào sau đây còn có tên là nhóm kim loại kiềm ?
-
A.
VIIA.
-
B.
IIA.
-
C.
VIIIA.
-
D.
IA.
Đáp án : D
Kim loại kiềm có 1 electron lớp ngoài cùng
Đáp án D
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân thì
-
A.
bán kính nguyên tử giảm dần, tính kim loại tăng dần.
-
B.
bán kính nguyên tử giảm dần, tính phi kim tăng dần.
-
C.
bán kính nguyên tử tăng dần, tính phi kim tăng dần.
-
D.
bán kính nguyên tử tăng dần, tính kim loại giảm dần.
Đáp án : B
Dựa vào xu hướng biến đổi của nguyên tố trong cùng một chu kì
Trong cùng một chu kì, bán kính nguyên tử giảm dần, tính phi kim tăng dần
Đáp án B
Nitrogen trong thiên nhiên là hỗn hợp gồm hai đồng vị là \({}_7^{14}{\rm{N}}\) (99,63%) và \({}_7^{15}{\rm{N}}\) (0,37%). Nguyên tử khối trung bình của nitrogen là
-
A.
14,7.
-
B.
14,0.
-
C.
14,4.
-
D.
13,7.
Đáp án : B
Dựa vào % đồng vị của N
\(M = \frac{{99,63.14 + 15.0,37}}{{100}} = 14,0037\)
Đáp án B
Liên kết nào sau đây thường được tạo thành giữa 1 nguyên tử kim loại điển hình và 1 phi kim điển hình:
-
A.
Liên kết cộng hóa trị phân cực.
-
B.
Liên kết ion.
-
C.
Liên kết cộng hóa trị không phân cực.
-
D.
Liên kết cho – nhận.
Đáp án : B
Liên kết ion được hình thành từ kim loại và phi kim điển hình
Đáp án B
Chất nào sau đây có thể tạo liên kết hydrogen?
-
A.
PH 3 .
-
B.
C 6 H 6 .
-
C.
HF.
-
D.
H 2 S.
Đáp án : C
Liên kết hydrogen hình thành giữa nguyên tố có độ âm điện cao với hydrogen
Đáp án C
Sự biểu diễn về orbital (AO) 3p 4 nào sau đây là đúng ?
-
A.

-
B.

-
C.

-
D.

Đáp án : B
Dựa vào nguyên tắc điền electron vào các AO
Các electron được điền sao cho không có AO trống. Mỗi AO chứa tối đa 2 electron được biểu diễn bằng 2 mũi tên ngược chiều nhau
Đáp án B
Hợp hất nào sau đây có không chứa liên kết ion trong phân tử ?
-
A.
NaBr.
-
B.
PH 3 .
-
C.
KF.
-
D.
Al 2 O 3 .
Đáp án : B
Liên kết ion được hình thành giữa nguyên tử kim loại và phi kim điển hình
Đáp án B
Trong một liên kết đôi có chứa :
-
A.
1 liên kết \(\sigma \) và 1 liên kết π.
-
B.
2 liên kết π.
-
C.
2 liên kết \(\sigma \) .
-
D.
Tất cả đều sai.
Đáp án : A
Trong một liên kết đôi có chứa 1 liên kết \(\sigma \)và 1 liên kết pi
Đáp án A
Tương tác van der Waals được hình thành do
-
A.
tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử.
-
B.
tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các phân tử.
-
C.
tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
-
D.
lực hút tĩnh điện giữa các phân tử phân cực.
Đáp án : C
Dựa vào kiến thức về tương tác van der Waals
Đáp án C
Phát biểu nào sau đây đúng ?
-
A.
Chu kỳ mở đầu là một kim loại điển hình và kết thúc là một phi kim điển hình.
-
B.
Số khối A là khối lượng tuyệt đối của nguyên tử.
-
C.
Để thỏa mãn quy tắc octet, nguyên tử của nguyên tố F (Z = 9) phải nhận thêm 2 electron.
-
D.
Electron thuộc lớp K (n =1) liên kết chặt chẽ nhất với hạt nhân.
Đáp án : D
A. sai vì kết thúc là nguyên tử khí hiếm
B. Sai vì số khối A là khối lượng được làm tròn của nguyên tử
C. sai vì F nhận thêm 1 electron để đạt cấu hình bền
D. đúng
Nguyên tử của nguyên tố A có tổng số hạt là 40. Trong đó, số hạt không mang điện nhiều hơn số hạt mang điện dương là 1 hạt. Số hạt không mang điện trong A là :
-
A.
1
-
B.
14
-
C.
13
-
D.
27
Đáp án : B
(1) P + N + E = 40
(2) N – P = 1
Từ đó tính được N = 14, P = E = 13
Đáp án B
Cấu hình electron nào sau đây là của nguyên tử kim loại ?
-
A.
1s 2 2s 2 2p 6 3s 2 3p 4
-
B.
1s 2 2s 2 2p 6 3s 2 3p 5
-
C.
1s 2 2s 2 2p 6 3s 1
-
D.
1s 2 2s 2 2p 6
Đáp án : C
Nguyên tử kim loại có 1, 2, 3 electron lớp ngoài cùng
Đáp án C
Nguyên tố R có cấu hình electron: 1s 2 2s 2 2p 3 . Công thức hợp chất oxide ứng với hóa trị cao nhất của R và hydride (hợp chất của R với hydrogen) tương ứng là. Lưu ý: Hóa trị của nguyên tố R trong hợp chất khí với hydrogen = 8 – số nhóm (nhóm IVA → VIIA)
-
A.
R 2 O 5 , RH 5 .
-
B.
R 2 O 3 , RH.
-
C.
R 2 O 7 , RH.
-
D.
R 2 O 5 , RH 3 .
Đáp án : D
Hóa trị của nguyên tố R với oxygen bằng số electron lớp ngoài cùng
R có 5 electron lớp ngoài cùng => công thức oxide là R 2 O 5
Công thức với hydrogen là RH 3
Đáp án D
Nguyên tố X có cấu hình electron là 1s 2 2s 2 2p 3 . Vậy vị trí X trong bảng tuần hoàn và công thức hợp chất khí với hydrogen của X là:
-
A.
Chu kì 2, nhóm VA, HXO 3 .
-
B.
Chu kì 2, nhóm VA, XH 4 .
-
C.
Chu kì 2, nhóm VA, XH 3 .
-
D.
Chu kì 2, nhóm VA, XH 2 .
Đáp án : C
Dựa vào cấu hình của electron
Nguyên tố X có 2 lớp electron => chu kì 2
Nguyên tố X có 5 electron lớp ngoài cùng => nhóm VA
Xét 3 nguyên tố có cấu hình electron lần lượt: X: 1s 2 2s 2 2p 6 3s 1 ; Q: 1s 2 2s 2 2p 6 3s 2 ; Z: 1s 2 2s 2 2p 6 3s 2 3p 1 . Tính base tăng dần của các hydroxide là
-
A.
XOH < Q(OH) 2 < Z(OH) 3
-
B.
Z(OH) 3 < XOH< Q(OH) 2
-
C.
Z(OH) 3 < Q(OH) 2 < XOH
-
D.
XOH < Z(OH) 3 < Q(OH) 2
Đáp án : C
Dựa vào cấu hình electron của 3 nguyên tố và xu hướng biến đổi của hợp chất hydroxide trong cùng một chu kì
X, Q, Z thuộc cùng một chu kì, nên tính base của hydroxide giảm dần từ X > Q > Z
Đáp án C
Liên kết trong phân tử nào dưới đây không được hình thành do sự xen phủ giữa các obital cùng loại (ví dụ cùng là obital s, hoặc cùng là obital p)?
-
A.
Cl 2
-
B.
H 2
-
C.
NH 3
-
D.
Br 2
Đáp án : C
Đáp án C do H không có obital p
Cho 9,6 gam một kim loại M hóa trị II tác dụng hết với nước thu được 5,94936 lít khí H 2 (ở 25 o C, 1 bar). Kim loại M cần tìm là:
-
A.
Mg.
-
B.
Zn.
-
C.
Ca.
-
D.
Ba.
Đáp án : C
Dựa vào số mol của H 2 từ đó tính M của kim loại M
n H2 = 5,94936 : 24,79 = 0,24 mol
M + 2H 2 O --> M(OH) 2 + H 2
0,24 0,24
M M = 9,6 : 0,24 = 40 (Ca)
Đáp án C
Dãy nguyên tố nào sau đây được xếp theo chiều tăng dần tính phi kim?
-
A.
N, P, As, Bi.
-
B.
F, Cl, Br, I.
-
C.
C, Si, Ge, Sn.
-
D.
Te, Se, S, O.
Đáp án : D
Trong cùng một nhóm, đi từ trên xuống tính phi kim giảm dần
Đáp án D
Trong các phân tử NCl 3 , H 2 S, KOH, CaF 2 , Al 2 O 3 , HNO 3 , NaCl, PCl 5 , NH 4 NO 3 , số chất có liên kết ion là
-
A.
3
-
B.
4
-
C.
5
-
D.
6
Đáp án : C
Liên kết ion hình thành từ kim loại và phi kim điển hình
KOH, CaF 2 , Al 2 O 3 , NaCl, NH 4 NO 3
Cho Cấu hình electron của ion X 2+ là 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 . Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X thuộc
-
A.
chu kì 4, nhóm VIIIB.
-
B.
chu kì 4, nhóm VIIIA.
-
C.
chu kì 3, nhóm VIB.
-
D.
chu kì 4, nhóm IIA.
Đáp án : A
X 2+ đã nhường đi 2 electron lớp ngoài cùng để đạt cấu hình khí hiếm
Cấu hình của X là
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 => Chu kì 4 nhóm VIIIB