Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề số 2
Điện tích của hạt nhân do loại hạt nào quyết định?
Đề bài
Điện tích của hạt nhân do loại hạt nào quyết định?
-
A.
Hạt proton.
-
B.
Hạt electron.
-
C.
Hạt neutron.
-
D.
Hạt proton và electron.
Giá trị điện tích – 1 và khối lượng 0,0059 amu là của hạt nào dưới đây trong nguyên tử?
-
A.
Electron.
-
B.
Neutron.
-
C.
Proton.
-
D.
Ion.
Nguyên tử phosphorus có Z = 15, A = 31 nên nguyên tử có
-
A.
15 proton, 16 electron, 31 neutron.
-
B.
15 electron, 31 neutron, 15 proton.
-
C.
15 proton, 15 electron, 16 neutron.
-
D.
khối lượng nguyên tử là 46 amu.
Số đơn vị điện tích hạt nhân của nguyên tử có kí hiệu \(_{11}^{23}Na\) là
-
A.
23.
-
B.
24.
-
C.
25.
-
D.
11.
Trong những hợp chất sau đây, cặp chất nào là đồng vị của nhau:
-
A.
\({}_{{\rm{19}}}^{{\rm{40}}}{\rm{K}}\) và \({}_{{\rm{18}}}^{{\rm{40}}}{\rm{Ar}}{\rm{.}}\)
-
B.
\({}_{{\rm{19}}}^{{\rm{40}}}{\rm{K}}\) và \({}_{20}^{{\rm{40}}}{\rm{Ca}}{\rm{.}}\)
-
C.
\({{\rm{O}}_{\rm{2}}}\)và \({{\rm{O}}_{\rm{3}}}\).
-
D.
\({}_{\rm{8}}^{{\rm{16}}}{\rm{O}}\) và \({}_{\rm{8}}^{{\rm{17}}}{\rm{O}}\).
Biết rằng nguyên tố argon có ba đồng vị khác nhau, ứng với số khối 36; 38 và A. Phần trăm các đồng vị tương ứng lần lượt bằng: 0,34% ; 0,06% và 99,6%. Số khối của đồng vị A của nguyên tố argon là bao nhiêu? (cho biết nguyên tử khối trung bình của argon bằng 39,98).
-
A.
39.
-
B.
40.
-
C.
41.
-
D.
42.
Các nguyên tố được sắp xếp trong bảng tuần hoàn không tuân theo nguyên tắc nào sau đây?
-
A.
Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
-
B.
Các nguyên tố có cùng số electron hoá trị được xếp vào một cột.
-
C.
Các nguyên tố có cùng số lớp electron được xếp vào một hàng.
-
D.
Các nguyên tố được sắp xếp theo chiều tăng dần khối lượng nguyên tử.
Số thứ tự ô nguyên tố không cho biết:
-
A.
số proton trong hạt nhân.
-
B.
số neutron trong hạt nhân.
-
C.
số hiệu nguyên tử.
-
D.
số electron ở lớp vỏ.
Cho dãy các nguyên tố nhóm IA: Li-Na- K- Rb- Cs. Từ Li đến Cs, theo chiều tăng điện tích hạt nhân, tính kim loại thay đổi theo chiều nào?
-
A.
Giảm dần.
-
B.
Giảm rồi tăng.
-
C.
Tăng dần.
-
D.
Tăng rồi giảm.
Nguyên tố X có cấu hình electron: 1s 2 2s 2 2p 6 3s 2 3p 4 .vị trí X trong bảng tuần hoàn:
-
A.
Chu kỳ 4, nhóm IVA.
-
B.
Chu kỳ 3,nhóm IVA.
-
C.
Chu kỳ 3, nhóm VIA.
-
D.
Chu kỳ 6, nhóm VIA.
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là:
-
A.
1s 2 2s 2 2p 6 3s 2 .
-
B.
1s 2 2s 2 2p 6 3s 1 .
-
C.
1s 2 2s 2 2p 5 3s 2 .
-
D.
1s 2 2s 2 2p 4 3s 1 .
Thời Trung Hoa cổ đại loài người đã biết các nguyên tố vàng, bạc, đồng, chì, sắt, thủy ngân và lưu huỳnh. Năm 1649 loài người đã tìm ra nguyên tố photpho. Đến năm 1869, mới có 63 nguyên tố được tìm ra. Vây nguyên tố ở ô thứ 35 là nguyên tố nào sau đây?
-
A.
Rb.
-
B.
Sr.
-
C.
Kr.
-
D.
Br.
Theo quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có
-
A.
8 electron tương ứng với khí hiếm gần nhất.
-
B.
2 electron tương ứng với kim loại gần nhất.
-
C.
8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
-
D.
6 electron tương ứng với phi kim gần nhất.
Ion lithium có cấu hình electron của khí hiếm tương ứng nào
-
A.
He.
-
B.
Ne
-
C.
Ar.
-
D.
Kr.
Cho các phân tử: H 2 , CO 2 , HCl, Cl 2 . Có bao nhiêu phân tử có cực?
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Các chất mà phân tử không phân cực là:
-
A.
HBr, CO 2 , CH 4 .
-
B.
Cl 2 , CO 2 , C 2 H 2 .
-
C.
HCl, C 2 H 2 , Br 2 .
-
D.
NH 3 ,Br 2 , C 2 H 4 .
Những liên kết có lực liên kết yếu như
-
A.
liên kết hydrogen và tương tác Van der Waals.
-
B.
liên kết ion và liên kết cộng hóa trị.
-
C.
liên kết ion và liên kết hydrogen.
-
D.
liên kết hydrogen và liên kết cộng hóa trị.
Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi electron khi hình thành liên kết hóa học như hình dưới đây?
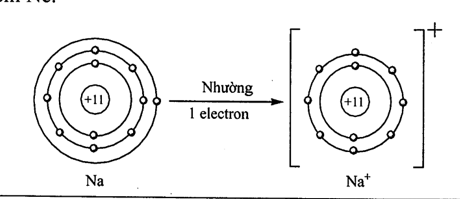
-
A.
helium.
-
B.
magnesium.
-
C.
aluminium.
-
D.
sodium.
Số oxi hoá của nguyên tố lưu huỳnh trong các chất: S, H 2 S, H 2 SO 4 , SO 2 lần lượt là:
-
A.
0, +2, +6, +4.
-
B.
0, –2, +4, –4.
-
C.
0, –2, –6, +4.
-
D.
0, –2, +6, +4.
Liên kết hoá học giữa các nguyên tử trong phân tử H 2 O là liên kết
-
A.
cộng hóa trị không phân cực.
-
B.
hydrogen.
-
C.
cộng hoá trị phân cực.
-
D.
ion.
Mô tả sự hình thành ion của nguyên tử O (Z = 8) theo quy tắc octet là
-
A.
O + 2e ⟶ O 2− .
-
B.
O ⟶ O 2+ + 2e.
-
C.
O + 6e ⟶ O 6− .
-
D.
O + 2e ⟶ O 2+ .
Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung là
-
A.
liên kết ion.
-
B.
liên kết cộng hoá trị.
-
C.
liên kết kim loại.
-
D.
liên kết hydrogen.
Chỉ ra nội dung không đúng khi hoàn thành câu sau: “Trong tất cả các hợp chất,..”
-
A.
kim loại kiềm luôn có số oxi hoá +1.
-
B.
halogen luôn có số oxi hoá –1.
-
C.
hydrogen hầu hết có số oxi hoá +1, trừ một số trường hợp như hiđrua kim loại (NaH, CaH 2 ..).
-
D.
kim loại kiềm thổ luôn có số oxi hoá +2.
Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung
-
A.
ở giữa hai nguyên tử.
-
B.
lệch về một phía của một nguyên tử.
-
C.
chuyển hẳn về một nguyên tử.
-
D.
nhường hẳn về một nguyên tử.
Tương tác Van Der Waals tồn tại giữa những
-
A.
ion.
-
B.
hạt proton.
-
C.
hạt neutron.
-
D.
phân tử
Lời giải và đáp án
Điện tích của hạt nhân do loại hạt nào quyết định?
-
A.
Hạt proton.
-
B.
Hạt electron.
-
C.
Hạt neutron.
-
D.
Hạt proton và electron.
Đáp án : A
Dựa vào kiến thức về thành phần nguyên tử
Điện tích của hạt nhân do hạt proton quyết định do neutron không mang điện
Đáp án A
Giá trị điện tích – 1 và khối lượng 0,0059 amu là của hạt nào dưới đây trong nguyên tử?
-
A.
Electron.
-
B.
Neutron.
-
C.
Proton.
-
D.
Ion.
Đáp án : A
Dựa vào kiến thức về thành phần cấu tạo nguyên tử
Điện tích – 1 là điện tích của electron
Đáp án A
Nguyên tử phosphorus có Z = 15, A = 31 nên nguyên tử có
-
A.
15 proton, 16 electron, 31 neutron.
-
B.
15 electron, 31 neutron, 15 proton.
-
C.
15 proton, 15 electron, 16 neutron.
-
D.
khối lượng nguyên tử là 46 amu.
Đáp án : C
Dựa vào số hiệu nguyên tử phosphorus để xác định vị trí của nguyên tố
Z = 15 => P = E = 15
Số khối A = 31 => E = 31 – 15 = 16
Đáp án C
Số đơn vị điện tích hạt nhân của nguyên tử có kí hiệu \(_{11}^{23}Na\) là
-
A.
23.
-
B.
24.
-
C.
25.
-
D.
11.
Đáp án : D
Dựa vào kí hiệu của nguyên tố Na
Số đơn vị điện tích hạt nhân = số pronton = số electron = 11
Đáp án D
Trong những hợp chất sau đây, cặp chất nào là đồng vị của nhau:
-
A.
\({}_{{\rm{19}}}^{{\rm{40}}}{\rm{K}}\) và \({}_{{\rm{18}}}^{{\rm{40}}}{\rm{Ar}}{\rm{.}}\)
-
B.
\({}_{{\rm{19}}}^{{\rm{40}}}{\rm{K}}\) và \({}_{20}^{{\rm{40}}}{\rm{Ca}}{\rm{.}}\)
-
C.
\({{\rm{O}}_{\rm{2}}}\)và \({{\rm{O}}_{\rm{3}}}\).
-
D.
\({}_{\rm{8}}^{{\rm{16}}}{\rm{O}}\) và \({}_{\rm{8}}^{{\rm{17}}}{\rm{O}}\).
Đáp án : D
Đồng vị là những nguyên tố có cùng số proton khác nhau số neutron
Đáp án D
Biết rằng nguyên tố argon có ba đồng vị khác nhau, ứng với số khối 36; 38 và A. Phần trăm các đồng vị tương ứng lần lượt bằng: 0,34% ; 0,06% và 99,6%. Số khối của đồng vị A của nguyên tố argon là bao nhiêu? (cho biết nguyên tử khối trung bình của argon bằng 39,98).
-
A.
39.
-
B.
40.
-
C.
41.
-
D.
42.
Đáp án : B
Dựa vào % các đồng vị để xác định số khối của nguyên tố
\(\begin{array}{l}{{\bar M}_{Ar}} = \frac{{36.0,34\% + 38.0,06\% + A.99,6\% }}{{100\% }} = 39,98\\ \to A \approx 40\end{array}\)
Đáp án B
Các nguyên tố được sắp xếp trong bảng tuần hoàn không tuân theo nguyên tắc nào sau đây?
-
A.
Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
-
B.
Các nguyên tố có cùng số electron hoá trị được xếp vào một cột.
-
C.
Các nguyên tố có cùng số lớp electron được xếp vào một hàng.
-
D.
Các nguyên tố được sắp xếp theo chiều tăng dần khối lượng nguyên tử.
Đáp án : D
Dựa vào nguyên tắc sắp xếp nguyên tố trong bảng tuần hoàn
Các nguyên tố không được sắp xếp theo chiều tăng dần khối lượng nguyên tử
Đáp án D
Số thứ tự ô nguyên tố không cho biết:
-
A.
số proton trong hạt nhân.
-
B.
số neutron trong hạt nhân.
-
C.
số hiệu nguyên tử.
-
D.
số electron ở lớp vỏ.
Đáp án : B
Dựa vào thông tin số thứ tự ô nguyên tố
Số thứ tự ô nguyên tố không cho biết số neutron trong hạt nhân
Đáp án B
Cho dãy các nguyên tố nhóm IA: Li-Na- K- Rb- Cs. Từ Li đến Cs, theo chiều tăng điện tích hạt nhân, tính kim loại thay đổi theo chiều nào?
-
A.
Giảm dần.
-
B.
Giảm rồi tăng.
-
C.
Tăng dần.
-
D.
Tăng rồi giảm.
Đáp án : C
Trong cùng một nhóm, tính kim loại tăng dần
Đáp án C
Nguyên tố X có cấu hình electron: 1s 2 2s 2 2p 6 3s 2 3p 4 .vị trí X trong bảng tuần hoàn:
-
A.
Chu kỳ 4, nhóm IVA.
-
B.
Chu kỳ 3,nhóm IVA.
-
C.
Chu kỳ 3, nhóm VIA.
-
D.
Chu kỳ 6, nhóm VIA.
Đáp án : C
Dựa vào cấu hình của X để xác định vị trí của X trong bảng tuần hoàn
X có 3 lớp electron => chu kì 3
X có 6 electron lớp ngoài cùng => nhóm VIA
Đáp án C
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là:
-
A.
1s 2 2s 2 2p 6 3s 2 .
-
B.
1s 2 2s 2 2p 6 3s 1 .
-
C.
1s 2 2s 2 2p 5 3s 2 .
-
D.
1s 2 2s 2 2p 4 3s 1 .
Đáp án : B
Dựa vào Z = 11 của Na để viết cấu hình electron của Na
Đáp án B
Thời Trung Hoa cổ đại loài người đã biết các nguyên tố vàng, bạc, đồng, chì, sắt, thủy ngân và lưu huỳnh. Năm 1649 loài người đã tìm ra nguyên tố photpho. Đến năm 1869, mới có 63 nguyên tố được tìm ra. Vây nguyên tố ở ô thứ 35 là nguyên tố nào sau đây?
-
A.
Rb.
-
B.
Sr.
-
C.
Kr.
-
D.
Br.
Đáp án : D
Dựa vào ô số nguyên tố để xác định nguyên tố
Nguyên tố ở ô thứ 35 => Bromine
Đáp án D
Theo quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có
-
A.
8 electron tương ứng với khí hiếm gần nhất.
-
B.
2 electron tương ứng với kim loại gần nhất.
-
C.
8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
-
D.
6 electron tương ứng với phi kim gần nhất.
Đáp án : C
Dựa vào kiến thức về quy tắc octet
Quy tắc octet: nguyên tử các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium)
Đáp án C
Ion lithium có cấu hình electron của khí hiếm tương ứng nào
-
A.
He.
-
B.
Ne
-
C.
Ar.
-
D.
Kr.
Đáp án : A
Ion Lithium nhường đi 1 electron để có 2 electron lớp ngoài cùng giống nguyên tố helium
Đáp án A
Cho các phân tử: H 2 , CO 2 , HCl, Cl 2 . Có bao nhiêu phân tử có cực?
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Đáp án : A
Dựa vào độ âm điện của các nguyên tử
Có HCl là phân tử có cực
Đáp án A
Các chất mà phân tử không phân cực là:
-
A.
HBr, CO 2 , CH 4 .
-
B.
Cl 2 , CO 2 , C 2 H 2 .
-
C.
HCl, C 2 H 2 , Br 2 .
-
D.
NH 3 ,Br 2 , C 2 H 4 .
Đáp án : B
Dựa vào hiệu độ âm điện của các nguyên tử
Đáp án B
Những liên kết có lực liên kết yếu như
-
A.
liên kết hydrogen và tương tác Van der Waals.
-
B.
liên kết ion và liên kết cộng hóa trị.
-
C.
liên kết ion và liên kết hydrogen.
-
D.
liên kết hydrogen và liên kết cộng hóa trị.
Đáp án : A
Dựa vào kiến thức của các loại liên kết
Đáp án A
Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi electron khi hình thành liên kết hóa học như hình dưới đây?

-
A.
helium.
-
B.
magnesium.
-
C.
aluminium.
-
D.
sodium.
Đáp án : D
Các nguyên tố kim loại nhóm IA có xu hướng nhường đi 1 electron
Đáp án D
Số oxi hoá của nguyên tố lưu huỳnh trong các chất: S, H 2 S, H 2 SO 4 , SO 2 lần lượt là:
-
A.
0, +2, +6, +4.
-
B.
0, –2, +4, –4.
-
C.
0, –2, –6, +4.
-
D.
0, –2, +6, +4.
Đáp án : D
Dựa vào quy tắc xác định số oxi hóa
Đáp án D
Liên kết hoá học giữa các nguyên tử trong phân tử H 2 O là liên kết
-
A.
cộng hóa trị không phân cực.
-
B.
hydrogen.
-
C.
cộng hoá trị phân cực.
-
D.
ion.
Đáp án : C
Liên kết hóa học giữa các nguyên tử trong phân tử H 2 O là liên kết cộng hóa trị phân cực do độ âm điện của oxygen lớn hơn hydrogen
Đáp án C
Mô tả sự hình thành ion của nguyên tử O (Z = 8) theo quy tắc octet là
-
A.
O + 2e ⟶ O 2− .
-
B.
O ⟶ O 2+ + 2e.
-
C.
O + 6e ⟶ O 6− .
-
D.
O + 2e ⟶ O 2+ .
Đáp án : A
Oxygen có xu hướng nhận thêm 2 electron để đạt cấu hình của khí hiếm
Đáp án A
Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung là
-
A.
liên kết ion.
-
B.
liên kết cộng hoá trị.
-
C.
liên kết kim loại.
-
D.
liên kết hydrogen.
Đáp án : B
Dựa vào kiến thức về liên kết hóa học
Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung là liên kết cộng hóa trị
Đáp án B
Chỉ ra nội dung không đúng khi hoàn thành câu sau: “Trong tất cả các hợp chất,..”
-
A.
kim loại kiềm luôn có số oxi hoá +1.
-
B.
halogen luôn có số oxi hoá –1.
-
C.
hydrogen hầu hết có số oxi hoá +1, trừ một số trường hợp như hiđrua kim loại (NaH, CaH 2 ..).
-
D.
kim loại kiềm thổ luôn có số oxi hoá +2.
Đáp án : B
Dựa vào quy tắc xác định số oxi hóa
Đáp án B sai vì các nguyên tố nhóm halogen có nhiều số oxi hóa
Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung
-
A.
ở giữa hai nguyên tử.
-
B.
lệch về một phía của một nguyên tử.
-
C.
chuyển hẳn về một nguyên tử.
-
D.
nhường hẳn về một nguyên tử.
Đáp án : B
Dựa vào kiến thức liên kết cộng hóa trị phân cực
Đáp án B
Tương tác Van Der Waals tồn tại giữa những
-
A.
ion.
-
B.
hạt proton.
-
C.
hạt neutron.
-
D.
phân tử
Đáp án : D
Dựa vào kiến thức về lực tương tác van der Waals
Đáp án D