Đề thi học kì 2 Hóa 10 Kết nối tri thức - Đề 2
Trong phản ứng oxi hóa – khử, chất khử là chất A. nhường electron. B. nhận electron. C. nhận proton. D.nhường proton.
Đề bài
Phần trắc nghiệm (7 điểm)
Câu 1. Trong phản ứng oxi hóa – khử, chất khử là chất
A. nhường electron.
B. nhận electron.
C. nhận proton.
D.nhường proton.
Câu 2. Dẫn khí H 2 đi qua ông sứ đựng bột CuO nung nóng để thực hiện phản ứng hóa học sau:
CuO + H 2 → Cu + H 2 O
Trong phản ứng trên, chất đóng vai trò chất khử là
A. CuO
B. Cu
C. H 2
D.H 2 O
Câu 3. Thuốc tím chứa ion permanganate (MnO 4 - ) có tính oxi hóa mạnh, được dùng để sát trùng, diệt khuẩn trong y học, đời sống và nuôi trồng thủy sản. Số oxi hóa của manganse trong ion permanganate là
A. +2
B. +3
C. +7
D.+6
Câu 4. Khi tham gia phản ứng đốt cháy nhiên liệu, oxygen đóng vai trò là
A. chất khử.
B. acid.
C. chất oxi hóa.
D.base.
Câu 5. Chlorine vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử trong phản ứng nào sau đây?
A. 2Na + Cl 2 → 2NaCl.
B. H 2 + Cl 2 → 2HCl.
C. 2FeCl 2 + Cl 2 → 2FeCl 3.
D.2NaOH + Cl 2 → NaCl + NaClO + H 2 O.
Câu 6. Nguyên tử carbon vừa có khả năng thể hiện tính oxi hóa, vừa có khả năng thể hiện tính khử trong chất nào sau đây?
A. C.
B. CO 2 .
C. CaCO 3 .
D.CH 4 .
Câu 7. Cho các phân tử sau: H 2 S, SO 3 , CaSO 4 , Na 2 S, H 2 SO 4 . Số oxi hóa của nguyên tử S trong các phân tử trên lần lượt là
A. 0, +6, +4, +4, +6.
B. 0, +6, +4, +2, +6.
C. +2, +6, +6, -2, +6.
D. -2, +6, +6, -2, +6.
Câu 8. Nung KNO 3 lên 550 o C xảy ra phản ứng:
KNO 3 (s) → KNO 2 (s) + 1/2O 2 (g) ∆H
Phản ứng nhiệt phân KNO 3 là
A. tỏa nhiệt, có ∆H < 0.
B. thu nhiệt, có ∆H > 0.
C. tỏa nhiệt, ∆H > 0.
D. thu nhiệt, có ∆H < 0.
Câu 9. Phản ứng nào sau đây là phản ứng tỏa nhiệt?
A. Phản ứng nhiệt phân muối KNO 3 .
B. Phản ứng phân hủy khí NH 3 .
C. Phản ứng oxi hóa glucose trong cơ thể.
D.Phản ứng hòa tan NH 4 Cl trong nước.
Câu 10. Phát biểu nào sau đây không đúng?
A. Các phản ứng phân hủy thường là phản ứng thu nhiệt.
B. Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra.
C. Phản ứng oxi hóa chất béo cung cấp nhiệt cho cơ thể.
D. Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Câu 11 . Cho phương trình phản ứng
Zn (r) + CuSO 4 → ZnSO 4 (aq) + Cu (s) ∆H = -210 kJ
và các phát biểu sau:
(1) Zn bị oxi hóa.
(2) Phản ứng trên tỏa nhiệt.
(3) Biến thiên enthalpy của phản ứng tạo thành 3,84 gam Cu là +12,6 kJ.
(4) Trong quá trình phản ứng, nhiệt độ hỗn hợp tăng lên.
Các phát biểu đúng là
A. (1) và (3).
B. (2) và (4).
C. (1) (2) và (4).
D.(1) (3) và (4)
Câu 12. Phát biểu nào sau đây đúng về xúc tác?
A. Xúc tác giúp làm tăng năng lượng hoạt hóa của phản ứng.
B. Khối lượng xúc tác không thay đổi sau phản ứng.
C. Xúc tác không tương tác với các chất tạo thành hợp chất bền.
D.Xúc tác kết hợp với sản phẩm phản ứng tạo thành hợp chất bền.
Câu 13. Cho phản ứng hóa học sau:
Zn (s) + H 2 SO 4 (aq) → ZnSO 4 (aq) + H 2 (g)
Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng?
A. Diện tích bề mặt zinc.
B. Nồng độ dung dịch sulfuric acid.
C. Thể tích dung dịch sulfuric acid.
D. Nhiệt độ của dung dịch sulfuric acid.
Câu 14. Cách nào sau đây làm củ khoai tây chín nhanh nhất?
A. Luộc trong nước sôi.
B. Hấp cách thủy trong nồi cơm.
C. Nướng ở 180 o C.
D.Hấp trên nồi hơi.
Câu 15. Cho phản ứng hóa học sau: C (s) + O 2 (g) → CO 2 (g)
Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng trên?
A. Nhiệt độ.
B. Áp suất O 2 .
C. Hàm lượng carbon.
D.Diện tích bề mặt carbon.
Câu 16. Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng?
A. áp suất.
B. diện tích tiếp xúc.
C. khối lượng riêng.
D.chất xúc tác.
Câu 17. Số electron ở lớp ngoài cùng của mỗi nguyên tử nguyên tố halogen là
A. 5
B. 7
C. 2
D.8
Câu 18. Tính chất hóa học đặc trưng của đơn chất helogen là
A. tính khử.
B. tính base.
C. tính acid.
D. tính oxi hóa.
Câu 19. Ở điều kiện thường, halogen tồn tại ở thể rắn, có màu đen tím là
A. F 2 .
B. Br 2
C. I 2
D. Cl 2
Câu 20. Muối nào có nhiều nhất trong nước biển với nồng độ khoảng 3%?
A. NaCl.
B. KCl.
C. MgCl 2 .
D.NaF.
Câu 21. Khi tác dụng với kim loại, các nguyên tử halogen thể hiện xu hướng nào sau đây?
A. Nhường 1 electron.
B. Nhận 1 electron.
C. Nhường 7 electron.
D.Góp chung 1 electron.
Câu 22. Trong các đơn chất halogen, từ F 2 đến I 2 , nhiệt độ sôi biến đổi như thế nào?
A. Giảm dần.
B. Tuần hoàn.
C. Không đổi.
D. Tăng dần.
Câu 23. Cho khí Cl 2 tác dụng với dung dịch KOH, đun nóng, thu được dung dịch chứa muối KCl và muối nào sau đây?
A. KClO.
B. KClO 3 .
C. KClO 4 .
D.KClO 2 .
Câu 24. Trong dãy hydrohalic acid, từ HF đến HI, tính acid tăng dần do nguyên nhân chính là
A. tương tác van der waals tăng dần.
B. độ phân cực liên kết giảm dần.
C. phân tử khối tăng dần.
D.độ bền liên kết giảm dần.
Câu 25. Hòa tan hoàn toàn 20 gam hỗn hợp Mg và Fe bằng dung dịch HCl dư. Sau phản ứng thu được 11,2 lít khí (đktc) và dung dịch X. Cô cạn dung dịch X thì thu được bao nhiêu gam muối khan?
A. 71 gam.
B. 90 gam.
C. 55,5 gam.
D. 91 gam.
Câu 26. Cho 26,1 gam MnO 2 tác dụng với dung dịch HCl dư thu được 6,048 lít Cl 2 (đktc). Tính hiệu suất của phản ứng.
A. 80%
B. 90%
C. 100%
D. 95%
Câu 27. Cho 2,24 lít khí HCl (đktc) vào 100 ml dung dịch NaOH 1,2M. Dung dịch sau phản ứng có môi trường
A. acid.
B. base.
C. trung tính.
D. lưỡng tính.
Câu 28. Br 2 bị lẫn tạp chất là Cl 2 . Cách nào sau đây có thể thu được Br 2 tinh khiết?
A. Dẫn hỗn hợp khí đi qua dung dịch NaOH.
B. Dẫn hỗn hợp khí đi qua dung dịch nước.
C. Dẫn hỗn hợp khí đi qua dung dịch NaBr.
D. Dẫn hỗn hợp khí đi qua dung dịch NaI.
Phần tự luận (3 điểm)
Câu 1. Hàm lượng iron(II) sulfate được xác định qua phản ứng oxi hóa – khử với potassium permanganate:
FeSO 4 + KMnO 4 + H 2 SO 4 → Fe 2 (SO 4 ) 3 + K 2 SO 4 + MnSO 4 + H 2 O
a, Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron. Chỉ rõ chất oxi hóa, chất khử.
b, Thể tích dung dịch KMnO 4 0,02M để phản ứng vừa đủ với 20 ml dung dịch FeSO 4 0,1M.
Câu 2. Cho phản ứng sau: \(CH \equiv CH\)(g) + H 2 (g) → CH 3 -CH 3 (g)
Năng lượng liên kết (kJ.mol -1 ) của H-H là 436, của C-C là 347, của C-H là 414 và của \(C \equiv C\) là 839.Tính nhiệt (∆H) của phản ứng và cho biết phản ứng thu hay tỏa nhiệt.
Câu 3. Trong công nghiệp, nước Javel được sản xuất bằng phương pháp điện phân dung dịch NaCl không sử dụng màng ngăn điện cực. Khi đó, Cl 2 và NaOH tạo thành sẽ tiếp tục phản ứng với nhau.
Viết PTHH của các phản ứng xảy ra khi sản xuất nước Javen. Xác định vai trò của NaCl và Cl 2 trong mỗi phản ứng.
Phương pháp giải:
Lời giải chi tiết:
Đáp án
Phần trắc nghiệm (7 điểm)
Câu 1. Trong phản ứng oxi hóa – khử, chất khử là chất
A. nhường electron.
B. nhận electron.
C. nhận proton.
D.nhường proton.
Hướng dẫn giải:
Chất khử là chất nhường electron.
Chất oxi hóa là chất nhận electron.
Lời giải chi tiết:
Đáp án A.
Câu 2. Dẫn khí H 2 đi qua ông sứ đựng bột CuO nung nóng để thực hiện phản ứng hóa học sau:
CuO + H 2 → Cu + H 2 O
Trong phản ứng trên, chất đóng vai trò chất khử là
A. CuO
B. Cu
C. H 2
D.H 2 O
Hướng dẫn giải:
Chất khử là chất nhường electron.
Chất oxi hóa là chất nhận electron.
\(\mathop {Cu}\limits^{ + 2} + 2e \to \mathop {Cu}\limits^0 \): chất oxi hóa.
\({\mathop H\limits^0 _2} \to 2\mathop {H + 2e}\limits^{ + 1} \): chất khử.
Lời giải chi tiết:
Đáp án C.
Câu 3. Thuốc tím chứa ion permanganate (MnO 4 - ) có tính oxi hóa mạnh, được dùng để sát trùng, diệt khuẩn trong y học, đời sống và nuôi trồng thủy sản. Số oxi hóa của manganse trong ion permanganate là
A. +2
B. +3
C. +7
D.+6
Hướng dẫn giải:
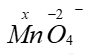
--> x + (-2).4 = -1 à x = +7
Lời giải chi tiết:
Đáp án C.
Câu 4. Khi tham gia phản ứng đốt cháy nhiên liệu, oxygen đóng vai trò là
A. chất khử.
B. acid.
C. chất oxi hóa.
D.base.
Hướng dẫn giải:
\(\mathop {{O_2}}\limits^0 + 2e \to \mathop {2O}\limits^{ - 2} \)
--> Đóng vai trò chất oxi hóa.
Lời giải chi tiết:
Đáp án C.
Câu 5. Chlorine vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử trong phản ứng nào sau đây?
A. 2Na + Cl 2 → 2NaCl.
B. H 2 + Cl 2 → 2HCl.
C. 2FeCl 2 + Cl 2 → 2FeCl 3.
D.2NaOH + Cl 2 → NaCl + NaClO + H 2 O.
Hướng dẫn giải:
\[\begin{array}{l}\mathop {C{l_2}}\limits^0 + 2e \to \mathop {2Cl}\limits^{ - 1} \\\mathop {C{l_2}}\limits^0 \to 2\mathop {Cl}\limits^{ + 1} + 2e\end{array}\]
--> Cl 2 vừa đóng vau trò chất khử, vừa đóng vai trò chất oxi hóa.
Lời giải chi tiết:
Đáp án D.
Câu 6. Nguyên tử carbon vừa có khả năng thể hiện tính oxi hóa, vừa có khả năng thể hiện tính khử trong chất nào sau đây?
A. C.
B. CO 2 .
C. CaCO 3 .
D.CH 4 .
Hướng dẫn giải:
Trong đơn chất C, nguyên tử carbon có số oxi hóa là 0, đây là số oxi hóa trung gian của carbon, do đó trong đơn chất C, nguyên tử carbon vừa có khả năng thể hiện tính oxi hoá, vừa có khả năng thể hiện tính khử.
Lời giải chi tiết:
Đáp án A.
Câu 7. Cho các phân tử sau: H 2 S, SO 3 , CaSO 4 , Na 2 S, H 2 SO 4 . Số oxi hóa của nguyên tử S trong các phân tử trên lần lượt là
A. 0, +6, +4, +4, +6.
B. 0, +6, +4, +2, +6.
C. +2, +6, +6, -2, +6.
D. -2, +6, +6, -2, +6.
Hướng dẫn giải:
Qui tắc xác định số oxi hóa:
1. Trong đơn chất, số oxi hóa của nguyên tử bằng 0.
2. Trong hợp chất, số oxi hóa của H thường là -1, O thường là -2.
3. Trong hợp chất, tổng số oxi hóa của nguyên tử các nguyên tố bằng 0.
4. Trong ion đơn chất, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của nguyên tử bằng điện tích ion.
Lời giải chi tiết:
Đáp án D.
Câu 8. Nung KNO 3 lên 550 o C xảy ra phản ứng:
KNO 3 (s) → KNO 2 (s) + 1/2O 2 (g) ∆H
Phản ứng nhiệt phân KNO 3 là
A. tỏa nhiệt, có ∆H < 0.
B. thu nhiệt, có ∆H > 0.
C. tỏa nhiệt, ∆H > 0.
D. thu nhiệt, có ∆H < 0.
Hướng dẫn giải:
Phản ứng nhiệt phân KNO 3 chỉ xảy ra ở nhiệt độ cao, khi cung cấp nhiệt vào, đó là phản ứng thu nhiệt, theo quy ước ∆H > 0
Lời giải chi tiết:
Đáp án B.
Câu 9. Phản ứng nào sau đây là phản ứng tỏa nhiệt?
A. Phản ứng nhiệt phân muối KNO 3 .
B. Phản ứng phân hủy khí NH 3 .
C. Phản ứng oxi hóa glucose trong cơ thể.
D.Phản ứng hòa tan NH 4 Cl trong nước.
Hướng dẫn giải:
Oxi hóa glucose thành CO 2 và H 2 O, tương tự phản ứng đốt cháy glucose là phản ứng tỏa nhiệt.
Lời giải chi tiết:
Đáp án C.
Câu 10. Phát biểu nào sau đây không đúng?
A. Các phản ứng phân hủy thường là phản ứng thu nhiệt.
B. Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra.
C. Phản ứng oxi hóa chất béo cung cấp nhiệt cho cơ thể.
D. Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Hướng dẫn giải:
Lời giải chi tiết:
Đáp án D.
Câu 11 . Cho phương trình phản ứng
Zn (r) + CuSO 4 → ZnSO 4 (aq) + Cu (s) ∆H = -210 kJ
và các phát biểu sau:
(1) Zn bị oxi hóa.
(2) Phản ứng trên tỏa nhiệt.
(3) Biến thiên enthalpy của phản ứng tạo thành 3,84 gam Cu là +12,6 kJ.
(4) Trong quá trình phản ứng, nhiệt độ hỗn hợp tăng lên.
Các phát biểu đúng là
A. (1) và (3).
B. (2) và (4).
C. (1) (2) và (4).
D.(1) (3) và (4)
Hướng dẫn giải:
(1) à Zn bị oxi hóa.
--> (1) đúng.
(2) ∆H = -210 kJ < 0 à Phản ứng tỏa nhiệt --> (2) đúng.
(3) Biến thiên enthalpy của phản ứng tạo thành 1 mol Cu ~ 64 gam Cu là ∆H = -210 kJ
--> Biến thiên enthalpy của phản ứng tạo thành 3,84 g Cu là
-210.3,8486 = -12,6 -210.3,8464 = -12,6 kJ/mol
--> (3) sai.
(4) Phản ứng tỏa nhiệt à Trong quá trình phản ứng, nhiệt độ tăng lên.
--> (4) đúng.
Lời giải chi tiết:
Đáp án C.
Câu 12. Phát biểu nào sau đây đúng về xúc tác?
A. Xúc tác giúp làm tăng năng lượng hoạt hóa của phản ứng.
B. Khối lượng xúc tác không thay đổi sau phản ứng.
C. Xúc tác không tương tác với các chất tạo thành hợp chất bền.
D.Xúc tác kết hợp với sản phẩm phản ứng tạo thành hợp chất bền.
Hướng dẫn giải:
Chất xúc tác không bị biến đổi về lượng và chất sau phản ứng.
Lời giải chi tiết:
Đáp án B.
Câu 13. Cho phản ứng hóa học sau:
Zn (s) + H 2 SO 4 (aq) → ZnSO 4 (aq) + H 2 (g)
Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng?
A. Diện tích bề mặt zinc.
B. Nồng độ dung dịch sulfuric acid.
C. Thể tích dung dịch sulfuric acid.
D. Nhiệt độ của dung dịch sulfuric acid.
Hướng dẫn giải:
- 5 yếu tố ảnh hưởng đến tốc độ phản ứng:
1. Nồng độ.
2. Nhiệt độ.
3. Áp suất.
4. Chất xúc tác.
5. Diện tích bề mặt tiếp xúc.
Lời giải chi tiết:
Đáp án C.
Câu 14. Cách nào sau đây làm củ khoai tây chín nhanh nhất?
A. Luộc trong nước sôi.
B. Hấp cách thủy trong nồi cơm.
C. Nướng ở 180 o C.
D.Hấp trên nồi hơi.
Hướng dẫn giải:
Đây là ảnh hưởng của nhiệt độ đến tốc độ phản ứng: Nhiệt độ càng cao thì tốc độ phản ứng càng nhanh
à Củ khoai tây nhanh chín.
Lời giải chi tiết:
Đáp án C.
Câu 15. Cho phản ứng hóa học sau: C (s) + O 2 (g) → CO 2 (g)
Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng trên?
A. Nhiệt độ.
B. Áp suất O 2 .
C. Hàm lượng carbon.
D.Diện tích bề mặt carbon.
Hướng dẫn giải: - 5 yếu tố ảnh hưởng đến tốc độ phản ứng:
1. Nồng độ.
2. Nhiệt độ.
3. Áp suất.
4. Chất xúc tác.
5. Diện tích bề mặt tiếp xúc.
Lời giải chi tiết:
Đáp án C.
Câu 16. Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng?
A. áp suất.
B. diện tích tiếp xúc.
C. khối lượng riêng.
D.chất xúc tác.
Hướng dẫn giải:
- 5 yếu tố ảnh hưởng đến tốc độ phản ứng:
1. Nồng độ.
2. Nhiệt độ.
3. Áp suất.
4. Chất xúc tác.
5. Diện tích bề mặt tiếp xúc.
Lời giải chi tiết:
Đáp án C.
Câu 17. Số electron ở lớp ngoài cùng của mỗi nguyên tử nguyên tố halogen là
A. 5
B. 7
C. 2
D. 8
Hướng dẫn giải:
Các nguyên tố halogen có 7 electron lớp ngoài cùng.
Lời giải chi tiết:
Đáp án B.
Câu 18. Tính chất hóa học đặc trưng của đơn chất helogen là
A. tính khử.
B. tính base.
C. tính acid.
D. tính oxi hóa.
Hướng dẫn giải:
Các đơn chất halogen có số oxi hóa 0, trong phản ứng sẽ có số oxi hóa đặc trưng là -1
à Tính chất hóa học đặc trưng là tính oxi hóa.
Lời giải chi tiết:
Đáp án B.
Câu 19. Ở điều kiện thường, halogen tồn tại ở thể rắn, có màu đen tím là
A. F 2 .
B. Br 2
C. I 2
D. Cl 2
Hướng dẫn giải: Trạng thái và màu sắc các halogen ở điều kiện thường:
- F 2 : khí màu lục nhạt.
- Cl 2 : khí màu vàng lục.
- Br 2 : lỏng màu nâu đỏ.
- I 2 : rắn màu tím đen.
Lời giải chi tiết:
Đáp án C.
Câu 20. Muối nào có nhiều nhất trong nước biển với nồng độ khoảng 3%?
A. NaCl.
B. KCl.
C. MgCl 2 .
D.NaF.
Hướng dẫn giải:
Muối có nhiều nhất trong nước biển với nồng độ khoảng 3% là NaCl.
Lời giải chi tiết:
Đáp án A.
Câu 21. Khi tác dụng với kim loại, các nguyên tử halogen thể hiện xu hướng nào sau đây?
A. Nhường 1 electron.
B. Nhận 1 electron.
C. Nhường 7 electron.
D.Góp chung 1 electron.
Hướng dẫn giải:
Khi tác dụng với kim loại, các nguyên tử halogen có xu hướng nhận 1 electron.
Lời giải chi tiết:
Đáp án B.
Câu 22. Trong các đơn chất halogen, từ F 2 đến I 2 , nhiệt độ sôi biến đổi như thế nào?
A. Giảm dần.
B. Tuần hoàn.
C. Không đổi.
D. Tăng dần.
Hướng dẫn giải:
Nhiệt độ sôi, nhiệt độ nóng chảy của các halogen từ F 2 đến I 2 tăng dần do:
- Tương tác Van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.
Lời giải chi tiết:
Đáp án D.
Câu 23. Cho khí Cl 2 tác dụng với dung dịch KOH, đun nóng, thu được dung dịch chứa muối KCl và muối nào sau đây?
A. KClO.
B. KClO 3 .
C. KClO 4 .
D.KClO 2 .
Hướng dẫn giải: PTHH:
Ở nhiệt độ thường: Cl 2 + KOH → KCl + KClO + H 2 O
Ở nhiệt độ cao với KOH đặc: Cl 2 + KOH → KCl + KClO 3 + H 2 O
Lời giải chi tiết:
Đáp án A.
Câu 24. Trong dãy hydrohalic acid, từ HF đến HI, tính acid tăng dần do nguyên nhân chính là
A. tương tác van der waals tăng dần.
B. độ phân cực liên kết giảm dần.
C. phân tử khối tăng dần.
D. độ bền liên kết giảm dần.
Hướng dẫn giải:
Trong dãy hydrohalic acid, từ HF đến HI độ bền liên kết giảm dần ⇒ khả năng phân li H + trong dung dịch tăng dần ⇒ Tính acid tăng dần.
Lời giải chi tiết:
Đáp án D.
Câu 25. Hòa tan hoàn toàn 20 gam hỗn hợp Mg và Fe bằng dung dịch HCl dư. Sau phản ứng thu được 11,2 lít khí (đktc) và dung dịch X. Cô cạn dung dịch X thì thu được bao nhiêu gam muối khan?
A. 71 gam.
B. 90 gam.
C. 55,5 gam.
D. 91 gam.
Hướng dẫn giải:
\[20gam\left\{ \begin{array}{l}Mg\\Fe\end{array} \right. + HCl \to ddX + 0,5(mol)khí{H_2}\]
Bảo toàn H: n HCl = 2n H2 à n HCl = 1 mol
BTKL: m Fe+Mg + m HCl = m X + m H2
à 20 + 36,5.1 = m X + 0,5.2
à m X = 55,5 (gam)
Lời giải chi tiết:
Đáp án C.
Câu 26. Cho 26,1 gam MnO 2 tác dụng với dung dịch HCl dư thu được 6,048 lít Cl 2 (đktc). Tính hiệu suất của phản ứng.
A. 80%
B. 90%
C. 100%
D. 95%
Hướng dẫn giải:
Dựa vào PTHH:
MnO 2 + 4HCl → MnCl 2 + Cl 2 + 2H 2 O
0,3 -> 0,3
n MnO2 = 26,1/87 =0,3 mol
n Cl2 = 6,048/22,4 = 0,27 mol
Theo lí thuyết: n MnO2 = 0,3 mol à n Cl2 (lí thuyết) = 0,3 mol.
Mà thực tế n Cl2 (thực tế) = 0,27 mol, nên
\[\begin{array}{l}H = \frac{{{n_{C{l_2}(tt)}}}}{{{n_{C{l_2}(lt)}}}}.100\% = \frac{{0,27}}{{0,3}}.100\% = 90\% \\\end{array}\]
Lời giải chi tiết:
Đáp án B.
Câu 27. Cho 2,24 lít khí HCl (đktc) vào 100 ml dung dịch NaOH 1,2M. Dung dịch sau phản ứng có môi trường
A. acid.
B. base.
C. trung tính.
D. lưỡng tính.
Hướng dẫn giải:
n HCl = 0,1 mol.
n NaOH = 0,12 mol
HCl + NaOH → NaCl + H 2 O
bđ 0,1 0,12 0 0
pư 0,1 0,1 0,1 0,1
spư 0 0,02 0,1 0,1
Sau phản ứng, HCl hết; NaOH dư --> Dung dịch có môi trường base.
Lời giải chi tiết:
Đáp án B.
Câu 28. Br 2 bị lẫn tạp chất là Cl 2 . Cách nào sau đây có thể thu được Br 2 tinh khiết?
A. Dẫn hỗn hợp khí đi qua dung dịch NaOH.
B. Dẫn hỗn hợp khí đi qua dung dịch nước.
C. Dẫn hỗn hợp khí đi qua dung dịch NaBr.
D.Dẫn hỗn hợp khí đi qua dung dịch NaI.
Hướng dẫn giải:
Để làm sạch brom có lẫn clo, người ta dẫn hỗn hợp đi qua dung dịch NaBr:
PTHH: Cl2+2NaBr→2NaCl+Br2.
Lời giải chi tiết:
Đáp án C.
Phần tự luận (3 điểm)
Câu 1. Hàm lượng iron(II) sulfate được xác định qua phản ứng oxi hóa – khử với potassium permanganate:
FeSO 4 + KMnO 4 + H 2 SO 4 → Fe 2 (SO 4 ) 3 + K 2 SO 4 + MnSO 4 + H 2 O
a, Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron. Chỉ rõ chất oxi hóa, chất khử.
b, Thể tích dung dịch KMnO 4 0,02M để phản ứng vừa đủ với 20 ml dung dịch FeSO 4 0,1M.
Hướng dẫn giải:
a, Sử dụng phương pháp thăng bằng electron để cân bằng PTHH.
Chất oxi hóa là chất nhận electron.
Chất khử là chất nhường electron.
b, Tính theo PTHH.
Lời giải chi tiết:
a, PTHH:
\(10\mathop {Fe}\limits^{ + 2} S{O_4} + {\rm{ 2}}\mathop {KMn}\limits^{ + 7} {O_4} + {\rm{ 8}}{H_2}S{O_4} \to {\rm{ 5}}{\mathop {Fe}\limits^{ + 3} _2}{\left( {S{O_4}} \right)_3} + {\rm{ }}{K_2}S{O_4} + {\rm{ }}\mathop {2Mn}\limits^{ + 2} S{O_4} + {\rm{ 8}}{H_2}O\)
\(\begin{array}{l}\mathop {2Fe}\limits^{ + 2} \to \mathop {2Fe}\limits^{ + 3} + 2e\\\mathop {Mn}\limits^{ + 7} + 5e \to \mathop {Mn}\limits^{ + 2} \end{array}\)
FeSO 4 là chất khử.
KMnO 4 là chất oxi hóa.
b, n FeSO4 = 0,002 mol
\(10\mathop {Fe}\limits^{ + 2} S{O_4} + {\rm{ 2}}\mathop {KMn}\limits^{ + 7} {O_4} + {\rm{ 8}}{H_2}S{O_4} \to {\rm{ 5}}{\mathop {Fe}\limits^{ + 3} _2}{\left( {S{O_4}} \right)_3} + {\rm{ }}{K_2}S{O_4} + {\rm{ }}\mathop {2Mn}\limits^{ + 2} S{O_4} + {\rm{ 8}}{H_2}O\)
0,002 → 0,0004
C M = n/V → V = n/C M = 0,0004/0,02 = 0,02 lít = 20ml.
Câu 2. Cho phản ứng sau: \(CH \equiv CH\)(g) + H 2 (g) → CH 3 -CH 3 (g)
Năng lượng liên kết (kJ.mol -1 ) của H-H là 436, của C-C là 347, của C-H là 414 và của \(C \equiv C\) là 839.Tính nhiệt (∆H) của phản ứng và cho biết phản ứng thu hay tỏa nhiệt.
Hướng dẫn giải:
Lời giải chi tiết:
\({\Delta _r}H_{298}^0 = 2{E_{(C - H)}} + {E_{(C \equiv C)}} + 2{E_{(H - H)}} - 6{E_{(C - H)}} - {E_{(C - C)}}\)
= 2.414 + 839 + 2.436 -6.414 – 347 = -292 (kJ/mol) < 0
→ Phản ứng tỏa nhiệt.
Câu 3. Trong công nghiệp, nước Javel được sản xuất bằng phương pháp điện phân dung dịch NaCl không sử dụng màng ngăn điện cực. Khi đó, Cl 2 và NaOH tạo thành sẽ tiếp tục phản ứng với nhau.
Viết PTHH của các phản ứng xảy ra khi sản xuất nước Javen. Xác định vai trò của NaCl và Cl 2 trong mỗi phản ứng.
Hướng dẫn giải:
Lời giải chi tiết:
Phản ứng điện phân có sinh ra khí chlorine ở anode, hydrogen và sodium hydroxide ở cathode:
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 : NaCl là chất khử.
Do không có màng ngăn điện cực nên khí Cl 2 và NaOH khuếch tan sang nhau trong bình điện phân và xảy ra phản ứng:
2NaOH + Cl 2 → NaCl + NaClO + H 2 O: Cl 2 vừa là chất khử, vừa là chất oxi hóa.
Phương pháp giải:
Lời giải chi tiết: