Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề số 1
Hạt mang điện trong nhân nguyên tử là:
Đề bài
Hạt mang điện trong nhân nguyên tử là:
-
A.
electron
-
B.
proton
-
C.
neutron
-
D.
proton và neutron
Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của
-
A.
các nguyên tử trong phân tử.
-
B.
các electron trong phân tử.
-
C.
các proton trong hạt nhân.
-
D.
các neutron và proton trong hạt nhân
Các nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học?
-
A.
\(_7^{14}\)G; \(_8^{16}\)M.
-
B.
\(_8^{16}\) Y và \(_{11}^{22}\)R.
-
C.
\(_7^{15}\)L và \(_{10}^{20}\)T.
-
D.
\(_8^{16}\)E và \(_8^{17}\)Q.
Ở lớp thứ hai (n=2) có bao nhiêu phân lớp electron?
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Cho hai nguyên tử của Chlorine là \(_{17}^{37}Cl\) và \(_{17}^{35}Cl\). Phát biểu nào sau đây không đúng?
-
A.
có cùng một số hiệu nguyên tử.
-
B.
đều có điện tích hạt nhân là 17+.
-
C.
là đồng vị của nhau.
-
D.
có cùng số neutron.
Một nguyên tử X có số hiệu nguyên tử Z =19. Số lớp electron trong nguyên tử X là
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Cho các nguyên tử có số hiệu tương ứng X (Z = 8), Y (Z = 10), R (Z = 17), T (Z = 20). Nguyên tử là kim loại là:
-
A.
X.
-
B.
Y.
-
C.
R.
-
D.
T.
Nguyên tố Aluminium (Al, nhôm) có ứng dụng rộng rãi trong cuộc sống như: làm vỏ máy bay, tên lửa, làm vật trang trí, vật dụng nấu ăn…là nguyên tố phổ biến thứ 3 trong vỏ trái đất. Nguyên tử của nguyên tố Alumium có 13 proton trong hạt nhân. Vị trí của Al trong bảng tuần hoàn hóa học là:
-
A.
Chu kì 3, nhóm IIA.
-
B.
Chu kì 2, nhóm IIIA.
-
C.
Chu kì 3, nhóm IIIA.
-
D.
Chu kì 3, nhóm VIIA.
Nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Vị trí của X trong bảng hệ thống tuần hoàn là:
-
A.
chu kì 3, nhóm IVA.
-
B.
chu kì 3, nhóm IIA.
-
C.
chu kì 3, nhóm IIIA.
-
D.
chu kì 3, nhóm VA.
Các nguyên tố nhóm Halogen, nguyên tố nào có tính phi kim mạnh nhất?
-
A.
Bromine.
-
B.
Chlorine.
-
C.
Fluorine.
-
D.
Iodine.
Dãy gồm các chất có tính base tăng dần là:
-
A.
NaOH, KOH, Mg(OH) 2 , Al(OH) 3 .
-
B.
NaOH, Mg(OH) 2 , Al(OH) 3 , KOH.
-
C.
Al(OH) 3 , Mg(OH) 2 , NaOH, KOH.
-
D.
KOH, NaOH, Mg(OH) 2 , Al(OH) 3 .
Nguyên tố X thuộc chu kì 3, nhóm IIA trong bảng tuần hoàn hóa học. Nguyên tử của nguyên tố X có số electron là:
-
A.
20.
-
B.
12.
-
C.
13.
-
D.
19.
Sơ đồ nào sau đây thể hiện đúng liên kết hydrogen giữa 2 phân tử hydrogen fluoride (HF)?
-
A.

-
B.
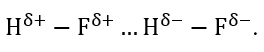
-
C.
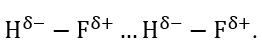
-
D.

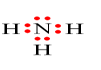
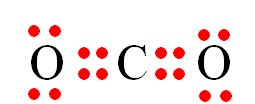
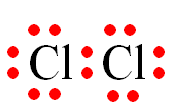
Công thức electron nào sau đây không đủ electron theo quy tắc octet?
-
A.
-
B.
 .
.
-
C.
-
D.
Vì sao các nguyên tử lại liên kết với nhau thành phân tử?
-
A.
Để mỗi nguyên tử trong phân tử đều đạt 8 electron ở lớp ngoài cùng.
-
B.
Để tổng số electron ngoài cùng của các nguyên tử trong phân tử là 8.
-
C.
Để lớp ngoài cùng của mỗi nguyên tử trong phân tử có nhiều electron độc thân nhất.
-
D.
Để mỗi nguyên tử trong phân tử đạt được cấu hình electron ổn định, bền vững.
Nguyên tử nào trong các nguyên tử sau đây không có xu hướng nhường electron để đạt lớp vỏ thỏa mãn quy tắc octet?
-
A.
Calcium.
-
B.
Magnesium.
-
C.
Potassium.
-
D.
Chlorine.
Liên kết hydrogen là loại liên kết hóa học được hình thành giữa các nguyên tử nào sau đây?
-
A.
Phi kim và hydrogen trong hai phân tử khác nhau.
-
B.
Phi kim và hydrogen trong cùng một phân tử.
-
C.
Phi kim có độ âm điện lớn và nguyên tử hydrogen.
-
D.
F, O, N,… có độ âm điện lớn, đồng thời có cặp electron hóa trị chưa liên kết và nguyên tử hydrogen linh động.
Liên kết hóa học trong phân tử nào sau đây là liên kết ion?
-
A.
HClO.
-
B.
Cl 2 .
-
C.
KCl.
-
D.
HCl.
Tính chất nào sau đây là tính chất của hợp chất ion?
-
A.
Hợp chất ion có nhiệt độ nóng chảy thấp.
-
B.
Hợp chất ion có nhiệt độ nóng chảy cao.
-
C.
Hợp chất ion dễ hoá lỏng.
-
D.
Hợp chất ion có nhiệt độ sôi không xác định.
X là nguyên tố mà nguyên tử có 20 proton, Y là nguyên tố mà nguyên tử có 9 proton. Công thức của hợp chất tạo bởi X, Y là:
-
A.
X 2 Y 3 .
-
B.
XY.
-
C.
XY 2 .
-
D.
X 3 Y 2 .
Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng
-
A.
một cặp electron góp chung.
-
B.
sự cho-nhận electron.
-
C.
một cặp electron góp chung.
-
D.
một hay nhiều cặp electron dùng chung.
Các liên kết trong phân tử oxygen gồm
-
A.
2 liên kết π.
-
B.
1 liên kết σ và 1 liên kết π.
-
C.
2 liên kết σ.
-
D.
1 liên kết σ.
Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p-p?
-
A.
H 2 .
-
B.
Cl 2 .
-
C.
NH 3 .
-
D.
HCl.
Điều nào sau đây sai khi nói về tính chất của hợp chất cộng hoá trị?
-
A.
Các hợp chất cộng hoá trị có nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn các hợp chất ion.
-
B.
Các hợp chất cộng hoá trị có thể ở thể rắn, lỏng hoặc khí trong điều kiện thường.
-
C.
Các hợp chất cộng hoá trị đều dẫn điện tốt.
-
D.
Các hợp chất cộng hoá trị không phân cực tan được trong dung môi không phân cực.
Cho độ âm điện của các nguyên tố như sau: O=3,44; Cl=3,16; Mg=1,31; C=2,55; H=2,2. Trong các phân tử MgO, CO 2 , CH 4 , Cl 2 O, số phân tử có kiểu liên kết cộng hóa trị phân cực là:
-
A.
2.
-
B.
3.
-
C.
1.
-
D.
4.
Lời giải và đáp án
Hạt mang điện trong nhân nguyên tử là:
-
A.
electron
-
B.
proton
-
C.
neutron
-
D.
proton và neutron
Đáp án : B
Hạt mang điện trong hạt nhân là proton và neutron
Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của
-
A.
các nguyên tử trong phân tử.
-
B.
các electron trong phân tử.
-
C.
các proton trong hạt nhân.
-
D.
các neutron và proton trong hạt nhân
Đáp án : B
Dựa vào kiến thức về tương tác van der Waals
Các lưỡng cực xuất hiện do sự chuyển động của các electron trong phân tử.
Đáp án B
Các nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học?
-
A.
\(_7^{14}\)G; \(_8^{16}\)M.
-
B.
\(_8^{16}\) Y và \(_{11}^{22}\)R.
-
C.
\(_7^{15}\)L và \(_{10}^{20}\)T.
-
D.
\(_8^{16}\)E và \(_8^{17}\)Q.
Đáp án : D
Các nguyên tử có cùng số proton là các nguyên tử của cùng một nguyên tố
Đáp án D
Ở lớp thứ hai (n=2) có bao nhiêu phân lớp electron?
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Đáp án : B
Lớp 1 có tối đa 2 electron được xếp vào 1 phân lớp s
Lớp 2 có tối đa 8 electron được xếp vào 2 phân lớp s, p
Đáp án B
Cho hai nguyên tử của Chlorine là \(_{17}^{37}Cl\) và \(_{17}^{35}Cl\). Phát biểu nào sau đây không đúng?
-
A.
có cùng một số hiệu nguyên tử.
-
B.
đều có điện tích hạt nhân là 17+.
-
C.
là đồng vị của nhau.
-
D.
có cùng số neutron.
Đáp án : D
Dựa vào kí hiệu nguyên tố của chlorine
\(_{17}^{37}Cl\) và \(_{17}^{35}Cl\) có cùng số proton, là đồng vị của nhau và khác số neutron
Đáp án D
Một nguyên tử X có số hiệu nguyên tử Z =19. Số lớp electron trong nguyên tử X là
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Đáp án : D
Dựa vào Z = E = 19 và quy tắc sắp xếp các electron trong mỗi lớp
Số lớp electron trong nguyên tử X là 4
Cho các nguyên tử có số hiệu tương ứng X (Z = 8), Y (Z = 10), R (Z = 17), T (Z = 20). Nguyên tử là kim loại là:
-
A.
X.
-
B.
Y.
-
C.
R.
-
D.
T.
Đáp án : D
Dựa vào số hiệu của nguyên tử từ đó viết cấu hình electron của nguyên tố hoặc xác định nguyên tố trong bảng tuần hoàn
X (Z=8) => X là oxygen => phi kim
Y (Z = 10) => Y là neon => khí hiếm
T (Z = 20) => T là calcium => kim loại
Đáp án D
Nguyên tố Aluminium (Al, nhôm) có ứng dụng rộng rãi trong cuộc sống như: làm vỏ máy bay, tên lửa, làm vật trang trí, vật dụng nấu ăn…là nguyên tố phổ biến thứ 3 trong vỏ trái đất. Nguyên tử của nguyên tố Alumium có 13 proton trong hạt nhân. Vị trí của Al trong bảng tuần hoàn hóa học là:
-
A.
Chu kì 3, nhóm IIA.
-
B.
Chu kì 2, nhóm IIIA.
-
C.
Chu kì 3, nhóm IIIA.
-
D.
Chu kì 3, nhóm VIIA.
Đáp án : C
Dựa vào số proton của Al
P = E = Z = 13 => Chu kì 3, nhóm IIIA
Đáp án C
Nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Vị trí của X trong bảng hệ thống tuần hoàn là:
-
A.
chu kì 3, nhóm IVA.
-
B.
chu kì 3, nhóm IIA.
-
C.
chu kì 3, nhóm IIIA.
-
D.
chu kì 3, nhóm VA.
Đáp án : A
Tổng số electron trong phân lớp p = 8 => có 2 phân lớp p => chu kì 3
Nguyên tử nguyên tố X thuộc chu kì 3, cấu hình electron: 1s 2 2s 2 2p 6 3s 2 3p 2 => Nhóm IVA
Các nguyên tố nhóm Halogen, nguyên tố nào có tính phi kim mạnh nhất?
-
A.
Bromine.
-
B.
Chlorine.
-
C.
Fluorine.
-
D.
Iodine.
Đáp án : C
Dựa vào xu hướng biến đổi của nhóm A trong bảng tuần hoàn
Trong cùng một nhóm đi từ trên xuống tính phi kim giảm dần
Đáp án C
Dãy gồm các chất có tính base tăng dần là:
-
A.
NaOH, KOH, Mg(OH) 2 , Al(OH) 3 .
-
B.
NaOH, Mg(OH) 2 , Al(OH) 3 , KOH.
-
C.
Al(OH) 3 , Mg(OH) 2 , NaOH, KOH.
-
D.
KOH, NaOH, Mg(OH) 2 , Al(OH) 3 .
Đáp án : C
Dựa vào xu hướng biến đổi của hợp chất hydroxide trong bảng tuần hoàn
Trong cùng một chu kì, tính kim loại giảm dần từ trái sang phải
Trong một nhóm, tính kim loại tăng dần từ trên xuống
KOH > NaOH > Mg(OH) 2 > Al(OH) 3
Đáp án C
Nguyên tố X thuộc chu kì 3, nhóm IIA trong bảng tuần hoàn hóa học. Nguyên tử của nguyên tố X có số electron là:
-
A.
20.
-
B.
12.
-
C.
13.
-
D.
19.
Đáp án : B
Dựa vào vị trí của X trong bảng tuần hoàn
Nguyên tố X có 3 lớp electron ( vì thuộc chu kì 3) và có 2 electron lớp ngoài cùng (vì thuộc nhóm IIA) => X là Mg => có 12 electron
Đáp án B
Sơ đồ nào sau đây thể hiện đúng liên kết hydrogen giữa 2 phân tử hydrogen fluoride (HF)?
-
A.

-
B.
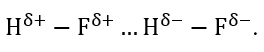
-
C.
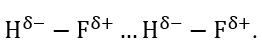
-
D.

Đáp án : A
Liên kết hydrogen giữa 2 phân tử hydrogen fluoride được hình hình giữa lực hút tĩnh điện giữa hydrogen và fluoride
Đáp án A
Công thức electron nào sau đây không đủ electron theo quy tắc octet?
-
A.

-
B.
 .
.
-
C.

-
D.

Đáp án : B
Các nguyên tử nguyên tố có xu hướng cho, nhận hoặc góp chung electron để đạt cấu hình bền vững của khí hiếm
Công thức B sai cho B chưa đạt đủ 8 electron của khí hiếm
Đáp án B
Vì sao các nguyên tử lại liên kết với nhau thành phân tử?
-
A.
Để mỗi nguyên tử trong phân tử đều đạt 8 electron ở lớp ngoài cùng.
-
B.
Để tổng số electron ngoài cùng của các nguyên tử trong phân tử là 8.
-
C.
Để lớp ngoài cùng của mỗi nguyên tử trong phân tử có nhiều electron độc thân nhất.
-
D.
Để mỗi nguyên tử trong phân tử đạt được cấu hình electron ổn định, bền vững.
Đáp án : D
Các nguyên tử nguyên tố có xu hướng cho, nhận hoặc góp chung electron để đạt cấu hình bền vững của khí hiếm
Để mỗi nguyên tử trong phân tử đạt cấu hình electron ổn định, bền vững
Nguyên tử nào trong các nguyên tử sau đây không có xu hướng nhường electron để đạt lớp vỏ thỏa mãn quy tắc octet?
-
A.
Calcium.
-
B.
Magnesium.
-
C.
Potassium.
-
D.
Chlorine.
Đáp án : D
Các nguyên tử kim loại có xu hướng nhường đi electron
Các nguyên tử phi kim có xu hướng nhận thêm electron
Chlorine là nguyên tố phi kim có xu hướng nhận thêm electron
Đáp án D
Liên kết hydrogen là loại liên kết hóa học được hình thành giữa các nguyên tử nào sau đây?
-
A.
Phi kim và hydrogen trong hai phân tử khác nhau.
-
B.
Phi kim và hydrogen trong cùng một phân tử.
-
C.
Phi kim có độ âm điện lớn và nguyên tử hydrogen.
-
D.
F, O, N,… có độ âm điện lớn, đồng thời có cặp electron hóa trị chưa liên kết và nguyên tử hydrogen linh động.
Đáp án : D
Dựa vào khái niệm của liên kết hydrogen
Liên kết hydrogen được hình thành giữa nguyên tử có độ âm điện lớn đồng thời có cặp electron hóa trị chưa liên kết với nguyên tử hydrogen
Đáp án D
Liên kết hóa học trong phân tử nào sau đây là liên kết ion?
-
A.
HClO.
-
B.
Cl 2 .
-
C.
KCl.
-
D.
HCl.
Đáp án : C
Liên kết ion được hình thành giữa kim loại và phi kim
Đáp án C
Tính chất nào sau đây là tính chất của hợp chất ion?
-
A.
Hợp chất ion có nhiệt độ nóng chảy thấp.
-
B.
Hợp chất ion có nhiệt độ nóng chảy cao.
-
C.
Hợp chất ion dễ hoá lỏng.
-
D.
Hợp chất ion có nhiệt độ sôi không xác định.
Đáp án : B
Dựa vào tính chất vật lí của hợp chất ion
Hợp chất ion thường là chất rắn ở điều kiện thường, có nhiệt độ sôi, nhiệt độ nóng chảy cao
X là nguyên tố mà nguyên tử có 20 proton, Y là nguyên tố mà nguyên tử có 9 proton. Công thức của hợp chất tạo bởi X, Y là:
-
A.
X 2 Y 3 .
-
B.
XY.
-
C.
XY 2 .
-
D.
X 3 Y 2 .
Đáp án : C
Dựa vào số proton của X và Y để xác định nguyên tố X, Y
X có 20 proton => X là calcium
Y có 9 proton => Y là fluoride
Công thức hợp chất tạo bởi X, Y là XY 2
Đáp án C
Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng
-
A.
một cặp electron góp chung.
-
B.
sự cho-nhận electron.
-
C.
một cặp electron góp chung.
-
D.
một hay nhiều cặp electron dùng chung.
Đáp án : D
Dựa vào khái niệm của liên kết cộng hóa trị
Liên kết cộng hóa trị được hình thành từ một hay nhiều cặp electron dùng chung
Đáp án D
Các liên kết trong phân tử oxygen gồm
-
A.
2 liên kết π.
-
B.
1 liên kết σ và 1 liên kết π.
-
C.
2 liên kết σ.
-
D.
1 liên kết σ.
Đáp án : B
Liên kết O 2 là O = O
O = O chứa 1 liên kết pi và 1 liên kết σ
Đáp án B
Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p-p?
-
A.
H 2 .
-
B.
Cl 2 .
-
C.
NH 3 .
-
D.
HCl.
Đáp án : D
Sự xen phủ orbital p – p tạo ra khi 2 nguyên tử đều có electron trong phân lớp p
Đáp án D
Điều nào sau đây sai khi nói về tính chất của hợp chất cộng hoá trị?
-
A.
Các hợp chất cộng hoá trị có nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn các hợp chất ion.
-
B.
Các hợp chất cộng hoá trị có thể ở thể rắn, lỏng hoặc khí trong điều kiện thường.
-
C.
Các hợp chất cộng hoá trị đều dẫn điện tốt.
-
D.
Các hợp chất cộng hoá trị không phân cực tan được trong dung môi không phân cực.
Đáp án : C
Dựa vào tính chất của liên kết cộng hóa trị
Các hợp chất hóa trị thường không dẫn điện
Đáp án C
Cho độ âm điện của các nguyên tố như sau: O=3,44; Cl=3,16; Mg=1,31; C=2,55; H=2,2. Trong các phân tử MgO, CO 2 , CH 4 , Cl 2 O, số phân tử có kiểu liên kết cộng hóa trị phân cực là:
-
A.
2.
-
B.
3.
-
C.
1.
-
D.
4.
Đáp án : C
Dựa vào denta Khi của các nguyên tử nguyên tố
CO 2 là phân tử có liên kết cộng hóa trị phân cực => Đáp án C