Đề thi học kì 1 Hóa 11 Kết nối tri thức - Đề số 7
Phương trình phân li nào dưới đây viết sai?
Đề bài
Phương trình phân li nào dưới đây viết sai ?
-
A.
K 2 CO 3 ⟶ 2K + + CO 3 2- .
-
B.
HCN ⟶ H + + CN - .
-
C.
Al(OH) 3 ⟶ Al 3+ + 3OH - .
-
D.
FeCl 2 ⟶ Fe 2+ + 2Cl - .
Chất nào sau đây là chất điện li yếu?
-
A.
Ba(OH) 2 .
-
B.
H 2 SO 4 .
-
C.
H 2 O.
-
D.
Al 2 (SO 4 ) 3 .
Phản ứng hóa học nào dưới đây không dịch chuyển cân bằng khi thay đổi áp suất chung của hệ?
-
A.
2SO 2 (g) + O 2 (g) ⇌ 2SO 3 (g).
-
B.
CO(g) + H 2 O(g) ⇌ H 2 (g) + CO 2 (g).
-
C.
PCl 5 (g) ⇌ PCl 3 (g) + Cl 2 (g).
-
D.
2CO(g) + O 2 (g) ⇌ 2CO 2 (g)
Cho các nhận định sau:
(a) Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
(b) ở trạng thái cân bằng, các chất không phản ứng với nhau.
(c) Ở trạng thái cân bằng, nồng đọc ác chất sản phẩm luôn lớn hơn nồng độ các chất tham gia.
(d) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Các nhận định đúng là:
-
A.
(a) và (b).
-
B.
(b) và (c).
-
C.
(a) và (c).
-
D.
(a) và (d).
Trộn 300 mL dung dịch có pH = 2 gồm HCl và HNO 3 vào 200 mL dung dịch NaOH nồng độ a (M) thu được 500 mL dung dịch có pH = 11. Giá trị của a gần nhất với
-
A.
0,01.
-
B.
0,02.
-
C.
0,03.
-
D.
0,04.
Khi trộn những thể tích bằng nhau của dung dịch HNO 3 0,01 M và dung dịch NaOH 0,03 M thì thu được dung dịch có giá trị pH bằng
-
A.
9.
-
B.
12,30.
-
C.
13.
-
D.
12.
Hỗn hợp X gồm Fe và Cu. Hòa tan hoàn toàn 15,2 gam X bằng dung dịch HNO 3 loãng dư, sau phản ứng thu được 4,958(L) NO (ở đkc, sản phẩm khử duy nhất). Khối lượng muối khan thu được có giá trị gần nhất với
-
A.
50.
-
B.
52.
-
C.
55.
-
D.
58.
Cho 40,8 gam hh Fe, FeO, Fe 3 O 4 tác dụng với HNO 3 (dư) trong dung dịch, thu được V lít khí NO (sản phẩm khử duy nhất, đkc) và dung dịch X. Dung dịch X phản ứng với lượng dư dung dịch NaOH thu được 64,2 gam kết tủa. Giá trị của V là
-
A.
9,916.
-
B.
7,437.
-
C.
12,395.
-
D.
3,7185.
Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một chất khí. Chất khí đó là
-
A.
NH 3 .
-
B.
H 2 .
-
C.
NO 2
-
D.
NO.
Dãy chất nào vừa tác dụng với dung dịch H 2 SO 4 loãng vừa tác dụng với dung dịch H 2 SO 4 đặc nóng?
-
A.
Ag, FeO, MgCO 3.
-
B.
Cu, Fe, MgCl 2.
-
C.
Al, FeO, MgSO 3 .
-
D.
Ag, FeO, MgSO 3 .
Hỗn hợp X gồm: 5,6 gam iron và 2,4 gam sulfur. Nung X trong điều kiện không có không khí, sau phản ứng thu được hỗn hợp chất rắn Y. Hòa tan hoàn toàn Y bằng dung dịch H 2 SO 4 loãng dư thu được hỗn hợp khí Z. Xác định tỉ khối của Z so với hydrogen. Biết các phản ứng xảy ra hoàn toàn.
-
A.
d Z/H2 = 13.
-
B.
d Z/H2 = 1,3.
-
C.
d Z/H2 = 17,3.
-
D.
d Z/H2 = 52.
Nung nóng hỗn hợp gồm 3,6 gam Mg và 3,83 gam S trong điều kiện không có không khí, thu được chất rắn X. Cho chất rắn X tác dụng với dung dịch HCl dư, sau phản ứng xảy ra hoàn toàn thu được hỗn hợp khí Y. Tỉ khối của Y so với khí hydrogen là
-
A.
16,2.
-
B.
15,8.
-
C.
11,2.
-
D.
13,8.
Nguyên nhân nào dưới đây không phải là nguồn gốc sinh ra các oxide của nitrogen?
-
A.
Cháy rừng.
-
B.
Khí thải xe cộ.
-
C.
Mưa giông.
-
D.
Quá trình quang hợp.
Phương pháp tách chất bằng cách làm bay hơi một chất lỏng và sau đó ngưng tụ hơi bằng cách làm lạnh nó được gọi là
-
A.
gạn.
-
B.
chưng cất.
-
C.
sắc kí.
-
D.
chiết
Tinh dầu giúp loại bỏ tế bào chết trên da, giữ và làm cho da mượt mà, mềm mại kích thích làm tiêu mỡ thừa dưới da, giúp da săn chắc ngăn ngừa mụn chứng cá. Tinh dầu hiện nay thường được tách chiết từ các loại thảo mộc theo quy trình dưới đây:
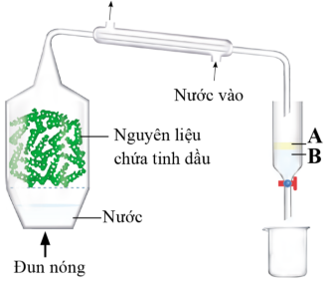
Phương pháp được sử dụng trong quá trình tách, chiết tinh dầu là
-
A.
Phương pháp chưng cất phân đoạn.
-
B.
Phương pháp chiết.
-
C.
Phương pháp chưng cất lôi cuốn hơi nước.
-
D.
Phương pháp kết tinh.
Chất X có công thức phân tử là C 5 H 10 O và có phổ hồng ngoại như sau:
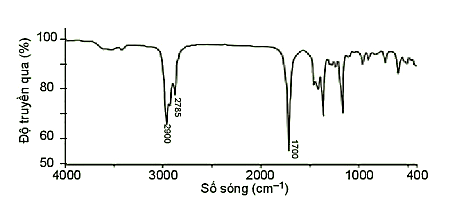
Nhóm chức có trong phân tử X là
-
A.
carboxylic acid.
-
B.
aldehyde.
-
C.
amine.
-
D.
alcohol.
Cho các cặp chất sau:
(a) CH ≡ C – CH 3 và CH 2 = C = CH 2
(b) CH 3 – CH = CH – CH 3 và CH 2 = C(CH 3 ) 2
(c) CH 3 – CH 2 – OH và CH 3 – O – CH 3
(d) CH 2 = CH 2 và CH 3 – CH = CH 2
(đ) CH 3 – CH 2 – CH 2 – OH và CH 3 – CH(OH) – CH 3
Số cặp chất là đồng phân nhóm chức của nhau là
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Dãy nào dưới đây gồm các chất thuộc cùng dãy đồng đẳng?
-
A.
CH 4 , C 2 H 4 , C 3 H 4 .
-
B.
C 2 H 2 , C 2 H 4 , C 2 H 6 .
-
C.
C 2 H 4 , C 3 H 6 , C 4 H 8 .
-
D.
CH 4 . C 2 H 4 . C 3 H 6 .
-
A.
CHN 2 .
-
B.
C 2 H 6 N 2 .
-
C.
C 2 H 5 N 2 .
-
D.
C 2 H 8 N 2 .
Aspirin là một trong những loại thuốc được sử dụng khá nhiều trong các quá trình điều trị bệnh. Đây là loại thuốc giảm đau, hạ nhiệt đồng thời có khả năng chống viêm. Một mẫu aspirin được xác định có chứa 60,00% carbon; 4,44% hydrogen và 35,56% oxygen về khối lượng. Công thức đơn giản nhất của aspirin là
-
A.
C 9 H 8 O 4 .
-
B.
C 3 H 2 O.
-
C.
C 5 H 4 O 2 .
-
D.
C 2 H 2 O.
Lời giải và đáp án
Phương trình phân li nào dưới đây viết sai ?
-
A.
K 2 CO 3 ⟶ 2K + + CO 3 2- .
-
B.
HCN ⟶ H + + CN - .
-
C.
Al(OH) 3 ⟶ Al 3+ + 3OH - .
-
D.
FeCl 2 ⟶ Fe 2+ + 2Cl - .
Đáp án : C
Cách viết phương trình điện li
Al(OH) 3 ↛ Al 3+ + 3OH - .
Chất nào sau đây là chất điện li yếu?
-
A.
Ba(OH) 2 .
-
B.
H 2 SO 4 .
-
C.
H 2 O.
-
D.
Al 2 (SO 4 ) 3 .
Đáp án : C
Dựa vào lý thuyết về sự điện li.
H 2 O là chất điện li yếu.
Phản ứng hóa học nào dưới đây không dịch chuyển cân bằng khi thay đổi áp suất chung của hệ?
-
A.
2SO 2 (g) + O 2 (g) ⇌ 2SO 3 (g).
-
B.
CO(g) + H 2 O(g) ⇌ H 2 (g) + CO 2 (g).
-
C.
PCl 5 (g) ⇌ PCl 3 (g) + Cl 2 (g).
-
D.
2CO(g) + O 2 (g) ⇌ 2CO 2 (g)
Đáp án : B
Chuyển dịch cân bằng theo nguyên lí Le Chaterlier.
Áp suất chỉnh ảnh hưởng đến những phản ứng có sự chệnh lệch số mol khí trước và sau phản ứng.
Cho các nhận định sau:
(a) Ở trạng thái cân bằng, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
(b) ở trạng thái cân bằng, các chất không phản ứng với nhau.
(c) Ở trạng thái cân bằng, nồng đọc ác chất sản phẩm luôn lớn hơn nồng độ các chất tham gia.
(d) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
Các nhận định đúng là:
-
A.
(a) và (b).
-
B.
(b) và (c).
-
C.
(a) và (c).
-
D.
(a) và (d).
Đáp án : A
Kiến thức về trạng thái cân bằng của phản ứng hóa học.
(a) đúng.
(b) sai, vì ở trạng thái cân bằng các chất vẫn phản ứng với nhau nhưng tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
(c) sai, vì nồng độ chất phụ thuộc vào lượng chất tham gia phản ứng và điều kiện nhiệt độ đang xét.
(d) đúng.
Trộn 300 mL dung dịch có pH = 2 gồm HCl và HNO 3 vào 200 mL dung dịch NaOH nồng độ a (M) thu được 500 mL dung dịch có pH = 11. Giá trị của a gần nhất với
-
A.
0,01.
-
B.
0,02.
-
C.
0,03.
-
D.
0,04.
Đáp án : B
Định luật bảo toàn nguyên tố, bảo toàn điện tích.
Dung dịch sau: pH = 11 > 7 ⟹ dung dịch sau có môi trường base ⟹ NaOH dư.
Σn OH- = n OH-pư + n OH-dư
= n H+ + n OH-dư
= 0,3.10 -2 + 0,5.10 14-11 = 3,5.10 -3 (mol)
⟹ a = C M(NaOH) = 0,0175 (M).
Khi trộn những thể tích bằng nhau của dung dịch HNO 3 0,01 M và dung dịch NaOH 0,03 M thì thu được dung dịch có giá trị pH bằng
-
A.
9.
-
B.
12,30.
-
C.
13.
-
D.
12.
Đáp án : D
Dựa vào lý thuyết về pH.
H + + OH - ⟶ H 2 O
n OH- dư = 0,03V – 0,01V = 0,02V
C OH- dư = 0,02V/2V = 0,01 M
⟹ pH = 14 + log (0,01) = 12
Hỗn hợp X gồm Fe và Cu. Hòa tan hoàn toàn 15,2 gam X bằng dung dịch HNO 3 loãng dư, sau phản ứng thu được 4,958(L) NO (ở đkc, sản phẩm khử duy nhất). Khối lượng muối khan thu được có giá trị gần nhất với
-
A.
50.
-
B.
52.
-
C.
55.
-
D.
58.
Đáp án : B
Bảo toàn khối lượng, bảo toàn electron.
BTe: n NO3-(muối) = n echo = n e nhận = 3.n NO = 0,6
BTKL: m muối = m KL + m NO3-(muối) = 15,2 + 0,6.62 = 52,4 (g)
Cho 40,8 gam hh Fe, FeO, Fe 3 O 4 tác dụng với HNO 3 (dư) trong dung dịch, thu được V lít khí NO (sản phẩm khử duy nhất, đkc) và dung dịch X. Dung dịch X phản ứng với lượng dư dung dịch NaOH thu được 64,2 gam kết tủa. Giá trị của V là
-
A.
9,916.
-
B.
7,437.
-
C.
12,395.
-
D.
3,7185.
Đáp án : B
Phương pháp tách chất, định luật bảo toàn nguyên tố, định luật bảo toàn electron.
Coi hỗn hợp đầu gồm Fe và O có khối lượng 38,4 gam.
Sơ đồ:
\(40,8(g)\left\{ {\begin{array}{*{20}{l}}{Fe:x}\\{O:y}\end{array}} \right.(mol) + HN{O_{3du}} \to \left\{ {\begin{array}{*{20}{l}}{V(L)NO(dkc)}\\{F{e^{3 + }}:x}\\{N{O_3}^ - }\\{{H^ + }}\end{array}} \right. + NaOHdu \to 64,2(g)Fe{(OH)_3}\)
m hh đầu = 56x + 16y = 40,8
BTNT(Fe): n Fe = n Fe(Fe(OH)3) ⟹ x = 0,6 (mol)
⟹ y = 0,45 (mol)
BTe: 3n Fe = 3n NO + 2.n O
⟹ n NO = 0,3 (mol) ⟹ V NO = 7,437 (L)
Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một chất khí. Chất khí đó là
-
A.
NH 3 .
-
B.
H 2 .
-
C.
NO 2
-
D.
NO.
Đáp án : A
Dựa vào lý thuyết về muối ammonium.
NH 4 + + OH - ⟶ NH 3 + H 2 O
Chất khí đó là NH 3
Dãy chất nào vừa tác dụng với dung dịch H 2 SO 4 loãng vừa tác dụng với dung dịch H 2 SO 4 đặc nóng?
-
A.
Ag, FeO, MgCO 3.
-
B.
Cu, Fe, MgCl 2.
-
C.
Al, FeO, MgSO 3 .
-
D.
Ag, FeO, MgSO 3 .
Đáp án : C
Các chất vừa phản ứng H 2 SO 4 loãng và đặc nóng là
+ Kim loại đứng trước H
+ Các oxide base, base, muối
A sai, vì Ag không phản ứng với H 2 SO 4 loãng
B sai , vì Cu không phản ứng với H 2 SO 4 ; MgCl 2 không phản ứng với cả 2
C đúng, vì
PTHH:
2Al + 3H 2 SO 4 loãng → Al 2 (SO 4 ) 3 + 3H 2 ↑
2Al + 6H 2 SO 4 đặc, nóng → Al 2 (SO 4 ) 3 + 3SO 2 + H 2 O
FeO + H 2 SO 4 loãng → FeSO 4 + H 2 O
2FeO + 4H 2 SO 4 đặc, nóng → Fe 2 (SO 4 ) 3 + SO 2 + 4H 2 O
MgSO 3 + H 2 SO 4 → MgSO 4 + SO 2 + H 2 O
D sai , vì Ag
Hỗn hợp X gồm: 5,6 gam iron và 2,4 gam sulfur. Nung X trong điều kiện không có không khí, sau phản ứng thu được hỗn hợp chất rắn Y. Hòa tan hoàn toàn Y bằng dung dịch H 2 SO 4 loãng dư thu được hỗn hợp khí Z. Xác định tỉ khối của Z so với hydrogen. Biết các phản ứng xảy ra hoàn toàn.
-
A.
d Z/H2 = 13.
-
B.
d Z/H2 = 1,3.
-
C.
d Z/H2 = 17,3.
-
D.
d Z/H2 = 52.
Đáp án : A
Tính toán dựa vào phương trình phản ứng.
n Fe = 0,1 (mol), n S = 0,075 (mol)
Fe + S ⟶ FeS
Ban đầu: 0,1 0,075
Phản ứng: 0,075 ⟵ 0,075 ⟶ 0,075
Sau: 0,025 0 0,075
⟹ Chất rắn Y: 0,075 (mol) FeS; 0,025 (mol) Fe
FeS + 2HCl ⟶ FeCl 2 + H 2 S
0,075 ⟶ 0,075
Fe + 2HCl ⟶ FeCl 2 + H 2
0,025 ⟶ 0,025
⟹ Hỗn hợp Z: 0,075 (mol) H 2 S; 0,025 (mol) H 2
\(\bar M = \frac{{\sum m }}{{\sum n }} = \frac{{0,075.34 + 0,025.2}}{{0,075 + 0,025}} = 26\)
⟹ d Z/H2 = 26/2 = 13
Nung nóng hỗn hợp gồm 3,6 gam Mg và 3,83 gam S trong điều kiện không có không khí, thu được chất rắn X. Cho chất rắn X tác dụng với dung dịch HCl dư, sau phản ứng xảy ra hoàn toàn thu được hỗn hợp khí Y. Tỉ khối của Y so với khí hydrogen là
-
A.
16,2.
-
B.
15,8.
-
C.
11,2.
-
D.
13,8.
Đáp án : D
Định luật bảo toàn electron, công thức tính tỉ khối hỗn hợp chất khí.
Sơ đồ:
\(\left. {\begin{array}{*{20}{l}}{Mg:0,15mol}\\{S:0,12mol}\end{array}} \right\} + HCl \to \left\{ {\begin{array}{*{20}{l}}{M{g^{2 + }}:0,15mol}\\{{S^{2 - }}:0,12mol}\\{{H_2}}\end{array}} \right.\)
BTe: 2.n Mg = 2.n S + 2.n H2 ⟹ n H2 = 0,03 (mol)
Trong hỗn hợp Y gồm: 0,12 (mol) H 2 S; 0,03 (mol) H 2
⟹ \(\bar M = \frac{{0,12.34 + 0,03.2}}{{0,12 + 0,03}} = 27,6\)
d Y/H2 = 27,6/2 = 13,8
Nguyên nhân nào dưới đây không phải là nguồn gốc sinh ra các oxide của nitrogen?
-
A.
Cháy rừng.
-
B.
Khí thải xe cộ.
-
C.
Mưa giông.
-
D.
Quá trình quang hợp.
Đáp án : D
Lý thuyết về các hợp chất của nitrogen với oxygen.
Quá trình quang hợp không sinh ra oxide của nitrogen.
Phương pháp tách chất bằng cách làm bay hơi một chất lỏng và sau đó ngưng tụ hơi bằng cách làm lạnh nó được gọi là
-
A.
gạn.
-
B.
chưng cất.
-
C.
sắc kí.
-
D.
chiết
Đáp án : B
Lý thuyết về phương pháp chưng cất.
Phương pháp chưng cất làm bay hơi một chất lỏng sau đó ngưng tụ hơi bằng cách làm lạnh nó.
Tinh dầu giúp loại bỏ tế bào chết trên da, giữ và làm cho da mượt mà, mềm mại kích thích làm tiêu mỡ thừa dưới da, giúp da săn chắc ngăn ngừa mụn chứng cá. Tinh dầu hiện nay thường được tách chiết từ các loại thảo mộc theo quy trình dưới đây:

Phương pháp được sử dụng trong quá trình tách, chiết tinh dầu là
-
A.
Phương pháp chưng cất phân đoạn.
-
B.
Phương pháp chiết.
-
C.
Phương pháp chưng cất lôi cuốn hơi nước.
-
D.
Phương pháp kết tinh.
Đáp án : C
Ứng dụng của phương pháp chưng cất lôi cuốn hơi nước.
Phương pháp chưng cuốn hơi nước được sử dụng trong quá trình tách, chiết tinh dầu.
Chất X có công thức phân tử là C 5 H 10 O và có phổ hồng ngoại như sau:

Nhóm chức có trong phân tử X là
-
A.
carboxylic acid.
-
B.
aldehyde.
-
C.
amine.
-
D.
alcohol.
Đáp án : B
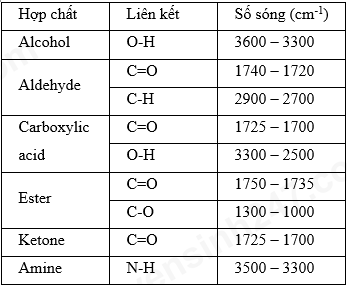
- Số sóng 1700 cm -1 là tín hiệu đặc trưng của liên kết C = O.
- Số sóng 2900 – 2785 cm -1 là tín hiệu đặc trưng của liên kết C – H trong nhóm – CHO.
⟹ Nhóm chức có trong phân tử X là – CHO (aldehyle).
Cho các cặp chất sau:
(a) CH ≡ C – CH 3 và CH 2 = C = CH 2
(b) CH 3 – CH = CH – CH 3 và CH 2 = C(CH 3 ) 2
(c) CH 3 – CH 2 – OH và CH 3 – O – CH 3
(d) CH 2 = CH 2 và CH 3 – CH = CH 2
(đ) CH 3 – CH 2 – CH 2 – OH và CH 3 – CH(OH) – CH 3
Số cặp chất là đồng phân nhóm chức của nhau là
-
A.
1.
-
B.
2.
-
C.
3.
-
D.
4.
Đáp án : B
Đồng phân là những hợp chất có cùng công thức phân tử.
Các hợp chất là đồng phân nhóm chức của nhau là: (a), (c)
⟹ Có 2 cặp chất.
Dãy nào dưới đây gồm các chất thuộc cùng dãy đồng đẳng?
-
A.
CH 4 , C 2 H 4 , C 3 H 4 .
-
B.
C 2 H 2 , C 2 H 4 , C 2 H 6 .
-
C.
C 2 H 4 , C 3 H 6 , C 4 H 8 .
-
D.
CH 4 . C 2 H 4 . C 3 H 6 .
Đáp án : C
Các chất thuộc cùng một dãy đồng đẳng là những hợp chất hữu cơ có cấu tạo tương tự nhau và hơn kém nhau một hay nhiều nhóm CH 2 .
Dãy gồm các chất thuộc cùng một dãy đồng đẳng là: C 2 H 4 , C 3 H 6 , C 4 H 8 .
-
A.
CHN 2 .
-
B.
C 2 H 6 N 2 .
-
C.
C 2 H 5 N 2 .
-
D.
C 2 H 8 N 2 .
Đáp án : D
Xác định công thức phân tử từ công thức cấu tạo rút gọn.
Công thức phân tử là C 2 H 8 N 2 .
Aspirin là một trong những loại thuốc được sử dụng khá nhiều trong các quá trình điều trị bệnh. Đây là loại thuốc giảm đau, hạ nhiệt đồng thời có khả năng chống viêm. Một mẫu aspirin được xác định có chứa 60,00% carbon; 4,44% hydrogen và 35,56% oxygen về khối lượng. Công thức đơn giản nhất của aspirin là
-
A.
C 9 H 8 O 4 .
-
B.
C 3 H 2 O.
-
C.
C 5 H 4 O 2 .
-
D.
C 2 H 2 O.
Đáp án : A
C : H : O = \(\frac{{\% {\rm{C}}}}{{{\rm{12}}}}:\frac{{\% {\rm{H}}}}{{\rm{1}}}:\frac{{\% {\rm{O}}}}{{{\rm{16}}}}\)
C : H : O = \(\frac{{\% {\rm{C}}}}{{{\rm{12}}}}:\frac{{\% {\rm{H}}}}{{\rm{1}}}:\frac{{\% {\rm{O}}}}{{{\rm{16}}}} = \frac{{{\rm{60}}}}{{{\rm{12}}}}:\frac{{{\rm{4}},{\rm{44}}}}{{\rm{1}}}:\frac{{{\rm{35}},{\rm{56}}}}{{{\rm{16}}}} = 5:4,44:2,2225 = 9:8:4\)
CTĐGN: C 9 H 8 O 4.
