Lý thuyết Ammonia - muối ammonium - Hóa học 11 - Kết nối tri thức
Được cấu tạo bởi một nguyên tử nitrogen liên kết với ba nguyên tử hydrogen và có dạng hình học là chóp tam giác.
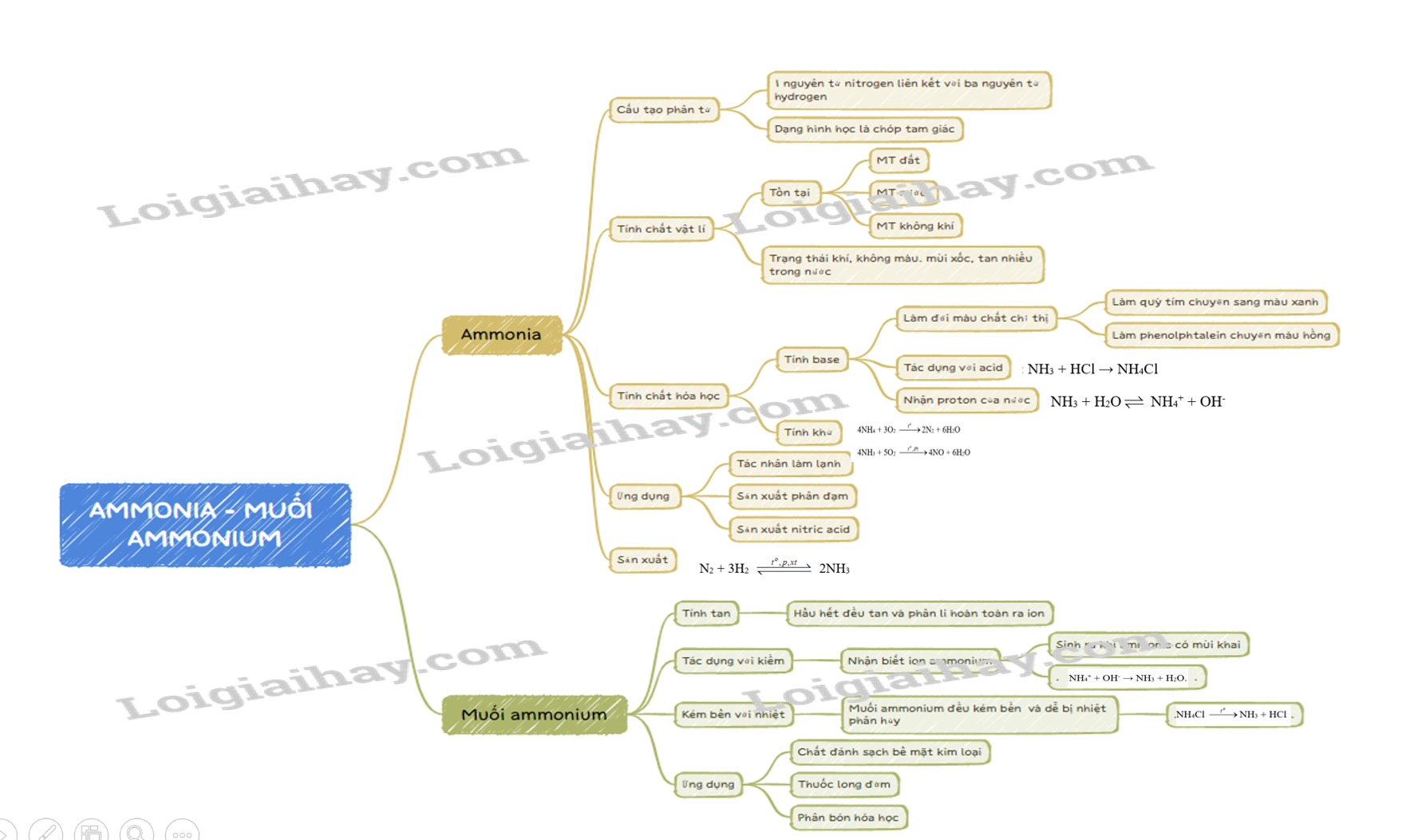
AMMONIA – MUỐI AMMONIUM
I. Ammonia
1. Cấu tạo phân tử
- Được cấu tạo bởi một nguyên tử nitrogen liên kết với ba nguyên tử hydrogen và có dạng hình học là chóp tam giác.
2. Tính chất vật lí
- Ammonia tồn tại ở cả trong môi trường đất, nước, không khí.
- Ở điều kiện thường, ammonia tồn tại ở thể khí, không màu, nhẹ hơn không khí, mùi khai và xốc, tan nhiều trong nước.
3. Tính chất hóa học
a, Tính base
- Trong dung dịch, nhận proton của nước: NH 3 + H 2 O NH 4 + + OH -
- Có môi trường base yếu:
+ Làm quỳ tím chuyển màu xanh.
+ Làm phenolphtalein chuyển màu hồng.
- Thể hiện tính chất của một base: NH 3 + HCl → NH 4 Cl
b, Tính khử
4NH 4 + 3O 2 --> 2N 2 + 6H 2 O
4NH 3 + 5O 2 --> 4NO + 6H 2 O
4. Ứng dụng
- Tác nhận làm lạnh.
- Dung môi.
- Sản xuất nitric acid.
- Sản xuất phân đạm.
5. Sản xuất
N 2 + 3H 2 --> 2NH 3
( nhiệt độ 400-450 o C, áp suất 150-200 bar, xúc tác Fe)
II. Muối ammonium
1. Tính tan, sự điện li
- Hầu hết các muối ammonium đều dễ tan trong nước và phân li hoàn toàn ra ion.
VD: NH 4 Cl → NH 4 + + Cl -
2. Tác dụng với kiềm – Nhận biết ion ammonuim
- Đun nóng hỗn hợp muối ammonium với dung dịch kiềm, sinh ra khí ammonia có mùi khai.
VD: NH 4 Cl + NaOH → NH 3 + NaCl + H 2 O
Phương trình ion rút gọn: NH 4 + + OH - → NH 3 + H 2 O.
3. Tính chất kém bền nhiệt
- Các muối ammonuin đều kém bền nhiệt và dễ bị phân hủy khi đun nóng.
VD: NH 4 Cl --> NH 3 + HCl
4. Ứng dụng
- Chất đánh sạch bề mặt kim loại.
- Thuốc long đờm.
- Phân bón hóa học.
- Chất phụ gia thực phẩm.
- Thuốc bổ sung chất điện giải.
SƠ ĐỒ TƯ DUY