Lý thuyết Hợp chất carbonyl - Hóa học 11 - Cánh diều
Khái niệm và danh pháp-Tính chất vật lý-Tính chất hóa học-Ứng dụng và điều chế
Bài 18:
HỢP CHẤT CARBONYL
I.Khái niệm và danh pháp
1.Khái niệm
-Nhóm
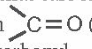 trong phân tử hợp chất hữu cơ được gọi là nhóm carbonyl.
trong phân tử hợp chất hữu cơ được gọi là nhóm carbonyl.
-Aldehyde, ketone thuộc loại hợp chất carbonyl.
-Aldehyde là hợp chất hữu cơ trong phân tử có nhóm –CHO liên kết trực tiếp với nguyên tử carbon hoặc nguyên tử hydrogen.
-Ketone là hợp chất hữu cơ có nhóm carbonyl liên kết với hai gốc hydrocarbon.
2.Danh pháp
a)Tên thay thế
-Tên aldehyde = Tên hydrocarbon (bỏ e) + al
-Tên ketone = Tên hydrocarbon (bỏ e)-vị trí nhóm carbonyl-one
b)Tên thông thường
-Tên thông thường của aldehyde: các aldehyde mà acid tương ứng của chúng có tên thông thường thì có thể được gọi tên thông thường bằng cách thay “…ic acid” bằng “…ic aldehyde” hoặc “…aldehyde”.
-Tên thông thường của ketone: một số ketone có tên thông thường.
II.Tính chất vật lý
-Nhiệt độ sôi cao hơn hydrocarbon nhưng thấp hơn alcohol có phân tử khối tương đương.
-Tính tan: mạch ngắn tan tốt, mạch dài không tan hoặc ít tan.
III.Tính chất hóa học
1.Phản ứng khử hợp chất carbonyl
- Với chất khử là LiAlH 4 hoặc NaBH 4 thì
+ Aldehyde bị khử tạo thành alcohol bậc 1
+ Ketone bị khử tạo thành alcohol bậc 2
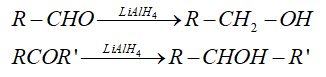
2.Phản ứng oxi hóa aldehyde
a)Phản ứng với nước bromie
- Khi tác dụng với nước bromine, aldehyde bị oxi hóa tạo thành acid.
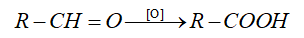
b)Phản ứng với thuốc thử Tollens
-Thuốc thử Tollens là dung dịch AgNO 3 trong NH 3 dư:
AgNO 3 + 3NH 3 + H 2 O → [Ag(NH 3 ) 2 ]OH + NH 4 NO 3
-Phản ứng tổng quát giữa thuốc thử Tollens với aldehyde sau:
R-CH=O + 2[Ag(NH 3 ) 2 ]OH → R-COONH 4 + 2Ag + 3NH 3 + H 2 O
c) Phản ứng với Cu(OH) 2
-Trong môi trường kiềm, Cu(OH) 2 oxi hóa hầu hết các aldehyde thành muối carboxylate và sinh ra kết tủa Cu 2 O có màu đỏ gạch.
-Ketone không có phản ứng với thuốc thử Tollens hoặc với Cu(OH) 2 (trong môi trường kiềm) => có thể dung thuốc thử Tollens hoặc Cu(OH) 2 để phan biệt aldehyde hoặc ketone.
3.Phản ứng với hydrogen cyanide : tạo sản phẩm cyanohydrin (hydroxynitrile)
CH 3 -CH=O + H-C≡C → CH 3 -CH(OH)-CN
CH 3 -CO-CH 3 + H-C≡C → (CH 3 ) 2 C(OH)-CN
4. Phản ứng tạo iodoform
-Các aldehyde, ketone có nhóm methyl cạnh nhóm carbonyl (CH 3 CO-) tham gia được phản ứng iodoform.
CH 3 -CH=O + I 2 + 4NaOH → CHI 3 +H-COONa + 3NaI + 3H 2 O
CH 3 -CO-CH 3 + 3I 2 + 4NaOH → CHI 3 + CH 3 COONa + 3NaI + 3H 2 O
IV.Ứng dụng và điều chế
1.Ứng dụng
-Formaldehyde dùng làm dung môi, sản xuất nhựa,…
-Acetaldehyde dùng làm nguyên liệu.
-Acetone làm dung môi, nguyên liệu.
2.Điều chế
a)Điều chế acetaldehyde
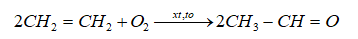
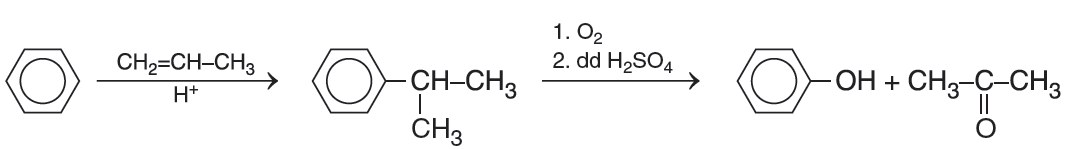
b) Điều chế acetone:
Sơ đồ tư duy về Hợp chất carbonyl