Lý thuyết Sự điện li trong dung dịch nước, thuyết Bronsted - Lowry về acid - base - Hóa học 11 - Cánh diều
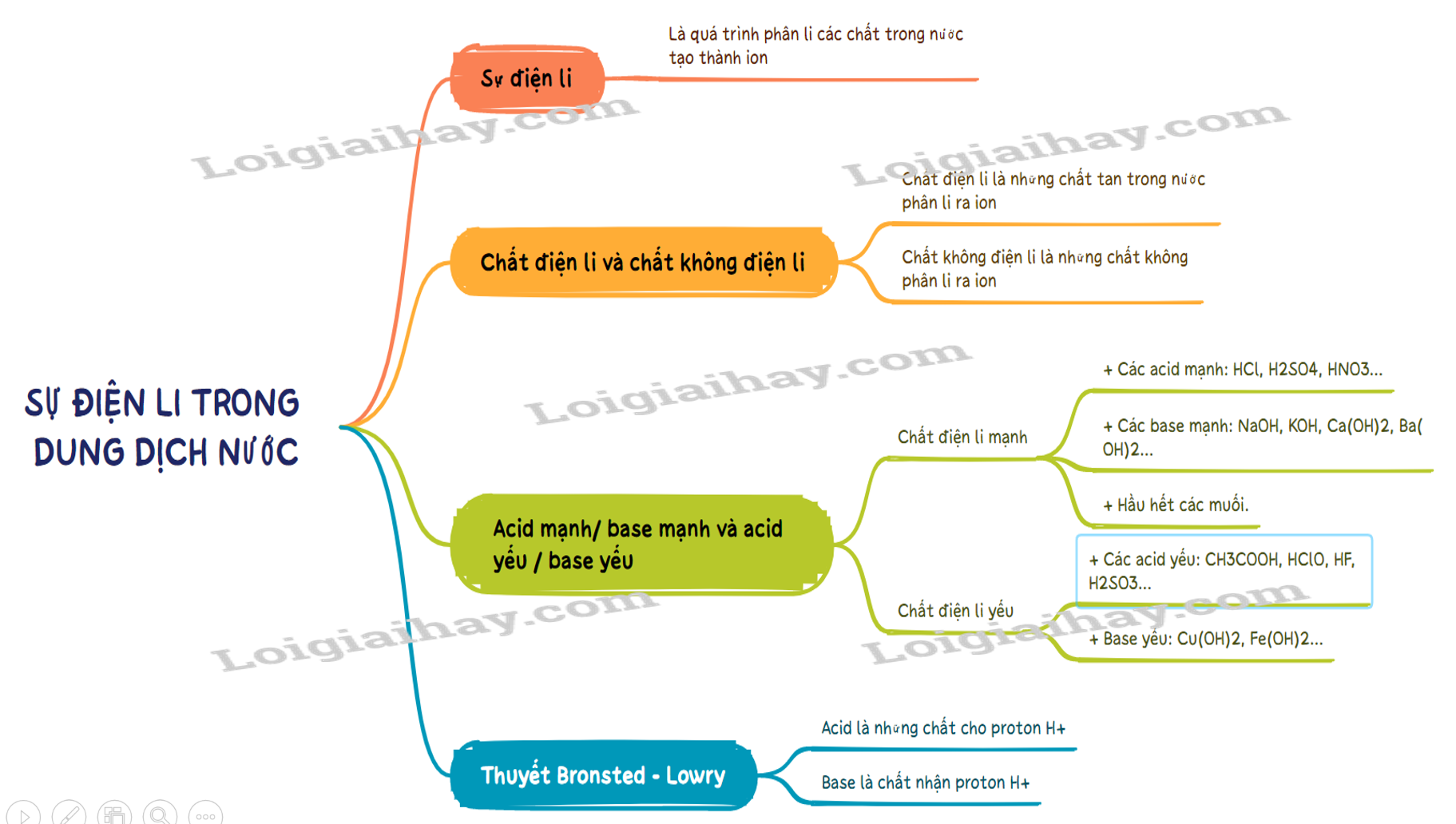
- Sự điện li là quá trình phân li các chất trong nước tạo thành ion.
I. Sự điện li, chất điện li và chất không điện li
1. Sự điện li
- Sự điện li là quá trình phân li các chất trong nước tạo thành ion.
2. Chất điện li và chất không điện li
- Chất điện li là những chất khi tan trong nước phân li ra các ion
- Chất điện li là những chất tan trong nước phân li ra các ion. VD: hydrochloric acid, sodium hydroxide, ..
- Chất không điện li là chất không phân li ra các ion. VD: saccarose, ethanol….
II. Thuyết Bronsted – Lowry về acid – base
1. Thuyết Bronsted – Lowry về acid – base
a. Khái niệm acid – base theo thuyết Bronsted – Lowry.
- Acid là chất cho proton (H + ).
- Base là chất nhận proton (H + ).
b. Ưu điểm của thuyết Bronsted – Lowry.
Tổng quát hơn thuyết Arhenius. (Phân tử không có nhóm –OH như NH 3 hay CO 3 - cũng là base).
2. Acid mạnh / base mạnh và acid yếu / base yếu
- Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion. Thường gặp là:
+ Các acid mạnh: HCl, H 2 SO 4 , HNO 3 …
+ Các base mạnh: NaOH, KOH, Ca(OH) 2 , Ba(OH) 2 …
+ Hầu hết các muối.
Phản ứng: Một chiều. Biểu diễn: Mũi tên một chiều (→).
VD: HNO 3 → H + + NO 3 - .
- Chất điện li yếu là chất khi tan trong nước chỉ có một phần phân tử chất tan phân li ra ion. Thường gặp là:
+ Các acid yếu: CH 3 COOH, HClO, HF, H 2 SO 3 …
+ Base yếu: Cu(OH) 2 , Fe(OH) 2 …
Phản ứng: Thuận nghịch.
Biểu diễn: Hai nửa mũi tên ngược nhau (⇆)
VD: CH 3 COOH ⇆ CH 3 COO - + H + .
SƠ ĐỒ TƯ DUY