Đề thi giữa kì 1 KHTN 8 Cánh diều - Đề số 9
Cho các phát biểu sau: (1) Không sử dụng hoá chất đựng trong đồ
Đề bài
Cho các phát biểu sau:
(1) Không sử dụng hoá chất đựng trong đồ chứa không có nhãn hoặc nhãn mờ, mất chữ.
(2) Trước khi sử dụng cần đọc cẩn nhận nhãn hoá chất và cần tìm hiểu kĩ các tính chất chất, các lưu ý, cảnh báo của mỗi loại hoá chất để thực hiện thí nghiệm an toàn.
(3) Thực hiện thí nghiệm cẩn thận, không dùng tay trực tiếp lấy hoá chất.
(4) Khi bị hoá chất dính vào người hoặc hoá chất bị đổ, tràn ra ngoài cần báo cáo với nhóm trưởng để được hướng dẫn xử lí.
(5) Các hoá chất dùng xong còn thừa nên đổ trở lại bình chứa đúng với hoá chất đó để tiết kiệm.
Số phát biểu đúng khi nói về quy tắc sử dụng hoá chất an toàn trong phòng thí nghiệm:
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Khi có hỏa hoạn trong phòng thực hành cần xử lí theo cách nào sau đây:
-
A.
Bình tĩnh, sử dụng các biện pháp dập tắt ngọn lửa theo hướng dẫn của phòng thực hành như ngắt toàn bộ hệ thống điện, đưa toàn bộ các hóa chất, các chất dễ cháy ra khu vực an toàn…
-
B.
Sử dụng nước để dập đám cháy nơi có các thiết bị điện.
-
C.
Sử dụng bình O 2 để dập đám cháy quần áo trên người.
-
D.
Không cần ngắt hệ thống điện, phải dập đám cháy trước.
-
A.
Ống nghiệm.
-
B.
Ống hút nhỏ giọt.
-
C.
Bình nón.
-
D.
Phễu lọc.
Dùng nước mưa đun sôi rồi để nguội làm nước uống, lâu ngày thấy trong ấm có những cặn trắng. Biết rằng trong nước mưa có chứa nhiều muối Calcium hydrocarbonate. Muối này dễ bị nhiệt phân hủy sinh ra Calcium carbonate (là chất kết tủa trắng), khí carbon dioxide và nước. Hãy cho biết dấu hiệu có phản ứng xảy ra khi đun nước sôi rồi để nguội.
-
A.
tạo thành chất kết tủa trắng Calcium carbonate.
-
B.
tạo thành nước.
-
C.
tạo khí carbon dioxide.
-
D.
tạo thành cặn trắng.
Trong 3 mol phân tử H 2 S chứa số phân tử là
-
A.
18,066.10 23 .
-
B.
18.10 23 .
-
C.
18,66.10 23 .
-
D.
18, 6.10 23 .
Khối lượng của 0,15 mol Aluminium (Al) là
-
A.
4,05 gam.
-
B.
4 gam.
-
C.
4,5 gam.
-
D.
4,15 gam.
Thể tích của hỗn hợp khí gồm 0,15 mol O 2 , 0,25 mol H 2 và 0,3 mol N 2 ở điều kiện tiêu chuẩn là
-
A.
17,353 L.
-
B.
15,68 L
-
C.
6,72 L.
-
D.
16,4 L.
Biết tỉ khối của khí B với khí oxygen là 0,5 và tỉ khối của khí A đối với khí B là 2,125. Xác định khối lượng mol của khí A?
-
A.
34 g/mol.
-
B.
14 g/mol.
-
C.
24 g/mol.
-
D.
44 g/mol.
Nồng độ mol của dung dịch là
-
A.
số mol chất tan có trong 1 lít dung dịch.
-
B.
số gam chất tan có trong 1 lít dung dịch.
-
C.
số mol chất tan trong 1 lít dung môi.
-
D.
số mol chất tan trong 1 lít dung dịch.
Hoà tan 15 gam sodium chloride (NaCl) vào 80 gam nước, nồng độ phần trăm của dung dịch thu được là
-
A.
15,8%.
-
B.
15, 2%
-
C.
15,4%.
-
D.
15,6%.
Trộn 4 lít dung dịch KCl 2M với 2 lít dung dịch KCl 5M. Tính nồng độ mol của dung dịch KCl sau khi trộn?
-
A.
3M.
-
B.
1M .
-
C.
2M.
-
D.
4M.
Cho 150 ml dung dịch H 2 SO 4 22,44% (D = 1,31 g/ml). Tính số mol của H 2 SO 4 có trong dung dịch?
-
A.
0,45 mol.
-
B.
4,5 mol .
-
C.
0,045 mol.
-
D.
0,4 mol.
Lập phương trình hóa học của kim loại iron tác dụng với dung dịch sulfuric acid biết sản phẩm là iron (II) sulfate và có khí hydrogen bay lên
-
A.
Fe + H 2 SO 4 → FeSO 4 + H 2
-
B.
Fe + H 2 SO 4 → Fe 2 SO 4 + H 2
-
C.
Fe + H 2 SO 4 → FeSO 4 + S 2
-
D.
Fe + H 2 SO 4 → FeSO 4 + H 2 S
Cho 2,4 gam magnessium (Mg) cháy trong không khí thu được 4 gam Magnessium oxide (MgO). Tính khối lượng khí oxygen đã phản ứng?
-
A.
1,6 gam.
-
B.
1,5 gam.
-
C.
1,8 gam.
-
D.
2 gam.
Cho Iron (Fe) tác dụng với 100,5 gam dung dịch hydrochloric acid (HCl) tạo ra 12,7 gam iron (II) chloride (FeCl 2 ) và 0,2 gam khí hydrogen (H 2 ).Tính khối lượng của iron đã tham gia phản ứng?
-
A.
5,6 gam.
-
B.
5,5 gam.
-
C.
5,7 gam.
-
D.
5,8 gam.
Cho luồng khí H 2 dư đi qua ống thủy tinh chứa 20 gam bột CuO ở nhiệt độ cao theo phương trình phản ứng như sau: CuO + H 2 \( \to \) Cu + H 2 O. Sau phản ứng thu được 12 gam Cu. Hiệu suất của phản ứng là:
-
A.
75%.
-
B.
85%.
-
C.
90%.
-
D.
95%.
Điền từ, cụm từ thích hợp hoàn thiện khái niệm về chất xúc tác:
"Chất xúc tác là chất làm ...(1)... tốc độ phản ứng nhưng ...(2)... trong quá trình phản ứng"
-
A.
(1) tăng, (2) không bị tiêu hao.
-
B.
(1) thay đổi, (2) không bị tiêu hao.
-
C.
(1) tăng, (2) không bị thay đổi.
-
D.
(1) thay, (2) bị tiêu hao không nhiều.
Đồ thị hình 1 biểu thị sự phụ thuộc của độ tan (S) của các chất (a), (b), (c) và (d) theo nhiệt độ (t°C). Ở 30°C, chất có độ tan nhỏ nhất là:
-
A.
(b).
-
B.
(a).
-
C.
(c).
-
D.
(d).
Phản ứng nào sau đây là phản ứng toả nhiệt
-
A.
phản ứng đốt cháy gas.
-
B.
phản ứng nung đá vôi CaCO 3 .
-
C.
phản ứng hoà tan viên C sủi vào nước.
-
D.
phản ứng phân huỷ đường.
Các hiện tượng sau đây, hiện tượng nào có biến đổi vật lí
1. Hoà tan muối ăn vào nước ta được dung dịch muối ăn.
2. Nước bị bốc hơi khi trời nắng.
3. Cồn để trong lọ không kín bị bay hơi.
4. Nước bị đóng băng hai cực Trái đất.
5. Cho vôi sống CaO hoà tan vào nước.
-
A.
1, 2, 3, 4.
-
B.
1, 2, 4.
-
C.
2, 3, 4.
-
D.
1, 4, 5.
Tính nồng độ mol của 350 ml dung dịch chứa 74,2 gam sodium carbonate (Na 2 CO 3 ) là
-
A.
2 M.
-
B.
4 M.
-
C.
1 M.
-
D.
3M.
Hòa tan 40 gam đường với nước, thu được dung dịch nước đường có nồng độ 20%. Khối lượng dung dịch nước đường thu được là:
-
A.
150 gam.
-
B.
170 gam.
-
C.
200 gam.
-
D.
250 gam.
Quá trình nào sau đây chỉ xảy ra biến đổi vật lí?
-
A.
Đốt cháy củi trong bếp.
-
B.
Thắp sáng bóng đèn dây tóc.
-
C.
Đốt sợi dây đổng trên lửa đèn cồn.
-
D.
Để sợi dây thép ngoài không khí ẩm bị gỉ.
Lời giải và đáp án
Cho các phát biểu sau:
(1) Không sử dụng hoá chất đựng trong đồ chứa không có nhãn hoặc nhãn mờ, mất chữ.
(2) Trước khi sử dụng cần đọc cẩn nhận nhãn hoá chất và cần tìm hiểu kĩ các tính chất chất, các lưu ý, cảnh báo của mỗi loại hoá chất để thực hiện thí nghiệm an toàn.
(3) Thực hiện thí nghiệm cẩn thận, không dùng tay trực tiếp lấy hoá chất.
(4) Khi bị hoá chất dính vào người hoặc hoá chất bị đổ, tràn ra ngoài cần báo cáo với nhóm trưởng để được hướng dẫn xử lí.
(5) Các hoá chất dùng xong còn thừa nên đổ trở lại bình chứa đúng với hoá chất đó để tiết kiệm.
Số phát biểu đúng khi nói về quy tắc sử dụng hoá chất an toàn trong phòng thí nghiệm:
-
A.
2
-
B.
3
-
C.
4
-
D.
5
Đáp án : C
Dựa vào an toàn trong phòng thực hành.
(1), (2), (3), (4) là các bước an toàn trong phòng thực hành.
Đáp án C
Khi có hỏa hoạn trong phòng thực hành cần xử lí theo cách nào sau đây:
-
A.
Bình tĩnh, sử dụng các biện pháp dập tắt ngọn lửa theo hướng dẫn của phòng thực hành như ngắt toàn bộ hệ thống điện, đưa toàn bộ các hóa chất, các chất dễ cháy ra khu vực an toàn…
-
B.
Sử dụng nước để dập đám cháy nơi có các thiết bị điện.
-
C.
Sử dụng bình O 2 để dập đám cháy quần áo trên người.
-
D.
Không cần ngắt hệ thống điện, phải dập đám cháy trước.
Đáp án : A
Dựa vào quy tắc phòng cháy chữa cháy.
Khi có hỏa hoạn trong phòng thực hành cần bình tĩnh, sử dụng các biện pháp dập tắt ngọn lửa theo hướng dẫn của phòng thực hành như ngắt toàn bộ hệ thống điện, đưa toàn bộ các hóa chất, các chất dễ cháy ra khu vực an toàn…
Đáp án A
-
A.
Ống nghiệm.
-
B.
Ống hút nhỏ giọt.
-
C.
Bình nón.
-
D.
Phễu lọc.
Đáp án : B
Dựa vào các dụng cụ trong phòng thực hành.
Hình ảnh trên là ống hút nhỏ giọt dùng để lấy các hóa chất lỏng.
Dùng nước mưa đun sôi rồi để nguội làm nước uống, lâu ngày thấy trong ấm có những cặn trắng. Biết rằng trong nước mưa có chứa nhiều muối Calcium hydrocarbonate. Muối này dễ bị nhiệt phân hủy sinh ra Calcium carbonate (là chất kết tủa trắng), khí carbon dioxide và nước. Hãy cho biết dấu hiệu có phản ứng xảy ra khi đun nước sôi rồi để nguội.
-
A.
tạo thành chất kết tủa trắng Calcium carbonate.
-
B.
tạo thành nước.
-
C.
tạo khí carbon dioxide.
-
D.
tạo thành cặn trắng.
Đáp án : A
Dựa vào quá trình biến đổi hóa học.
Dấu hiệu nhận biết là có chất kết tủa trắng xuất hiện.
Đáp án A
Trong 3 mol phân tử H 2 S chứa số phân tử là
-
A.
18,066.10 23 .
-
B.
18.10 23 .
-
C.
18,66.10 23 .
-
D.
18, 6.10 23 .
Đáp án : A
Dựa vào 1 mol có chứa 6,022.10 23 hạt.
3 mol phân tử H 2 S có chứa số phân tử là: 3.6,022.10 23 = 18,066.10 23
Đáp án A
Khối lượng của 0,15 mol Aluminium (Al) là
-
A.
4,05 gam.
-
B.
4 gam.
-
C.
4,5 gam.
-
D.
4,15 gam.
Đáp án : A
Dựa vào công thức tính khối lượng gam: m = n.M.
m Al = 0,15.27 = 4,05gam
Đáp án A
Thể tích của hỗn hợp khí gồm 0,15 mol O 2 , 0,25 mol H 2 và 0,3 mol N 2 ở điều kiện tiêu chuẩn là
-
A.
17,353 L.
-
B.
15,68 L
-
C.
6,72 L.
-
D.
16,4 L.
Đáp án : A
Dựa vào công thức tính thể tích ở điều kiện chuẩn: V = n.24,79 (L)
V hỗn hợp khí = V O2 + V H2 + V N2 = 0,15.24,79 + 0,25.24,79 + 0,3.24,79
= 17,353L
Đáp án A
Biết tỉ khối của khí B với khí oxygen là 0,5 và tỉ khối của khí A đối với khí B là 2,125. Xác định khối lượng mol của khí A?
-
A.
34 g/mol.
-
B.
14 g/mol.
-
C.
24 g/mol.
-
D.
44 g/mol.
Đáp án : A
Dựa vào tỉ khối của chất khí.
Vì tỉ khối của chất B với khí oxygen là 0,5 \( \to \frac{{{M_B}}}{{{M_{{O_2}}}}} = 0,5 \to {M_B} = 0,5.32 = 16\)
Vì tỉ khối của chất A đối với khí B là 2,125 \( \to \frac{{{M_A}}}{{{M_B}}} = 2,125 \to {M_A} = 2,125.16 = 34g/mol\)
Đáp án A
Nồng độ mol của dung dịch là
-
A.
số mol chất tan có trong 1 lít dung dịch.
-
B.
số gam chất tan có trong 1 lít dung dịch.
-
C.
số mol chất tan trong 1 lít dung môi.
-
D.
số mol chất tan trong 1 lít dung dịch.
Đáp án : A
Dựa vào khái niệm nồng độ mol của dung dịch.
Nồng độ mol của dung dịch là số mol chất tan có trong 1 lít dung dịch.
Đáp án A
Hoà tan 15 gam sodium chloride (NaCl) vào 80 gam nước, nồng độ phần trăm của dung dịch thu được là
-
A.
15,8%.
-
B.
15, 2%
-
C.
15,4%.
-
D.
15,6%.
Đáp án : A
Dựa vào công thức tính nồng độ phần trăm của dung dịch: C% = \(\frac{{{m_{c\tan }}}}{{{m_{{\rm{dd}}}}}}.100\)
m dung dịch = m NaCl + m H2O = 15 + 80 = 95g
C% = \(\frac{{{m_{c\tan }}}}{{{m_{{\rm{dd}}}}}}.100\)= \(\frac{{15}}{{95}}.100 = 15,8\% \)
Trộn 4 lít dung dịch KCl 2M với 2 lít dung dịch KCl 5M. Tính nồng độ mol của dung dịch KCl sau khi trộn?
-
A.
3M.
-
B.
1M .
-
C.
2M.
-
D.
4M.
Đáp án : A
Dựa vào công thức tính nồng độ mol của dung dịch: C M = \(\frac{n}{V}\)
n KCl (1) = 4.2 = 8 mol
n KCl (2) = 2.5 = 10 mol
C M = \(\frac{{8 + 10}}{{4 + 2}} = 3M\)
Đáp án A
Cho 150 ml dung dịch H 2 SO 4 22,44% (D = 1,31 g/ml). Tính số mol của H 2 SO 4 có trong dung dịch?
-
A.
0,45 mol.
-
B.
4,5 mol .
-
C.
0,045 mol.
-
D.
0,4 mol.
Đáp án : A
Dựa vào công thức tính C%.
Ta có: m dung dịch H2SO4 = D.V = 150.1,31 = 196,5g
m H2SO4 = 196,5.22,44% = 44,0946g
n H2SO4 = \(\frac{{44,0946}}{{98}} = 0,45mol\)
Đáp án A
Lập phương trình hóa học của kim loại iron tác dụng với dung dịch sulfuric acid biết sản phẩm là iron (II) sulfate và có khí hydrogen bay lên
-
A.
Fe + H 2 SO 4 → FeSO 4 + H 2
-
B.
Fe + H 2 SO 4 → Fe 2 SO 4 + H 2
-
C.
Fe + H 2 SO 4 → FeSO 4 + S 2
-
D.
Fe + H 2 SO 4 → FeSO 4 + H 2 S
Đáp án : A
Dựa vào cách lập phương trình hóa học.
Fe + H 2 SO 4 → FeSO 4 + H 2
Đáp án A
Cho 2,4 gam magnessium (Mg) cháy trong không khí thu được 4 gam Magnessium oxide (MgO). Tính khối lượng khí oxygen đã phản ứng?
-
A.
1,6 gam.
-
B.
1,5 gam.
-
C.
1,8 gam.
-
D.
2 gam.
Đáp án : A
Dựa vào số mol của Mg và MgO.
n Mg = 2,4 : 24 = 0,1 mol
n MgO = 4 : 40 = 0,1 mol
2Mg + O 2 \( \to \) 2MgO
Theo phương trình hóa học: n O2 = \(\frac{1}{2}{n_{MgO}} = 0,1.\frac{1}{2} = 0,05mol\)
m O2 = 0,05.32 = 1,6gam
Đáp án A
Cho Iron (Fe) tác dụng với 100,5 gam dung dịch hydrochloric acid (HCl) tạo ra 12,7 gam iron (II) chloride (FeCl 2 ) và 0,2 gam khí hydrogen (H 2 ).Tính khối lượng của iron đã tham gia phản ứng?
-
A.
5,6 gam.
-
B.
5,5 gam.
-
C.
5,7 gam.
-
D.
5,8 gam.
Đáp án : A
Dựa vào tính theo phương trình hóa học.
n FeCl2 = 12,7 : 127 = 0,1 mol
n H2 = 0,2 : 2 = 0,1 mol
Fe + 2HCl \( \to \) FeC l2 + H 2
Theo phương trình hóa học: n Fe = n H2 = 0,1 mol
m Fe = 0,1.56 = 5,6 gam
Đáp án A
Cho luồng khí H 2 dư đi qua ống thủy tinh chứa 20 gam bột CuO ở nhiệt độ cao theo phương trình phản ứng như sau: CuO + H 2 \( \to \) Cu + H 2 O. Sau phản ứng thu được 12 gam Cu. Hiệu suất của phản ứng là:
-
A.
75%.
-
B.
85%.
-
C.
90%.
-
D.
95%.
Đáp án : A
Dựa vào công thức tính hiệu suất của phản ứng.
n CuO = 20 : 80 = 0,25 mol
n Cu = 12 : 64 = 0,1875 mol
Theo phương trình phản ứng: n Cu = n CuO phản ứng = 0,1875 mol
H% = \(\frac{{0,1875}}{{0,25}}.100 = 75\% \)
Đáp án A
Điền từ, cụm từ thích hợp hoàn thiện khái niệm về chất xúc tác:
"Chất xúc tác là chất làm ...(1)... tốc độ phản ứng nhưng ...(2)... trong quá trình phản ứng"
-
A.
(1) tăng, (2) không bị tiêu hao.
-
B.
(1) thay đổi, (2) không bị tiêu hao.
-
C.
(1) tăng, (2) không bị thay đổi.
-
D.
(1) thay, (2) bị tiêu hao không nhiều.
Đáp án : A
Dựa vào khái niệm chất xúc tác.
Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị tiêu hao trong quá trình phản ứng.
Đáp án A
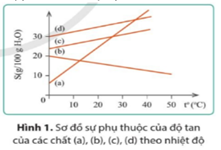
Đồ thị hình 1 biểu thị sự phụ thuộc của độ tan (S) của các chất (a), (b), (c) và (d) theo nhiệt độ (t°C). Ở 30°C, chất có độ tan nhỏ nhất là:

-
A.
(b).
-
B.
(a).
-
C.
(c).
-
D.
(d).
Đáp án : A
Dựa vào sơ đồ phụ thuộc của chất tan theo nhiệt độ.
Khi tăng nhiệt độ, độ tan của chất (b) giảm dần.
Đáp án A
Phản ứng nào sau đây là phản ứng toả nhiệt
-
A.
phản ứng đốt cháy gas.
-
B.
phản ứng nung đá vôi CaCO 3 .
-
C.
phản ứng hoà tan viên C sủi vào nước.
-
D.
phản ứng phân huỷ đường.
Đáp án : A
Dựa vào năng lượng của phản ứng.
Phản ứng đốt cháy gas tỏa nhiệt mạnh nên là phản ứng tỏa nhiệt.
Đáp án A
Các hiện tượng sau đây, hiện tượng nào có biến đổi vật lí
1. Hoà tan muối ăn vào nước ta được dung dịch muối ăn.
2. Nước bị bốc hơi khi trời nắng.
3. Cồn để trong lọ không kín bị bay hơi.
4. Nước bị đóng băng hai cực Trái đất.
5. Cho vôi sống CaO hoà tan vào nước.
-
A.
1, 2, 3, 4.
-
B.
1, 2, 4.
-
C.
2, 3, 4.
-
D.
1, 4, 5.
Đáp án : A
Quá trình biến đổi vật lí chỉ làm thay đổi về hình dạng, kích thước,…không có chất mới tạo thành.
1, 2, 3, 4 là hiện tượng vật lí vì không có chất mới tạo thành.
Đáp án A
Tính nồng độ mol của 350 ml dung dịch chứa 74,2 gam sodium carbonate (Na 2 CO 3 ) là
-
A.
2 M.
-
B.
4 M.
-
C.
1 M.
-
D.
3M.
Đáp án : A
Dựa vào công thức tính nồng độ mol của chất.
n Na2CO3 = 74,2 : 106 = 0,7 mol
C M = \(\frac{{0,7}}{{0,35}} = 2M\)
Đáp án A
Hòa tan 40 gam đường với nước, thu được dung dịch nước đường có nồng độ 20%. Khối lượng dung dịch nước đường thu được là:
-
A.
150 gam.
-
B.
170 gam.
-
C.
200 gam.
-
D.
250 gam.
Đáp án : C
Dựa vào công thức tính nồng độ %.
Khối lượng dung dịch nước đường thu được là: 40 : 20% = 200 gam
Đáp án C
Quá trình nào sau đây chỉ xảy ra biến đổi vật lí?
-
A.
Đốt cháy củi trong bếp.
-
B.
Thắp sáng bóng đèn dây tóc.
-
C.
Đốt sợi dây đổng trên lửa đèn cồn.
-
D.
Để sợi dây thép ngoài không khí ẩm bị gỉ.
Đáp án : B
Dựa vào khái niệm về biến đổi vật lí và biến đổi hóa học.
Quá trình thắp sáng bóng đèn dây tóc là biến đổi vật lí vì không tạo ra chất mới.
Đáp án B
a) Cân bằng PTHH:
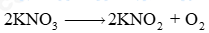
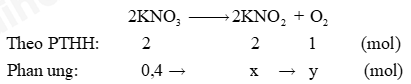
b) Số mol KNO 2 : \({\rm{x}}\,\,{\rm{ = }}\,\,\frac{{{\rm{0,4}}\,{\rm{.}}\,\,{\rm{2}}}}{{\rm{2}}}\,{\rm{ = }}\,\,{\rm{0,4}}\,\,{\rm{(mol)}}\,\); Số mol O 2 : \(y\, = \,\frac{{0,4\,{\rm{.}}\,\,1}}{2}\,\,{\rm{ = }}\,\,{\rm{0,2}}\,\,{\rm{(mol)}}\,.\)
c) Số mol O 2 \( = \,\frac{{4,958\,}}{{24,79}}\,\,{\rm{ = }}\,\,{\rm{0,2}}\,\,{\rm{(mol)}}\,\) => Số mol KNO 3 = 0,2.2 = 0,4 mol.
Khối lượng KNO 2 : \({\rm{0,4}}\,{\rm{.}}\,{\rm{122,5}}\,{\rm{ = }}\,49\,{\rm{(g)}}{\rm{.}}\)
Dựa vào định luật bảo toàn khối lượng.
n CaO = 2,8 : 56 = 0,05 mol
CaO + H 2 O \( \to \)Ca(OH) 2
0,05 \( \to \) 0,05
m Ca(OH)2 = 0,05 . 74 = 3,7g
khối lượng nước = D.V = 1.400 = 400g
Khối lượng dung dịch Ca(OH) 2 là: 400 + 2,8 = 402,8g
Dựa vào công thức tính thể tích ở điều kiện chuẩn.
a) Gọi số mol Cl 2 và O 2 lần lượt là a và 2a mol.
%V Cl2 = \(\frac{a}{{a + 2{\rm{a}}}}.100 = 33,33\% \)
%V O2 = 100 – 33,33% = 66,67%
%m Cl2 = \(\frac{{a.71}}{{a.71 + 32.2{\rm{a}}}}.100 = 52,6\% \)
%m O2 = 100 – 52,6 = 47,4%
b) \({\bar M_{hh}} = \frac{{{m_{C{l_2}}} + {m_{{O_2}}}}}{{{n_{C{l_2}}} + {n_{{O_2}}}}} = \frac{{71.a + 32.2{\rm{a}}}}{{a + 2{\rm{a}}}} = 45g/mol\)
Tỉ khối hỗn hợp A so với khí H 2 là: \(\frac{{{M_A}}}{{{M_{{H_2}}}}} = \frac{{45}}{2} = 22,5\)
c) n A = 7,437 : 24,79 = 0,3 mol
Khối lượng A là: 0,3.45 = 13,5g
Dựa vào công thức tính hiệu suất phản ứng.
a) Bảo toàn khối lượng: m KClO3 = m chất rắn + m O2
\( \to \)m O2 = 50 – 38 = 22g
n O2 = 22 : 32 = 0,375 mol
2KClO 3 \( \to \)2KCl + 3O 2
Theo phương trình hóa học: n KClO3 phản ứng = \(\frac{2}{3}{n_{{O_2}}} = \frac{2}{3}.0,375 = 0,25mol\)
H% = \(\frac{{{m_{KClO{3_{p/u}}}}}}{{{m_{KClO{3_{b/dau}}}}}}.100 = \frac{{0,25.122,5}}{{50}}.100 = 61,25\% \)
b) m KClO3 dư = 50 – 0,25.122,5 = 19,375g
n KCl = n KClO3 phản ứng = 0,25 mol
m KCl = 0,25.74,5 = 18,625g
m O2 = 22g