Đề thi giữa kì 2 Hóa 10 - Kết nối tri thức - Đề số 2
Khi cho Cu vào dung dịch FeCl3; H2S
Đề bài
Đốt cháy hoàn toàn 1 mol C 2 H 4 (g). Biết các sản phẩm thu được đều ở thể khí. Giá trị \({\Delta _r}H_{298}^0\)các phản ứng của phản ứng trên dựa theo nhiệt tạo thành chuẩn là
-
A.
-1323 kJ.
-
B.
-132,3 kJ.
-
C.
-264,6 kJ.
-
D.
-2646 kJ
Khi cho Cu vào dung dịch FeCl 3 ; H 2 S vào dung dịch CuSO 4 , HI vào dung dịch FeCl 3 ; dung dịch AgNO 3 vào FeCl 3 ; dung dịch NaHSO 4 vào dung dịch Fe(NO 3 ) 2 , O 2 vào dung dịch KI, số cặp chất phản ứng được với nhau là
-
A.
2
-
B.
5
-
C.
4.
-
D.
3.
Cho biết các phản ứng xảy ra như sau:
2FeBr 2 + Br 2 2FeBr 3 (1) 2NaBr + Cl 2 2NaCl + Br 2 (2)
Phát biểu đúng là:
-
A.
Tính khử Cl - mạnh hơn của \(B{r^ - }\)
-
B.
Tính oxi hóa của Br 2 mạnh hơn của Cl 2
-
C.
Tính khử của \(B{r^ - }\) mạnh hơn Fe 2+
-
D.
Tính oxi hóa của Cl 2 mạnh hơn của Fe 3+
Cho phương trình phản ứng
aFeSO 4 + bK 2 Cr 2 O 7 + cH 2 SO 4 \( \to \) dFe 2 (SO 4 ) 3 + eK 2 SO 4 + fCr 2 (SO 4 ) 3 + gH 2 O.
Tỉ lệ a : b là
-
A.
6 : 1.
-
B.
2 : 3.
-
C.
3 : 2.
-
D.
1 : 6.
Cho 4,8 gam Mg tác dụng với lượng dư dung dịch HNO 3 đặc, nóng thu được V lít khí NO 2 (ở đkc, là sản phẩm khử duy nhất). Giá trị của V là
-
A.
9,916.
-
B.
24,79.
-
C.
3,7185.
-
D.
4,958.
Số oxi hoá của S trong các chất: S ; H 2 SO 4 ; Na 2 SO 4 ; CaSO 3 ;NaHS lần lượt bằng:
-
A.
– 2; +6; +6; +4; –2.
-
B.
0; +6; +4; +4; –2.
-
C.
0; +6; +6; +4; –2.
-
D.
0; +6; +6; +4; +2.
Cho phản ứng: Cl 2 + 2NaOH \( \to \)NaCl + NaClO + H 2 O. Vai trò của Cl 2
-
A.
chỉ bị oxi hoá
-
B.
Chỉ bị khử
-
C.
không bị oxi hoá, không bị khử
-
D.
vừa bị oxi hoá, vừa bị khử.
Cho các quá trình sau : (1) Nước hoá rắn. (2) Sự tiêu hoá thức ăn. (3) Quá trình chạy của con người. (4) Khi CH 4 đốt ở trong lò. (5) Hoà tan KBr vào nước làm cho nước trở nên lạnh. (6) Sulfuric acid đặc khi thêm vào nước làm cho nước nóng lên. Các quá trình toả nhiệt hay thu nhiệt tương ứng là ?
-
A.
Tỏa nhiệt : (1), (3), (4), (6) và thu nhiệt : (2), (5).
-
B.
Tỏa nhiệt : (1), (3), (5), (6) và thu nhiệt : (2), (4).
-
C.
Tỏa nhiệt : (1), (2), (4), (6) và thu nhiệt : (3), (5).
-
D.
Tỏa nhiệt : (1), (3), (5), (6) và thu nhiệt : (2), (4).
Phát biểu nào sau đây đúng?
-
A.
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K.
-
B.
Điều kiện chuẩn là điều kiện ứng với nhiệt độ 298 K.
-
C.
Áp suất 760 mmHg là áp suất ở điều kiện chuẩn.
-
D.
Điều kiện chuẩn là điều kiện ứng với áp suất 1 atm, nhiệt độ 0 °C
Khái niệm nào sau đây về enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) là chính xác nhất ?
-
A.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 2 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn.
-
B.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất kém bền nhất ở điều kiện chuẩn.
-
C.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn.
-
D.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện tiêu chuẩn.
Mô tả nào sau đây là đúng theo phương trình nhiệt hóa học sau :
-
A.
Ở điều kiện chuẩn, phản ứng của 1 mol Ca(thể rắn) với 1 mol C (thể rắn) thu được 1 mol CaC 2 (thể rắn) và giải phóng (tỏa ra) một lượng nhiệt là 62,00 kJ, ta nói enthalpy tạo thành chuẩn của CaC 2 (thể rắn) là –62 kJ/mol.
-
B.
Ở điều kiện chuẩn, phản ứng của 1 mol Ca(thể rắn) với 2 mol C (thể rắn) thu được 2 mol CaC 2 (thể rắn) và giải phóng (tỏa ra) một lượng nhiệt là 62,00 kJ, ta nói enthalpy tạo thành chuẩn của CaC 2 (thể rắn) là –62 kJ/mol.
-
C.
Ở điều kiện chuẩn, phản ứng của 1 mol Ca(thể rắn) với 2 mol C (thể rắn) thu được 1 mol CaC 2 (thể rắn) và hấp thụ một lượng nhiệt là 62,00 kJ, ta nói enthalpy tạo thành chuẩn của CaC 2 (thể rắn) là +62 kJ/mol.
-
D.
Ở điều kiện chuẩn, phản ứng của 1 mol Ca(thể rắn) với 2 mol C (thể rắn) thu được 1 mol CaC 2 (thể rắn) và giải phóng (tỏa ra) một lượng nhiệt là 62,00 kJ, ta nói enthalpy tạo thành chuẩn của CaC 2 (thể rắn) là –62 kJ/mol.
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
(1) 2C(than chì) + O 2 (g) \( \to \)2CO(g)
(2) C (than chì) + 1/2 O 2 (g) \( \to \)CO(g)
(3) C (than chì) + CO 2 (g) \( \to \)2CO(g)
(4) CO(g) \( \to \)C (than chì) + O(g)
-
A.
(3)
-
B.
(1)
-
C.
(2)
-
D.
(4)
Trong các chất sau, chất nào bền nhất về nhiệt ở điều kiện chuẩn ?
-
A.
O 2 (g)
-
B.
N 2 (g)
-
C.
Ca(s)
-
D.
HCl(g)
Định nghĩa nào sau đây về biến thiên enthalpy là chính xác nhất ?
-
A.
Chính là nhiệt lượng tỏa ra của phản ứng được xác định ở điều kiện chuẩn.
-
B.
Chính là nhiệt lượng thu vào của phản ứng được xác định ở điều kiện chuẩn.
-
C.
Chính là nhiệt lượng tỏa ra hay thu vào của phản ứng được xác định ở điều kiện tiêu chuẩn.
-
D.
Chính là nhiệt lượng tỏa ra hay thu vào của phản ứng được xác định ở điều kiện chuẩn
Cho phương trình nhiệt hóa học của phản ứng tạo thành NO(g) trong không khí
\({N_2}(g) + {O_2}(g) \to 2NO(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = 180kJ\)
Phát biểu nào sau đây đúng?
-
A.
Cho 1 mol N 2 tác dụng với 1 mol O 2 tỏa nhiệt lượng là 180 kJ
-
B.
Cho 2 mol N 2 tác dụng với 1 mol O 2 thu vào nhiệt lượng là 180 kJ
-
C.
Cho 1 mol N 2 tác dụng với 1 mol O 2 thu vào nhiệt lượng là 180 kJ
-
D.
Cho 1 mol N 2 tác dụng với O 2 dư thu vào nhiệt lượng là 180 kJ
Dựa vào phương trình nhiệt hóa học của phản ứng sau:
\({N_2}(g) + 3{H_2}(g) \to 2N{H_3}(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 91,8kJ\)
Giá trị \({\Delta _r}H_{298}^0\)của phản ứng: 2NH 3 (g) \( \to \)N 2 (g) + 3H 2 (g) là
-
A.
-45,9 kJ
-
B.
45,9 kJ
-
C.
-91,8 kJ
-
D.
91,8 kJ
Ở điều kiện chuẩn, cần phải cung cấp 26,48 kJ nhiệt lượng cho quá trình ½ mol H 2 (thể khí) phản ứng với ½ mol I2 (thể rắn) để thu được 1 mol HI (thể khí). Ta nói enthalpy tạo thành của HI khí ở điều kiện chuẩn là 26,48 kJ mol -1 . Phản ứng trên được biểu diễn như sau:
\(\frac{1}{2}{H_2}(g) + \frac{1}{2}{I_2}(g) \to HI(g){\rm{ }}{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{ = }}26,48kJ/mol\)
ở cùng điều kiện phản ứng, nếu thu được 3 mol HI thì lượng nhiệt cần thu vào là bao nhiêu kJ?
-
A.
26,48 kJ
-
B.
52,96 kJ
-
C.
79,44 kJ
-
D.
794,4 kJ
Quá trình hòa tan calcium chloride trong nước: \(CaC{l_2}(s) \to C{a^{2 + }}(aq) + 2C{l^ - }(aq)\)
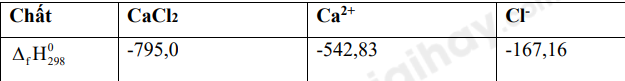
Biến thiên enthalpy của quá trình trên là:
-
A.
850,1 kJ
-
B.
850,1 kJ
-
C.
82,15 kJ
-
D.
-82,15 kJ
Cho biết năng lượng liên kết trong phân tử O 2 , N 2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng: \({N_2}(g) + {O_2}(g) \to 2NO(g)\)
-
A.
-225 kJ
-
B.
252 kJ
-
C.
225 kJ
-
D.
2250 kJ
Cho bảng năng lượng liên kết của các chất sau:

Tính \({\Delta _r}H_{298}^0\)của phản ứng sau: \({F_2}(g) + {H_2}O(g) \to 2HF(g) + \frac{1}{2}{O_2}(g)\). Dự đoán các phản ứng trên là thuận lợi hay không thuận lợi.
-
A.
292 kJ và thuận lợi
-
B.
-292 kJ và thuận lợi
-
C.
-292 kJ và không thuận lợi
-
D.
292 kJ và không thuận lợi
Cho phương trình phản ứng sau:
\(2{H_2}(g) + {O_2}(g) \to 2{H_2}O(l){\rm{ }}\Delta {\rm{H = - 572kJ}}\). Khi cho 2g khí H 2 tác dụng hoàn toàn với 32g khí O 2 thì phản ứng
-
A.
tỏa ra nhiệt lượng 286 kJ
-
B.
thu vào nhiệt lượng 286 kJ
-
C.
tỏa ra nhiệt lượng 572 kJ
-
D.
thu vào nhiệt lượng 572 kJ
Lời giải và đáp án
Đốt cháy hoàn toàn 1 mol C 2 H 4 (g). Biết các sản phẩm thu được đều ở thể khí. Giá trị \({\Delta _r}H_{298}^0\)các phản ứng của phản ứng trên dựa theo nhiệt tạo thành chuẩn là
-
A.
-1323 kJ.
-
B.
-132,3 kJ.
-
C.
-264,6 kJ.
-
D.
-2646 kJ
Đáp án : A
Dựa vào nhiệt tạo thành của các chất
C 2 H 4 (g) + 3O 2 (g)\( \to \)2CO 2 (g) + 2H 2 O(g)
\({\Delta _r}H_{298}^0\)= 2.\({\Delta _f}H_{298}^0(C{O_2}) + 2{\Delta _f}H_{298}^0({H_2}{\rm{O}}) - {\Delta _f}H_{298}^0({C_2}{H_4})\)
= 2. -393,5 + 2.(-241,8) – 52,4 = -1323 KJ
Đáp án A
Khi cho Cu vào dung dịch FeCl 3 ; H 2 S vào dung dịch CuSO 4 , HI vào dung dịch FeCl 3 ; dung dịch AgNO 3 vào FeCl 3 ; dung dịch NaHSO 4 vào dung dịch Fe(NO 3 ) 2 , O 2 vào dung dịch KI, số cặp chất phản ứng được với nhau là
-
A.
2
-
B.
5
-
C.
4.
-
D.
3.
Đáp án : C
Dựa vào khái niệm của phản ứng oxi hóa khử
Cu + 2FeCl 3 \( \to \)CuCl 2 + 2FeCl 2
2HI + 2FeCl 3 \( \to \)2FeCl 2 + 2HCl + I 2
9Fe(NO 3 ) 2 + 12NaHSO 4 → 2Fe 2 (SO 4 ) 3 + 5Fe(NO 3 ) 3 + 6Na 2 SO 4 + 6H 2 O + 3NO
½ O 2 + 2KI + H 2 O \( \to \) 2KOH + I 2
Đáp án C
Cho biết các phản ứng xảy ra như sau:
2FeBr 2 + Br 2 2FeBr 3 (1) 2NaBr + Cl 2 2NaCl + Br 2 (2)
Phát biểu đúng là:
-
A.
Tính khử Cl - mạnh hơn của \(B{r^ - }\)
-
B.
Tính oxi hóa của Br 2 mạnh hơn của Cl 2
-
C.
Tính khử của \(B{r^ - }\) mạnh hơn Fe 2+
-
D.
Tính oxi hóa của Cl 2 mạnh hơn của Fe 3+
Đáp án : C
Dựa vào kiến thức về phản ứng oxi hóa khử
Tính oxi hóa của Cl 2 mạnh hơn của Fe 3+
Đáp án D
Cho phương trình phản ứng
aFeSO 4 + bK 2 Cr 2 O 7 + cH 2 SO 4 \( \to \) dFe 2 (SO 4 ) 3 + eK 2 SO 4 + fCr 2 (SO 4 ) 3 + gH 2 O.
Tỉ lệ a : b là
-
A.
6 : 1.
-
B.
2 : 3.
-
C.
3 : 2.
-
D.
1 : 6.
Đáp án : A
Cân bằng phương trình theo phương pháp thăng bằng electron
\(\begin{array}{l}F{e^{ + 2}} \to F{e^{ + 3}} + 1{\rm{e|x3e}}\\C{r^{ + 6}} + 3{\rm{e}} \to C{r^{ + 3}}|x1{\rm{e}}\end{array}\)
6FeSO 4 + K 2 Cr 2 O 7 + 10H 2 SO 4 \( \to \) 3Fe 2 (SO 4 ) 3 + K 2 SO 4 + Cr 2 (SO 4 ) 3 + 10H 2 O.
Tỉ lệ a: b = 6 : 1
Đáp án A
Cho 4,8 gam Mg tác dụng với lượng dư dung dịch HNO 3 đặc, nóng thu được V lít khí NO 2 (ở đkc, là sản phẩm khử duy nhất). Giá trị của V là
-
A.
9,916.
-
B.
24,79.
-
C.
3,7185.
-
D.
4,958.
Đáp án : A
Dựa vào phương pháp bảo toàn electron
n Mg = 4,8: 24 = 0,2 mol
Mg + 4HNO 3 \( \to \)Mg(NO 3 ) 2 + 2NO 2 + 2H 2 O
n NO2 = 0,2 . 2 = 0,4 mol
V NO2 = 0,4 . 24,79 = 9,916 lít
Đáp án A
Số oxi hoá của S trong các chất: S ; H 2 SO 4 ; Na 2 SO 4 ; CaSO 3 ;NaHS lần lượt bằng:
-
A.
– 2; +6; +6; +4; –2.
-
B.
0; +6; +4; +4; –2.
-
C.
0; +6; +6; +4; –2.
-
D.
0; +6; +6; +4; +2.
Đáp án : C
Dựa vào quy tắc xác định số oxi hóa
\(\mathop S\limits^0 ,{H_2}\mathop S\limits^{ + 6} {O_4},N{a_2}\mathop S\limits^{ + 6} {O_4},Ca\mathop S\limits^{ + 4} {O_3},NaH\mathop S\limits^{ - 2} \)
Đáp án C
Cho phản ứng: Cl 2 + 2NaOH \( \to \)NaCl + NaClO + H 2 O. Vai trò của Cl 2
-
A.
chỉ bị oxi hoá
-
B.
Chỉ bị khử
-
C.
không bị oxi hoá, không bị khử
-
D.
vừa bị oxi hoá, vừa bị khử.
Đáp án : D
Dựa vào kiến thức về phản ứng oxi hóa khử
Cl 2 vừa bị oxi hóa, vừa bị khử
Đáp án D
Cho các quá trình sau : (1) Nước hoá rắn. (2) Sự tiêu hoá thức ăn. (3) Quá trình chạy của con người. (4) Khi CH 4 đốt ở trong lò. (5) Hoà tan KBr vào nước làm cho nước trở nên lạnh. (6) Sulfuric acid đặc khi thêm vào nước làm cho nước nóng lên. Các quá trình toả nhiệt hay thu nhiệt tương ứng là ?
-
A.
Tỏa nhiệt : (1), (3), (4), (6) và thu nhiệt : (2), (5).
-
B.
Tỏa nhiệt : (1), (3), (5), (6) và thu nhiệt : (2), (4).
-
C.
Tỏa nhiệt : (1), (2), (4), (6) và thu nhiệt : (3), (5).
-
D.
Tỏa nhiệt : (1), (3), (5), (6) và thu nhiệt : (2), (4).
Đáp án : A
Dựa vào dấu hiệu của phản ứng thu nhiệt và tỏa nhiệt
Tỏa nhiệt : (1), (3), (4), (6) và thu nhiệt : (2), (5). Đáp án A
Phát biểu nào sau đây đúng?
-
A.
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K.
-
B.
Điều kiện chuẩn là điều kiện ứng với nhiệt độ 298 K.
-
C.
Áp suất 760 mmHg là áp suất ở điều kiện chuẩn.
-
D.
Điều kiện chuẩn là điều kiện ứng với áp suất 1 atm, nhiệt độ 0 °C
Đáp án : A
Dựa vào điều kiện chuẩn của phản ứng
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K. đáp án A
Khái niệm nào sau đây về enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) là chính xác nhất ?
-
A.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 2 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn.
-
B.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất kém bền nhất ở điều kiện chuẩn.
-
C.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn.
-
D.
Là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện tiêu chuẩn.
Đáp án : C
Dựa vào khái niệm về enthalpy tạo thành chuẩn
Enthalpy tạo thành chuẩn là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn
Đáp án C
Mô tả nào sau đây là đúng theo phương trình nhiệt hóa học sau :
-
A.
Ở điều kiện chuẩn, phản ứng của 1 mol Ca(thể rắn) với 1 mol C (thể rắn) thu được 1 mol CaC 2 (thể rắn) và giải phóng (tỏa ra) một lượng nhiệt là 62,00 kJ, ta nói enthalpy tạo thành chuẩn của CaC 2 (thể rắn) là –62 kJ/mol.
-
B.
Ở điều kiện chuẩn, phản ứng của 1 mol Ca(thể rắn) với 2 mol C (thể rắn) thu được 2 mol CaC 2 (thể rắn) và giải phóng (tỏa ra) một lượng nhiệt là 62,00 kJ, ta nói enthalpy tạo thành chuẩn của CaC 2 (thể rắn) là –62 kJ/mol.
-
C.
Ở điều kiện chuẩn, phản ứng của 1 mol Ca(thể rắn) với 2 mol C (thể rắn) thu được 1 mol CaC 2 (thể rắn) và hấp thụ một lượng nhiệt là 62,00 kJ, ta nói enthalpy tạo thành chuẩn của CaC 2 (thể rắn) là +62 kJ/mol.
-
D.
Ở điều kiện chuẩn, phản ứng của 1 mol Ca(thể rắn) với 2 mol C (thể rắn) thu được 1 mol CaC 2 (thể rắn) và giải phóng (tỏa ra) một lượng nhiệt là 62,00 kJ, ta nói enthalpy tạo thành chuẩn của CaC 2 (thể rắn) là –62 kJ/mol.
Đáp án : D
Dựa vào khái niệm của enthalpy tạo thành chuẩn của chất
Ở điều kiện chuẩn, phản ứng của 1 mol Ca(thể rắn) với 2 mol C (thể rắn) thu được 1 mol CaC 2 (thể rắn) và giải phóng (tỏa ra) một lượng nhiệt là 62,00 kJ, ta nói enthalpy tạo thành chuẩn của CaC 2 (thể rắn) là –62 kJ/mol.
Đáp án D
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
(1) 2C(than chì) + O 2 (g) \( \to \)2CO(g)
(2) C (than chì) + 1/2 O 2 (g) \( \to \)CO(g)
(3) C (than chì) + CO 2 (g) \( \to \)2CO(g)
(4) CO(g) \( \to \)C (than chì) + O(g)
-
A.
(3)
-
B.
(1)
-
C.
(2)
-
D.
(4)
Đáp án : C
Dựa vào khái niệm enthalpy tạo thành chuẩn của chất
C (than chì) + 1/2 O 2 (g) \( \to \)CO(g)
Đáp án C
Trong các chất sau, chất nào bền nhất về nhiệt ở điều kiện chuẩn ?
-
A.
O 2 (g)
-
B.
N 2 (g)
-
C.
Ca(s)
-
D.
HCl(g)
Đáp án : B
Dựa vào năng lượng của các chất
ở điều kiện thường, N 2 (g) bền về nhiệt vì trong phân tử N 2 có liên kết ba bền vững
đáp án B
Định nghĩa nào sau đây về biến thiên enthalpy là chính xác nhất ?
-
A.
Chính là nhiệt lượng tỏa ra của phản ứng được xác định ở điều kiện chuẩn.
-
B.
Chính là nhiệt lượng thu vào của phản ứng được xác định ở điều kiện chuẩn.
-
C.
Chính là nhiệt lượng tỏa ra hay thu vào của phản ứng được xác định ở điều kiện tiêu chuẩn.
-
D.
Chính là nhiệt lượng tỏa ra hay thu vào của phản ứng được xác định ở điều kiện chuẩn
Đáp án : D
Dựa vào khái niệm về biến thiên enthalpy của phản ứng
Biến thiên enthalpy là nhiệt lượng tỏa ra hay thu vào của phản ứng được xác định ở điều kiện chuẩn
Đáp án D
Cho phương trình nhiệt hóa học của phản ứng tạo thành NO(g) trong không khí
\({N_2}(g) + {O_2}(g) \to 2NO(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = 180kJ\)
Phát biểu nào sau đây đúng?
-
A.
Cho 1 mol N 2 tác dụng với 1 mol O 2 tỏa nhiệt lượng là 180 kJ
-
B.
Cho 2 mol N 2 tác dụng với 1 mol O 2 thu vào nhiệt lượng là 180 kJ
-
C.
Cho 1 mol N 2 tác dụng với 1 mol O 2 thu vào nhiệt lượng là 180 kJ
-
D.
Cho 1 mol N 2 tác dụng với O 2 dư thu vào nhiệt lượng là 180 kJ
Đáp án : C
Dựa vào biến thiên enthalpy của phản ứng
Cho 1 mol N 2 tác dụng với 1 mol O 2 thu vào nhiệt lượng là 180 kJ
Đáp án C
Dựa vào phương trình nhiệt hóa học của phản ứng sau:
\({N_2}(g) + 3{H_2}(g) \to 2N{H_3}(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 91,8kJ\)
Giá trị \({\Delta _r}H_{298}^0\)của phản ứng: 2NH 3 (g) \( \to \)N 2 (g) + 3H 2 (g) là
-
A.
-45,9 kJ
-
B.
45,9 kJ
-
C.
-91,8 kJ
-
D.
91,8 kJ
Đáp án : D
Dựa vào enthalpy của phản ứng (1)
Phản ứng (2) là phản ứng nghịch của phản ứng (1) => \({\Delta _r}H_{298}^0\)(2) = 91,8 kJ
Đáp án D
Ở điều kiện chuẩn, cần phải cung cấp 26,48 kJ nhiệt lượng cho quá trình ½ mol H 2 (thể khí) phản ứng với ½ mol I2 (thể rắn) để thu được 1 mol HI (thể khí). Ta nói enthalpy tạo thành của HI khí ở điều kiện chuẩn là 26,48 kJ mol -1 . Phản ứng trên được biểu diễn như sau:
\(\frac{1}{2}{H_2}(g) + \frac{1}{2}{I_2}(g) \to HI(g){\rm{ }}{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{ = }}26,48kJ/mol\)
ở cùng điều kiện phản ứng, nếu thu được 3 mol HI thì lượng nhiệt cần thu vào là bao nhiêu kJ?
-
A.
26,48 kJ
-
B.
52,96 kJ
-
C.
79,44 kJ
-
D.
794,4 kJ
Đáp án : C
Dựa vào enthalpy tạo thành chuẩn của phản ứng tạo thành HI
Nếu thu được 3 mol HI thì lượng nhiệt cần thu là 26,48 . 3 = 79,44 kJ
Đáp án C
Quá trình hòa tan calcium chloride trong nước: \(CaC{l_2}(s) \to C{a^{2 + }}(aq) + 2C{l^ - }(aq)\)
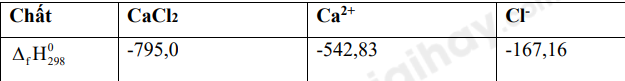
Biến thiên enthalpy của quá trình trên là:
-
A.
850,1 kJ
-
B.
850,1 kJ
-
C.
82,15 kJ
-
D.
-82,15 kJ
Đáp án : D
Dựa vào enthalpy tạo thành chuẩn của các chất
\({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0(C{a^{2 + }}) + 2.{\Delta _f}H_{298}^0(C{l^ - }) - {\Delta _f}H_{298}^0(CaC{l_2})\)
= -542,83 + 2.-167,16 – (-795,0) = -82,15 KJ
Đáp án D
Cho biết năng lượng liên kết trong phân tử O 2 , N 2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng: \({N_2}(g) + {O_2}(g) \to 2NO(g)\)
-
A.
-225 kJ
-
B.
252 kJ
-
C.
225 kJ
-
D.
2250 kJ
Đáp án : C
Dựa vào năng lượng liên kết trong các phân tử
\(\Delta rH_{298}^0 = {E_{N2}} + {E_{O2}} - 2{E_{NO}} = {E_{N \equiv N}} + {E_{O = O}} - 2.{E_{N - O}}\)= 945 + 494 – 2.607 = 225 kj
Đáp án C
Cho bảng năng lượng liên kết của các chất sau:

Tính \({\Delta _r}H_{298}^0\)của phản ứng sau: \({F_2}(g) + {H_2}O(g) \to 2HF(g) + \frac{1}{2}{O_2}(g)\). Dự đoán các phản ứng trên là thuận lợi hay không thuận lợi.
-
A.
292 kJ và thuận lợi
-
B.
-292 kJ và thuận lợi
-
C.
-292 kJ và không thuận lợi
-
D.
292 kJ và không thuận lợi
Đáp án : D
Dựa vào enthalpy tạo thành của các chất
\({\Delta _r}H_{298}^0\)= \(2.{E_{H - F}} + \frac{1}{2}{E_{O = O}} - {E_{F - F}} + 2{{\rm{E}}_{O - H}}\)= 2. 565 + ½ . 498 – 159 – 2.464 = 292 kJ
Phản ứng thu nhiệt và không thuận lợi
Đáp án D
Cho phương trình phản ứng sau:
\(2{H_2}(g) + {O_2}(g) \to 2{H_2}O(l){\rm{ }}\Delta {\rm{H = - 572kJ}}\). Khi cho 2g khí H 2 tác dụng hoàn toàn với 32g khí O 2 thì phản ứng
-
A.
tỏa ra nhiệt lượng 286 kJ
-
B.
thu vào nhiệt lượng 286 kJ
-
C.
tỏa ra nhiệt lượng 572 kJ
-
D.
thu vào nhiệt lượng 572 kJ
Đáp án : A
Dựa vào số mol của H 2 và O 2
n H2 = 2:2 = 1 mol
n O2 = 32 : 32 = 1 mol
Theo phương trình phản ứng: n H2 hết , n O2 dư
Nhiệt lượng tỏa ra là: ½ . 572 = 286 kJ
Đáp án A