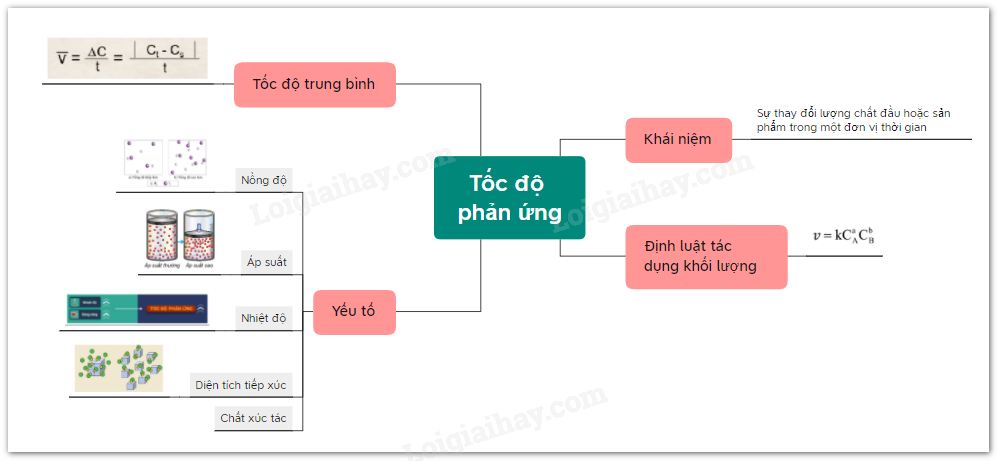
Lý thuyết bài 16: Tốc độ phản ứng hóa học
Tốc độ phản ứng hóa học, tốc độ trung bình, biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng và nồng độ, hệ số nhiệt độ Van't Hoff
Lý thuyết: Tốc độ phản ứng hóa học
I. Khái niệm tốc độ phản ứng, tốc độ trung bình của phản ứng
1. . Khái niệm tốc độ phản ứng
Tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.

Tốc độ phản ứng kí hiệu là v có đơn vị là M.s -1
2. Tốc độ trung bình của phản ứng
Tốc độ trung bình của phản ứng là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
Cho phản ứng tổng quát:
aA + bB -> mM + nN
Tốc độ trung bình được tính dựa theo sự thay đổi nồng độ của một chất bất kì trong phản ứng theo quy ước sau:
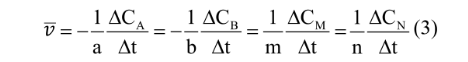

II. Định luật tác dụng khối lượng
Định luật: Tốc độ phản ứng tỉ lệ thuận với tích nồng độ các chất tham gia phản ứng với số mũ thích hợp.
Định luật tác dụng khối lượng áp dụng cho các phản ứngđơn giản, biểu thị sự phụ thuộc tốc độ phản ứng theo nồng độ các chất phản ứng.
Ví dụ: Với phản ứng đơn giản có dạng: aA + bB -> sản phẩm

III. Các yếu tố ảnh hưởng tới tốc độ phản ứng, hệ số nhiệt độ Van’t hoff
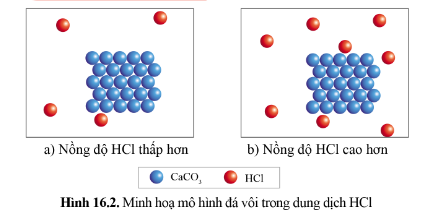
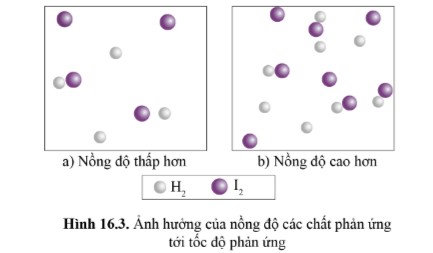
1. Ảnh hưởng của nồng độ:
Nồng độ các chất phản ứng càng lớn, tốc độ phản ứng càng lớn.
2. Ảnh hưởng của áp suất:
Áp suất của các chất phản ứng ở thể khí càng lớn, tốc độ phản ứng càng lớn.
3. Ảnh hưởng của diện tích bề mặt
Diện tích bề mặt càng lớn, tốc độ phản ứng càng lớn
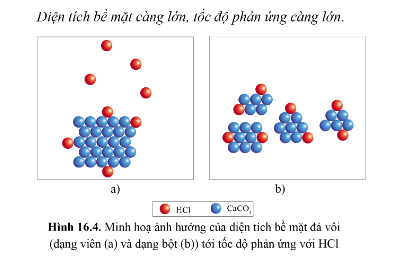
4. Ảnh hưởng của nhiệt độ:
Nhiệt độ càng cao, tốc độ phản ứng càng lớn. Với đa số các phản ứng, khi nhiệt độ tăng 10 o thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị này được gọi là hệ số nhiệt độ Van’t Hoff
Mối liên hệ của hệ số Van’t Hoff với tốc độ và nhiệt độ như sau:
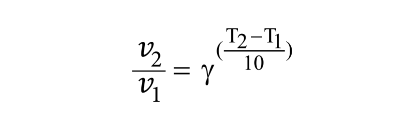
Trong đó v1, v2 là tốc độ phản ứng ở nhiệt độ T1 và T2 tương ứng
5. Ảnh hưởng của chất xúc tác:
Để tăng tốc độ phản ứng hóa học => thêm chất xúc tác vào hỗn hợp phản ứng.
Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị thay đổi cả về lượng và chất sau phản ứng
Ví dụ: Các enzym trong cơ thể là những chất xúc tác sinh học thúc đẩy các phản ứng sinh hóa phức tạp trong cơ thể.
Một loại enzym protease
Sơ đồ tư duy