Lý thuyết bài 11: Liên kết cộng hóa trị
Liên kết cộng hóa trị, liên kết đơn, liên kết đôi
Lý thuyết: Liên kết cộng hóa trị
I. Liên kết cộng hóa trị
Liên kết cộng hóa trị là liên kết được hình thành bởi một hay nhiều cặp electron dùng chung giữa hai nguyên tử.
1. Liên kết đơn:
Ví dụ: Nguyên tử Hydrogen (H) có 1e ngoài cùng, chlorine (Cl) có 7e ngoài cùng. Để đạt được cấu hình của nguyên tử khí hiếm gần nhất, mỗi nguyên tử H và Cl góp chung 1e để tạo nên 1 cặp electron dùng chung cho cả 2 nguyên tử.
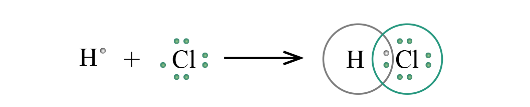
Sơ đồ mô tả sự hình thành cặp e chung của HCl
- Giữa 2 nguyên tử có một cặp electron dùng chung thì cặp elctron này được bieur diễn bằng một nối đơn (-) gọi là liên kết đơn.
- HCl được biểu diễn như sau:
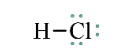
- Hợp chất HCl được tạo nên chỉ bởi liên kết cộng hóa trị nên thuộc loại hợp chất cộng hóa trị.
2. Liên kết đôi:
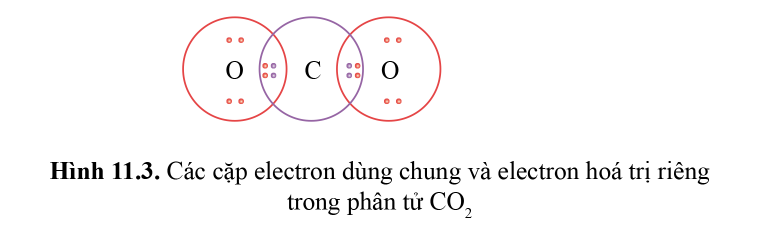
Nếu giữa hai nguyên tử có hai cặp electron dùng chung thì hai cặp electron này được biểu diễn bằng một nối đôi (=) và gọi là liên kết đôi.
Ví dụ: Công thức cấu tạo của CO 2 là O=C=O
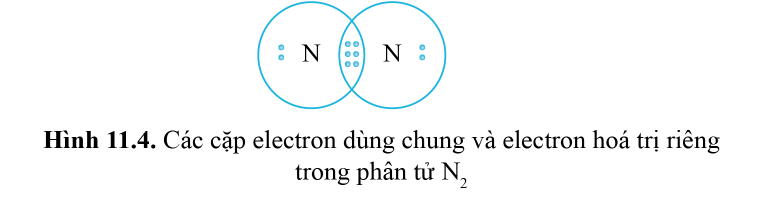
3. Liên kết ba:
Nếu giữa hai nguyên tử có ba cặp electron dùng chung thì ba cặp electron này được biểu diễn bằng một nối ba (≡) và gọi là liên kết ba.
Ví dụ: Công thức cấu tạo của N 2 là N≡N
4. Liên kết cho nhận:
Liên kết cho – nhận là loại liên kết cộng hóa trị mà cặp electron dùng chung được đóng góp từ một nguyên tử.
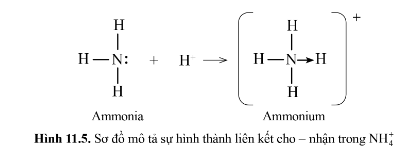
Ví dụ:
- Phân tử NH 3 , lớp ngoài cùng của nguyên tử N có 5 electron, trong đó có cặp electron chưa liên kết
=> Ion H + có orbital trống, không có electron
=> Khi phân tử NH 3 kết hợp với H + , nguyên tử N đóng góp cặp electron chưa liên kết để tạo liên kết với H + tạo thành NH 4 +
=> Liên kết cho – nhận được hình thành
=> Nguyên tử N là nguyên tử cho, ion H + là nguyên tử nhận
II. Phân loại liên kết theo độ âm điện
Dựa vào hiệu độ âm điện (∆ c đọc là đen – ta) giữa hai nguyên tử A và B, có thể dự đoán loại liên kết giũa hai nguyên tử đó.

Ví dụ:
- Trong phân tử HCl, hiệu độ âm điện của Cl và H: 3,16 – 2,20 = 0.96
=> Liên kết cộng hóa trị phân cực
- Trong phân tử NaCl, hiệu độ âm điện của Cl và Na: 3,16 – 0,93 = 2,23
=> Liên kết ion
III. Liên kết sigma và liên kết Pi
1. Liên kết sigma ( σ)
Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma
Có ba khả năng xen phủ trục:
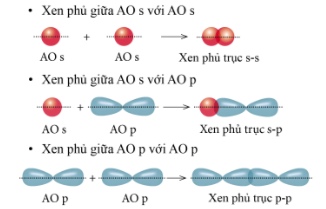
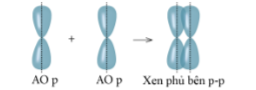
2. Liên kết Pi ( п)
Liên kết được tạ nên từ xen phủ bên của 2 AO gọi là liên kết pi ( п)
IV. Năng lượng của liên kết cộng hóa trị
Các nguyên tửu liên kết với nhau tạo thành hệ bền vững. Để phá vỡ liên kết giữa các nguyên tử thì phải cung cấp năng lượng.
=> Năng lượng liên kết (E b ) là năng lượng cần thiết để phá vỡ một liên kết hóa học trong phân tử ở thể khí thành các nguyên tử ở thể khí
- Đơn vị: kJ/mol
Ví dụ: Để phá vỡ liên kết H-H trong 1mol khí H 2 ở 25 o C và 1 bar cần năng lượng là 436 kJ
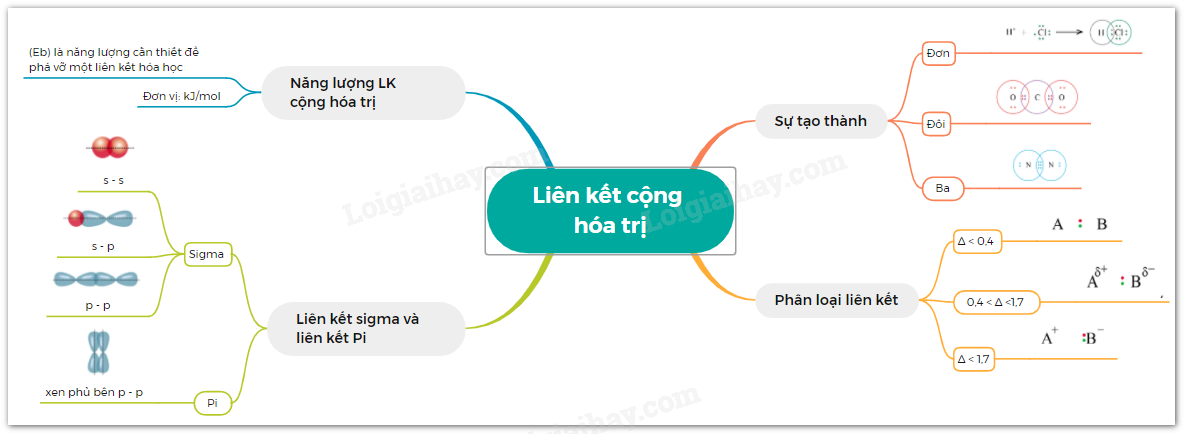
Sơ đồ tư duy