Lý thuyết bài 9: Quy tắc Octet
Quy tắc Octet
Lý thuyết: Quy tắc octet
I. Quy tắc octet
Quy tắc: Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững của khí hiếm.
II. Vận dụng quy tắc Octet trong quá trình hình thành liên kết hóa học của các nguyên tố nhóm A
Trong quá trình hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt được cấu hình electron bền vững của nguyên tử khí hiếm gần nhất với 8 electron ở lớp ngoài cùng (hoặc 2 electron ở lớp ngoài cùng như của heli)
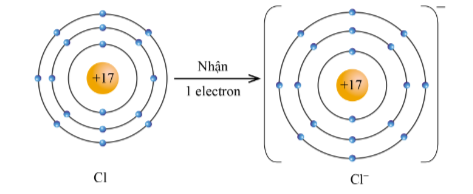
Ví dụ 1 : Nguyên tử chlorine với cấu hình electron là: [Ne]3s 2 3p 5 , có 7 e ngoài cùng. Xu hướng cơ bản của nguyên tử chlorine khi hình thành liên kết hóa học là nhận thêm 1 electron để đạt được 8 electron ở lớp ngoài cùng như của khí hiếm Ar (thay vì Cl phải nhường đi 7 electron để có lớp electron ngoài cùng là 2s 2 2p 6 – khó khăn hơn rất nhiều)
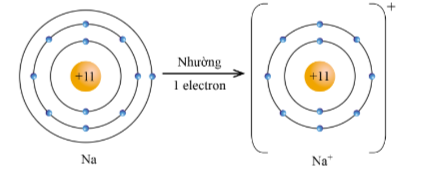
Ví dụ 2: Nguyên tử sodium với cấu hình electron là : [Ne]3s 1 có 1 electron ở lớp vỏ ngoài cùng. Xu hướng cơ bản của nguyên tử sodium khi hình thành liên kết hóa học là nhường đi 1 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài cùng như của khí hiếm Ne (thay vì sodium phải nhận thêm 7 electron để có lớp electron ngoài cùng là 3s 2 3p 6 – khó khăn hơn rất nhiều)
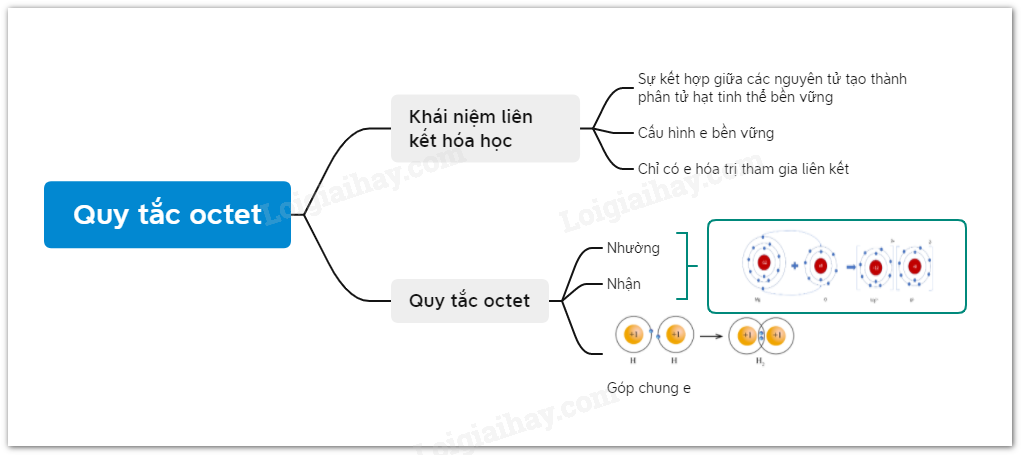
Sơ đồ tư duy