Lý thuyết bài 14: Phản ứng hóa học và Enthalpy
phản ứng tỏa nhiệt, phản ứng thu nhiệt, nhiệt tạo thành, biến thiên enthalpy, ý nghĩa của dấu và giá trị biến thiên enthalpy chuẩn
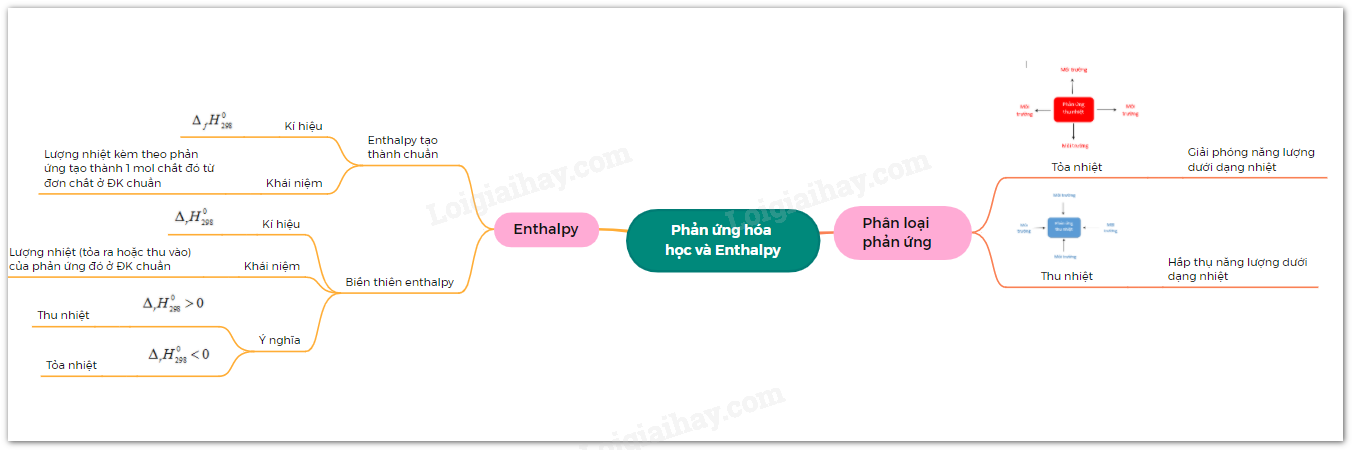
Lý thuyết: Phản ứng hóa học và Enthalpy
I. Phản ứng tỏa nhiệt và phản ứng thu nhiệt
Phản ứng giải phóng năng lượng dưới dạng nhiệt gọi là phản ứng tỏa nhiệt


Phản ứng hấp thụ năng lượng dưới dạng nhiệt gọi là phản ứng thu nhiệt

Với cùng một phản ứng, ở điều kiện khác nhau về nhiệt độ, áp suất thì lượng nhiệt kèm theo cũng khác nhau
- Điều kiện chuẩn: ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol.L -1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25 o C)
II. Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
1. Enthalpy tạo thành chuẩn của một chất hóa học
Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất, kí hiệu là \({\Delta _r}H_{298}^o\)
Ví dụ 1: Phản ứng đốt cháy 2 mol khí hydrogen bằng 1 mol khí oxygen, tạo thành 2 mol nước ở trạng thái lỏng, tỏa ra nhiệt lượng 571,6 kJ.. Phản ứng trên có biến thiên enthalpy \({\Delta _r}H_{298}^o\) = -571,6 kJ, biểu diễn như sau:
2H 2 (g) + O 2 (g) → 2H 2 O(l) \({\Delta _r}H_{298}^o\) = -571,6 kJ
\({\Delta _r}H_{298}^o\) > 0: phản ứng thu nhiệt
\({\Delta _r}H_{298}^o\) < 0: phản ứng tỏa nhiệt
- Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều
Ví dụ 2: Xét 2 phản ứng
CH 4 (g) + 2O 2 (g) CO 2 (g) + 2H 2 O(l) \({\Delta _r}H_{298}^o\) = -890 kJ/mol
CH 3 OH(l) + 3/2 O 2 (g) CO 2 (g) + 2H 2 O(l) \({\Delta _r}H_{298}^o\) = -726 kJ/mol
=> Đốt 1 mol methane tỏa ra nhiệt lượng nhiều hơn đốt 1 mol methanol
2. Biến thiên enthalpy chuẩn của phản ứng hóa học
Biến thiên enthalpy chuẩn của một phản ứng hóa học kí hiệu là \({\Delta _r}H_{298}^o\) chính là lượng nhiệt (tỏa ra hoặc thu vào) của phản ứng đó ở điều kiện chuẩn
VD: Phản ứng nhiệt phân CaCO 3 là phản ứng thu nhiệt
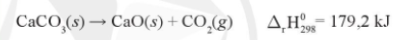
Sơ đồ tư duy