Lý thuyết bài 10: Liên kết ion
Liên kết ion
Lý thuyết: Liên kết ion
I. Khái niệm và sự hình thành liên kết ion
1. Khái niệm
Liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu
Ví dụ: Liên kết ion trong hợp chất NaCl tạo bởi lực hút tĩnh điện giữa cation Na + và anion Cl -
Na + + Cl - → NaCl
Các hợp chất được tạo nên từ cation và anion gọi là hợp chất ion
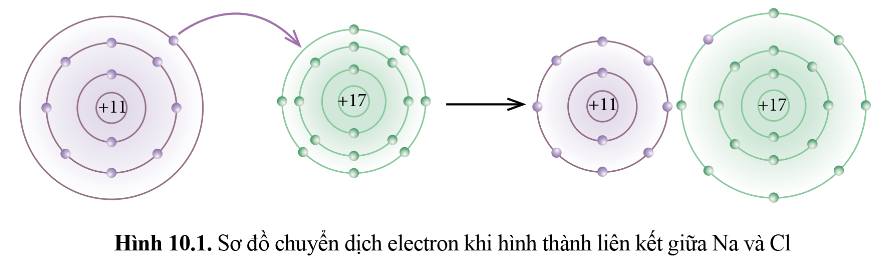
2. Sự hình thành liên kết ion từ phản ứng giữa các nguyên tử
Quá trình diễn ra: Hình thành các ion trái dấu từ các quá trình nguyên tử kim loại nhường electron và nguyên tử phi kim nhận electron theo quy tắc octet.
=> Nguyên tử kim loại điển hình nhường electron tạo thành cation. Nguyên tử phi kim điển hình nhận electron tạo thành anion.
Ví dụ:
Na → Na + + 1e
Cl + 1e → Cl -
Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion. Các ion trái dấu kết hợp với nhau theo tỉ lệ sao cho tổng điện tích của các ion trong hợp chất phải bằng 0
Na + + Cl - → NaCl
Nhận xét: Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình
II. Tinh thể ion
1. Khái niệm
Tinh thể ion là loại tinh thể được tạo nên bởi các cation và anion.
Ví dụ: Tinh thể muối ăn (NaCl) được hình thành từ các ion Na + và Cl - Sắp xếp cạnh nhau một cách luân phiên.
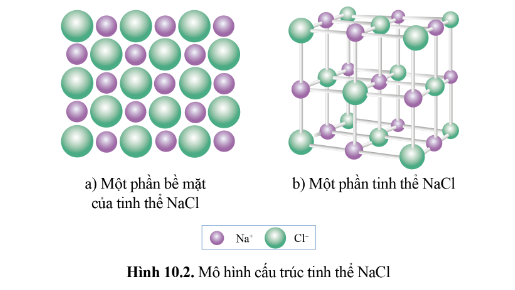

Tinh thể muối ăn
2. Đặc điểm của hợp chất ion
Hợp chất ion tạo bởi lực hút tĩnh điện giữa các nguyên tử => Các phân tử này không chuyển động tự do được
=> Hợp chất ion thường là tinh thể rắn ở điều kiện thường, nhiệt độ nóng chảy và nhiệt độ sôi rất cao.
Ví dụ: NaCl nóng chảy ở 801 o C
NaF nóng chảy ở 993 o C
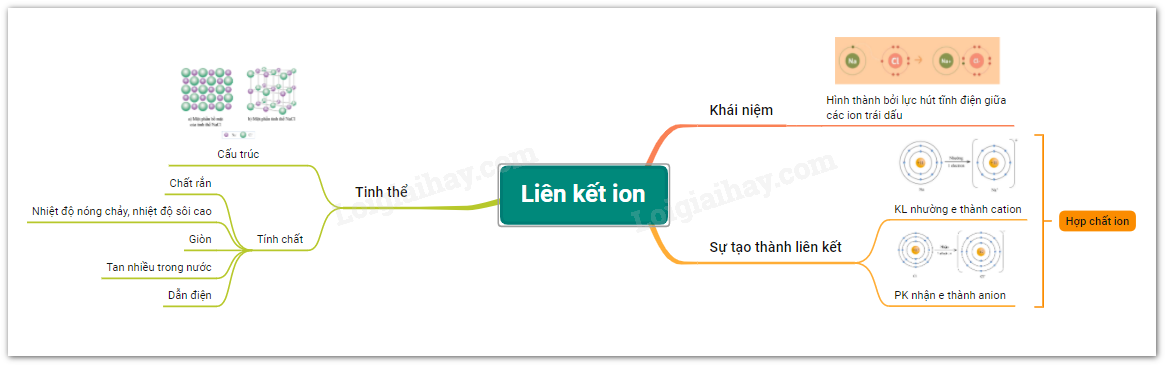
Sơ đồ tư duy