Lý thuyết bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
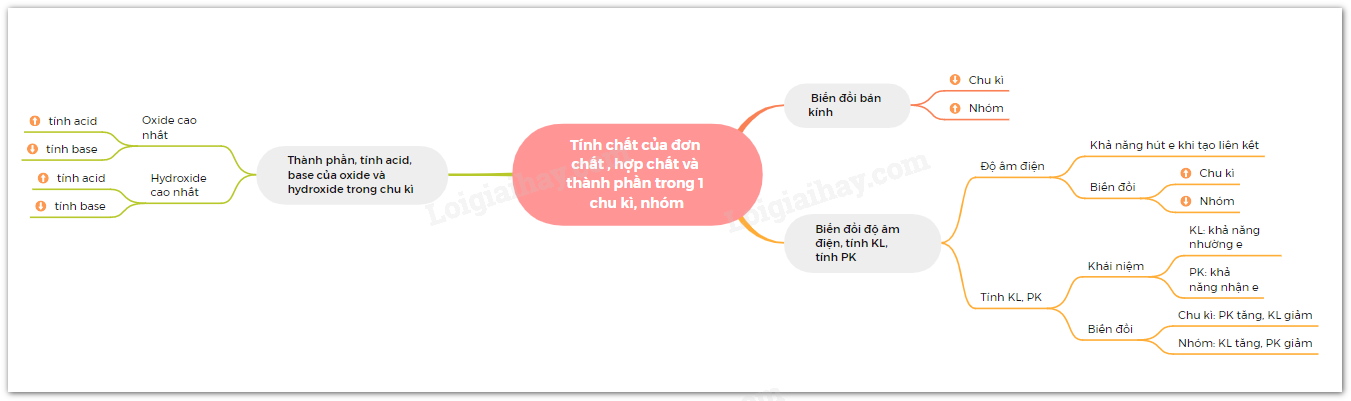
Lý thuyết: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
I. Xu hướng biến đổi bán kính nguyên tử
1. Trong một chu kì
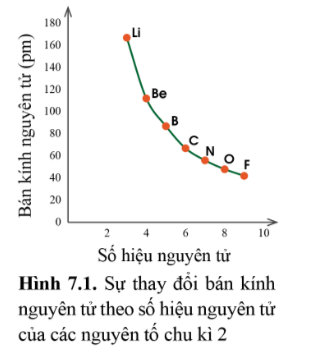
Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính các nguyen tử có xu hướng giảm dần.
- Giải thích: Trong cùng một chu kì có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên hạt nhân sẽ hút electron lớp ngoài cùng mạnh hơn, làm cho bán kính nguyên tử giảm
2. Trong một nhóm A
Quy luật: Trong một nhóm, theo chiều tăng điện tích hạt nhân, bán kính của nguyên tử có xu hướng tăng dần.
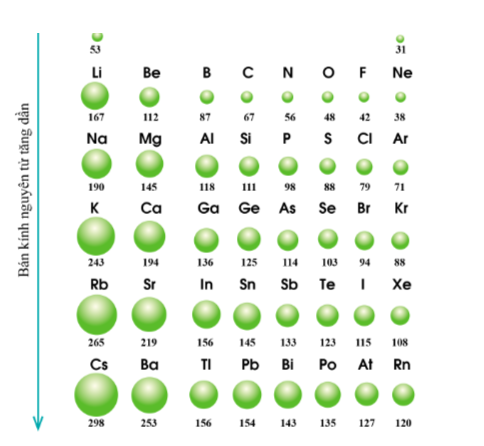
- Giải thích: Trong một nhóm A, theo chiều từ trên xuống dưới, số lớp electron tăng dần => bán kính nguyên tử tăng dần
II. Xu hướng biến đổi độ âm điện, tính kim loại và tính phi kim
1. Độ âm điện
Độ âm điện là đại lượng đặc trưng cho khả năng hút electron liên kết của một nguyên tử trong phân tử.
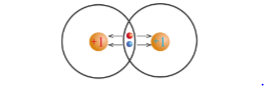
Cặp electron liên kết bị các nguyên tử hút về phía hạt nhân của mỗi nguyên tử H

* Quy luật chung đối với các nguyên tố nhóm A:
- Trong một chu kì, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng tăng dần.
- Trong một nhóm, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng giảm dần.
* Giải thích:
- Trong một chu kì, từ trái sang phải theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần nên khả năng hút cặp electron liên kết càng tăng => độ âm điện tăng.
- Trong một nhóm, từ trên xuống dưới theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử tăng lên => lực hút cua hạt nhân tới cặp electron liên kết giảm => độ âm điện giảm
2. Tính kim loại và tính phi kim
Tính kim loại đặc trưng nởi khả năng nhường electron của nguyên tử, tính phi kim đặc trưng bởi khả năng nhận electron của nguyên tử.
* Quy luật chung đối với các nguyên tố nhóm A:
- Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng giảm dần, tính phi kim của các nguyên tố có xu hướng tăng dần.
- Trong một nhóm, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng tăng dần, tính phi kim của các nguyên tố có xu hướng giảm dần.
* Giải thích:
- Trong một chu kì, từ trái sang phải, điện tích hạt nhân tăng dần, bán kính nguyên tử giảm dần => lực hút của hạt nhân tới electron hóa trị tăng, làm giảm khả năng nhường electron => tính kim loại giảm.
- Trong cùng một nhóm A, bán kính nguyên tố tăng nhanh => lực hút của hạt nhân tới electron hóa trị giảm dần => làm tăng khả năng nhường electron => tính kim loại tăng.
III. Xu hướng biến đổi thành phần và tính acid, tính base của các oxide và các hydroxide theo chu kì
1. Thành phần và tính acid, tính base của các oxide cao nhất trong một chu kì
Oxide cao nhất của một nguyên tố là oxide mà trong đó, hóa trị của nguyên tố đó là cao nhất.
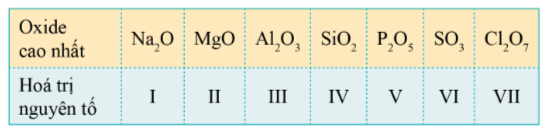
Công thức oxide cao nhất của các nguyên tố nhóm A chu kì 3
* Xu hướng biến đổi thành phần của các oxide cao nhất:
- Trong một chu kì, theo chiều tăng điện tích hạt nhân, tỉ số giữa số nguyên tử oxygen với số nguyên tử nguyên tố còn lại trong các oxide cao nhất có xu hướng tăng dần.
* Xu hướng biến đổi tính acid, tính base của oxide cao nhất:
- Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính acid của oxide cao nhất có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.
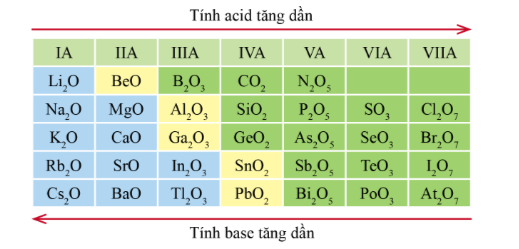
Xu hướng biến đổi tính acid tính base của một số oxide cao nhất
2. Thành phần và tính acid, tính base của các hydroxide trong một chu kì
Xu hướng: Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính acid của các hydroxide có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.

Sơ đồ tư duy