Lý thuyết bài 5: Lớp, phân lớp và cấu hình electron
Lớp, phân lớp, cấu hình electron
Lý thuyết: Lớp, phân lớp và cấu hình electron
I. Lớp và phân lớp electron
Các electron trong lớp vỏ nguyên tử được phân bố vào các lớp và phân lớp dựa theo năng lượng của chúng.
1. Lớp electron
- Các electron thuộc cùng một lớp có năng lượng gần bằng nhau
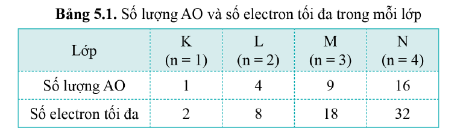
- Số lượng AO và số electron tối đa trên mỗi lớp:
2. Phân lớp electron
Mỗi lớp electron lại được chia thành các phân lớp theo nguyên tắc: Các electron thuộc cùng một phân lớp có năng lượng bằng nhau.
* Số lượng và kí hiệu các phân lớp trong một lớp
Lớp electron thứ n có n phân lớp, cụ thể:
- Lớp K, n = 1: có 1 phân lớp, kí hiệu là 1s
- Lớp L, n = 2: có 2 phân lớp, kí hiệu là 2s và 2p
- Lớp M, n = 3: có 3 phân lớp, kí hiệu là 3s và 3p và 3d
* Số lượng AO trong mỗi phân lớp:
- Phân lớp ns chỉ có 1AO
- Phân lớp np chỉ có 3AO
- Phân lớp nd chỉ có 5AO
- Phân lớp nf chỉ có 7AO
* Phân lớp nào đã có tối đa electron thì được gọi là phân lớp bão hòa
II. Cấu hình nguyên tử:
1. Cách viết cấu hình electron nguyên tử
Cấu hình electron biểu diễn sự phân bố electron vào lớp vỏ nguyên tử theo các lớp và phân lớp
* Các bước:
- B1: Điền electron theo thứ tự các mức năng lượng từ thấp đến cao
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s
Điền electron bão hòa phân lớp trước rồi mới điền tiếp vào phân lớp sau
![]()
- B2: Đổi lại vị trí các phân lớp sao cho số thứ tự lớp (n) tăng dần từ trái qua phải, các phân lớp trong cùng một lớp theo thứ tự s, p, d, f.
2. Biểu diễn cấu hình electron theo orbital
Quy tắc biểu diễn:
- Viết cấu hình electron của nguyên tử
- Biểu diễn mỗi AO bằng một ô vuông (ô lượng tử)
- Điền electron vào từng orbital theo thứ tự lớp và phân lớp
Ví dụ: Cấu hình theo ô orbital của C như sau:

Như vậy nguyên tử carbon có 2 electron độc thân, thuộc AO 2p.
III. Dự đoán tính chất hóa học cơ bản của nguyên tố dựa theo cấu hình elctron của nguyên tử
Từ cấu hình electron, có thể dự đoán các tính chất này theo quy tắc sau:
- Các nguyên tử có 1, 2 hoặc 3 eletron ở lớp ngoài thường là nguyên tố kim loại => Tính khử
- Các nguyên tử có 5, 6 hoặc 7 eletron ở lớp ngoài thường là nguyên tố phi kim => tính oxi hóa
- Các nguyên tố có 8 electron ở lớp ngoài cùng (trừ He có 2 electron) là các nguyên tố khí hiếm => tính trơ (khó tham gia phản ứng hóa học)
- Nếu lớp electron ngoài cùng của một nguyên tử có 4 electron thì có thể là kim loại hoặc phi kim.
Sơ đồ tư duy