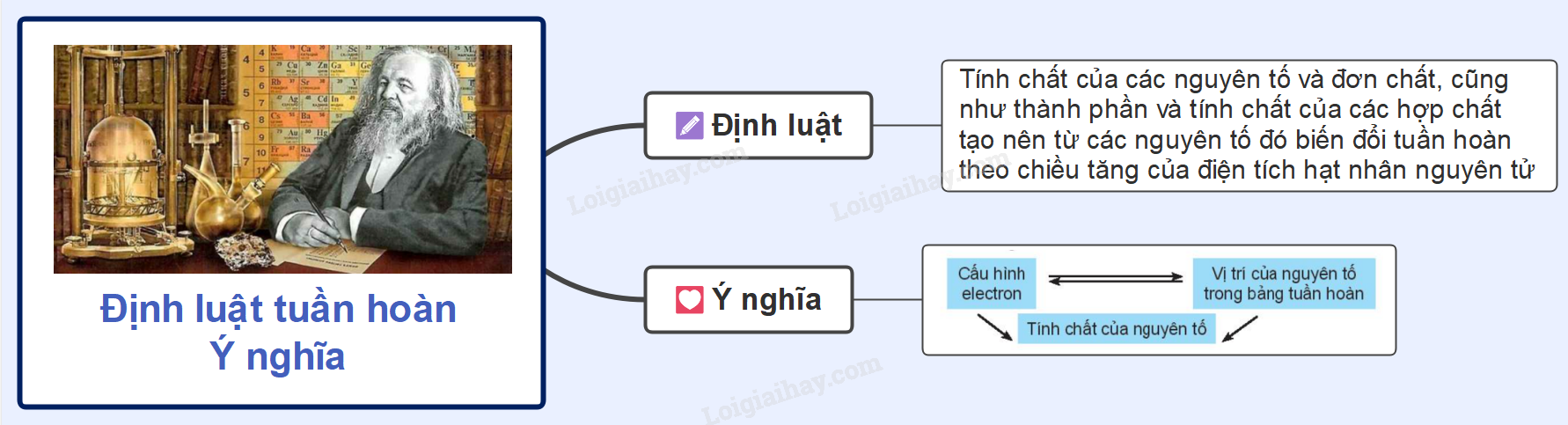
Lý thuyết bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Lý thuyết: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
I. Định luật tuần hoàn các nguyên tố hóa học
Nội dung định luật: Tính chất của các nguyên tố và đơn chất,cũng như thành phần và tính chất của hợp chất tạo nên từ các nguyên tó đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.

Kết luận:
- Các tính chất của các đơn chất, cũng như thành phần và tính chất của các hợp chất lặp đi lặp lại một cách có hệ thống và có thể dự đoán được khi các nguyên tố được sắp xếp theo thứu tự tăng dần số hiệu nguyên tử vào các chu kì và nhóm.
- Định luật tuần hoàn dẫn đến sự phát triển và hoàn thiện của bảng tuần hoàn các nguyên tố hóa học.
II. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
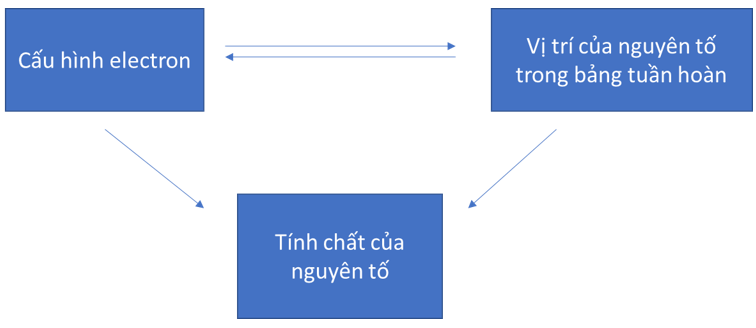
Khi biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể đưa ra dự đoán về tính chất của đơn chất cũng như hợp chất của nó.
Ví dụ 1: Nguyên tố sulfur (S) ở ô số 16, nhóm VIA, chu kì 3
- Nguyên tử S có:
+ 16 proton, 16 electron (do số proton = số electron = Z)
+ 3 lớp electron (do số lớp electron bằng số thứ tự chu kì)
+ 6 electron lớp ngoài cùng (do số electron lớp ngoài cùng bằng số thứ tự nhóm A)
=> Cấu hình electron của S: 1s 2 2s 2 2p 6 3s 2 3p 4
Sơ đồ tư duy