Trắc nghiệm Bài 1: Khái niệm về cân bằng hóa học Hóa 11 Chân trời sáng tạo
Đề bài
Cho cân bằng hóa học: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)
Cân bằng trên chuyển dịch theo chiều thuận khi:
-
A.
Tăng nhiệt độ của hệ phản ứng.
-
B.
Giảm áp suất của hệ phản ứng.
-
C.
Tăng áp suất của hệ phản ứng.
-
D.
Thêm chất xúc tác vào hệ phản ứng.
Cho cân bằng hóa học:
\({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)
Phản ứng thuận là phản ứng tỏa nhiệt. Cân bằng hóa học không bị chuyển dịch khi:
-
A.
Thay đổi áp suất của hệ
-
B.
Thay đổi nồng độ N 2
-
C.
Thay đổi nhiệt độ
-
D.
Thêm chất xúc tác Fe.
Cho cân bằng: \(2S{O_{2(k)}} + {O_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_{3(k)}}\)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này
-
A.
Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
-
B.
Phản ứng nghịch tỏa nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
-
C.
Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
-
D.
Phản ứng thuận tỏa nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Cho cân bằng hóa học sau: \(2S{O_{2(k)}} + {O_{2(k)}} \to 2S{O_{3(k)}}\); ∆H<0
Các yếu tố nào sau đây làm cân bằng chuyển dịch theo chiều thuận:
(1) Tăng nhiệt độ
(2) Hạ nhiệt độ
(3) Tăng áp suất
(4) Thêm xúc tác
(5) Tăng nồng độ SO2
(6) Tăng nồng độ SO3
-
A.
(1), (2), (4), (5)
-
B.
(2), (3), (5)
-
C.
(1), (2), (4)
-
D.
(2), (3), (4), (6)
Một bình phản ứng có dung tích không đổi, chứa hỗn hợp khí N 2 và H 2 với nồng độ tương ứng là 0,3M và 0,7M. Sau khi phản ứng tổng hợp NH 3 đạt trạng thái cân bằng ở t o C, H 2 chiếm 50% thể tích hỗn hợp thu được. Hằng số cân bằng K C ở t o C của phản ứng có giá trị là:
-
A.
2,500.
-
B.
3,125.
-
C.
0,609.
-
D.
0,500.
Cho phản ứng hóa học sau:
\({H_{2(k)}} + {I_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2H{I_{(k)}}\)
Nồng độ các chất lúc cân bằng ở nhiệt độ 430℃ như sau:
(H 2 ) = (I 2 ) = 0,107M; (HI)=0,768M
Tính hằng số cân bằng K C của phản ứng ở 430℃.
-
A.
5,51.
-
B.
51,52.
-
C.
66,87.
-
D.
67,08.
Cho cân bằng sau trong bình kín:

Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có:
-
A.
∆H>0, phản ứng tỏa nhiệt
-
B.
∆H<0, phản ứng tỏa nhiệt
-
C.
∆H>0, phản ứng thu nhiệt
-
D.
∆H<0, phản ứng thu nhiệt
Cho cân bằng hóa học: \({H_{2(k)}} + {I_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2H{I_{(k)}}\)∆H>0.
Cân bằng không bị chuyển dịch khi:
-
A.
Tăng nhiệt độ của hệ.
-
B.
Giảm nồng độ HI
-
C.
Tăng nồng độ H 2
-
D.
Giảm áp suất chung của hệ.
Cho cân bằng hóa học sau: \(2S{O_{2(k)}} + {O_{2(k)}} \to 2S{O_{3(k)}}\); ∆H<0
Yếu tố nào sau đây làm cân bằng chuyển dịch theo chiều thuận
(1) tăng nhiệt độ
(2) hạ nhiệt độ
(3) tăng áp suất
(4) giảm nồng độ SO2
(5) tăng nồng độ SO2
(6) thêm chất xúc tác
-
A.
(1), (2), (4), (5)
-
B.
(2), (3), (5)
-
C.
(1), (2), (4)
-
D.
(2), (3), (4), (6)
Một bình phản ứng có dung tích không đổi, chứa hỗn hợp khí N 2 và H 2 với nồng độ tương ứng là 0,3M và 0,7M. Sau khi phản ứng tổng hợp NH 3 đạt trạng thái cân bằng ở t o C, H 2 chiếm 50% thể tích hỗn hợp thu được. Hằng số cân bằng K C ở t o C của phản ứng có giá trị là:
-
A.
2,500.
-
B.
3,125.
-
C.
0,609.
-
D.
0,500.
Cho cân bằng hóa học:
\({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)
Phản ứng thuận là phản ứng tỏa nhiệt. Cân bằng hóa học không bị chuyển dịch khi:
-
A.
Thay đổi áp suất của hệ
-
B.
Thay đổi nồng độ N 2
-
C.
Thay đổi nhiệt độ
-
D.
Thêm chất xúc tác Fe.
Cho cân bằng: \(2S{O_{2(k)}} + {O_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_{3(k)}}\)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này
-
A.
Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
-
B.
Phản ứng nghịch tỏa nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
-
C.
Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
-
D.
Phản ứng thuận tỏa nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Dãy chất nào sau đây, trong nước đều là chất điện li mạnh?
-
A.
H 2 SO 4 , Cu(NO 3 ) 2 , CaCl 2 , H 2 S
-
B.
HCl, H 3 PO 4 , Fe(NO 3 ) 3 , NaOH
-
C.
HNO 3 , CH 3 COOH, BaCl 2 , KOH
-
D.
H 2 SO 4 , MgCl 2 , Al 2 (SO 4 ) 3 , Ba(OH) 2
Chất nào dưới đây không phân li ra ion khi hòa tan trong nước?
-
A.
MgCl 2
-
B.
Ba(OH) 2
-
C.
HClO 3
-
D.
C 6 H 12 O 6 (glucose)
Lời giải và đáp án
Cho cân bằng hóa học: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)
Cân bằng trên chuyển dịch theo chiều thuận khi:
-
A.
Tăng nhiệt độ của hệ phản ứng.
-
B.
Giảm áp suất của hệ phản ứng.
-
C.
Tăng áp suất của hệ phản ứng.
-
D.
Thêm chất xúc tác vào hệ phản ứng.
Đáp án : C
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Cân bằng sẽ chuyển dịch theo chiều thuận khi tăng áp suất của hệ phản ứng, bởi vì tổng số mol khí trước phản ứng lớn hơn tổng số mol khí sau phản ứng.
Cho cân bằng hóa học:
\({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)
Phản ứng thuận là phản ứng tỏa nhiệt. Cân bằng hóa học không bị chuyển dịch khi:
-
A.
Thay đổi áp suất của hệ
-
B.
Thay đổi nồng độ N 2
-
C.
Thay đổi nhiệt độ
-
D.
Thêm chất xúc tác Fe.
Đáp án : D
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Ta có: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) (∆H<0)
Chất xúc tác chỉ làm tăng tốc độ phản ứng chứ không làm thay đổi cân bằng.
Cho cân bằng: \(2S{O_{2(k)}} + {O_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_{3(k)}}\)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này
-
A.
Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
-
B.
Phản ứng nghịch tỏa nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
-
C.
Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
-
D.
Phản ứng thuận tỏa nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Đáp án : D
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Khi tăng nhiệt độ tỉ khối của hỗn hợp khí so với H 2 giảm đi chứng tỏ phản ứng dịch theo chiều nghịch. Vì vậy, đây là phản ứng tỏa nhiệt.
Cho cân bằng hóa học sau: \(2S{O_{2(k)}} + {O_{2(k)}} \to 2S{O_{3(k)}}\); ∆H<0
Các yếu tố nào sau đây làm cân bằng chuyển dịch theo chiều thuận:
(1) Tăng nhiệt độ
(2) Hạ nhiệt độ
(3) Tăng áp suất
(4) Thêm xúc tác
(5) Tăng nồng độ SO2
(6) Tăng nồng độ SO3
-
A.
(1), (2), (4), (5)
-
B.
(2), (3), (5)
-
C.
(1), (2), (4)
-
D.
(2), (3), (4), (6)
Đáp án : B
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Dựa vào phản ứng: \(2S{O_{2(k)}} + {O_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_{3(k)}}\); ∆H<0
-Đây là một phản ứng tỏa nhiệt (∆H<0).
-Có sự chênh lệch số mol trước và sau phản ứng.
Vì vậy các yếu tố làm cân bằng chuyển dịch theo chiều thuận là:
+Hạ nhiệt độ (2)
+Tăng áp suất (3)
+Tăng nồng độ SO 2 (5)
Một bình phản ứng có dung tích không đổi, chứa hỗn hợp khí N 2 và H 2 với nồng độ tương ứng là 0,3M và 0,7M. Sau khi phản ứng tổng hợp NH 3 đạt trạng thái cân bằng ở t o C, H 2 chiếm 50% thể tích hỗn hợp thu được. Hằng số cân bằng K C ở t o C của phản ứng có giá trị là:
-
A.
2,500.
-
B.
3,125.
-
C.
0,609.
-
D.
0,500.
Đáp án : B
Dựa vào kiến thức về hằng số cân bằng.
aA + bB → cC + dD
Ở trạng thái cân bằng, hằng số cân bằng K C của phản ứng được xác định theo biểu thức:
\({K_C} = \frac{{{{{\rm{(}}C{\rm{)}}}^{\rm{c}}}{{{\rm{(}}D{\rm{)}}}^d}}}{{{{{\rm{(}}A)}^a}{{(B{\rm{)}}}^b}}}\)
Ta có: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)(1)
Gọi (N 2 ) phản ứng là a => theo phản ứng (1): (H 2 ) phản ứng là 3a; (NH 3 ) phản ứng là 2a.
Ở trạng thái cân bằng: (N 2 ) = 0,3-a; (H 2 ) = 0,7-a
Để đơn giản ta xét 1 lít hỗn hợp.
Sau khi phản ứng cân bằng: 0,3 – a + 0,7 – 3a + 2a= 1 – 2a
Mặt khác % thể tích H2 = 50% = \(\frac{{0,7 - 3a}}{{1 - 2a}}\).100 => a = 0,1.
Khi đạt cân bằng (N 2 ) = 0,3 – 0,1 = 0,2 (M)
(H 2 ) = 0,7 – 0,3 = 0,4 (M)
(NH 3 ) = 0,2 (M).
Vậy \({K_C} = \frac{{{{{\rm{(0,2)}}}^2}}}{{{\rm{(0,2}}){{{\rm{(}}0,4)}^3}}} = \)= 3,125
Cho phản ứng hóa học sau:
\({H_{2(k)}} + {I_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2H{I_{(k)}}\)
Nồng độ các chất lúc cân bằng ở nhiệt độ 430℃ như sau:
(H 2 ) = (I 2 ) = 0,107M; (HI)=0,768M
Tính hằng số cân bằng K C của phản ứng ở 430℃.
-
A.
5,51.
-
B.
51,52.
-
C.
66,87.
-
D.
67,08.
Đáp án : B
Dựa vào kiến thức về hằng số cân bằng.
aA + bB → cC + dD
Ở trạng thái cân bằng, hằng số cân bằng K C của phản ứng được xác định theo biểu thức:
\({K_C} = \frac{{{{{\rm{(}}C{\rm{)}}}^{\rm{c}}}{{{\rm{(}}D{\rm{)}}}^d}}}{{{{{\rm{(}}A)}^a}{{(B{\rm{)}}}^b}}}\)
Ta có: \({K_C} = \frac{{{{{\rm{(HI)}}}^2}}}{{{\rm{(}}{H_2})({I_2}{\rm{)}}}}\)
Thay các giá trị (HI) = 0,768M; (H 2 ) = (I 2 ) = 0,107M
Vậy \({K_C} = \frac{{{{{\rm{(0,768)}}}^2}}}{{{{{\rm{(0,107}})}^2}}}\)= 51,52
Cho cân bằng sau trong bình kín:

Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có:
-
A.
∆H>0, phản ứng tỏa nhiệt
-
B.
∆H<0, phản ứng tỏa nhiệt
-
C.
∆H>0, phản ứng thu nhiệt
-
D.
∆H<0, phản ứng thu nhiệt
Đáp án : B
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
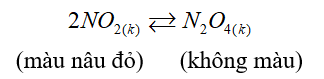
Khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần, chứng tỏ phản ứng xảy ra theo chiều thuận, vì vậy phản ứng trên là phản ứng tỏa nhiệt (∆H<0).
Cho cân bằng hóa học: \({H_{2(k)}} + {I_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2H{I_{(k)}}\)∆H>0.
Cân bằng không bị chuyển dịch khi:
-
A.
Tăng nhiệt độ của hệ.
-
B.
Giảm nồng độ HI
-
C.
Tăng nồng độ H 2
-
D.
Giảm áp suất chung của hệ.
Đáp án : D
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Từ phản ứng \({H_{2(k)}} + {I_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2H{I_{(k)}}\)∆H>0.
-Đây là phản ứng thu nhiệt (∆H>0)
-Tổng số mol trước khi phản ứng = Tổng số mol sau khi phản ứng => Áp suất chung của hệ không làm thay đổi đến sự chuyển dịch cân bằng hóa học.
Cho cân bằng hóa học sau: \(2S{O_{2(k)}} + {O_{2(k)}} \to 2S{O_{3(k)}}\); ∆H<0
Yếu tố nào sau đây làm cân bằng chuyển dịch theo chiều thuận
(1) tăng nhiệt độ
(2) hạ nhiệt độ
(3) tăng áp suất
(4) giảm nồng độ SO2
(5) tăng nồng độ SO2
(6) thêm chất xúc tác
-
A.
(1), (2), (4), (5)
-
B.
(2), (3), (5)
-
C.
(1), (2), (4)
-
D.
(2), (3), (4), (6)
Đáp án : B
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Dựa vào phản ứng: \(2S{O_{2(k)}} + {O_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_{3(k)}}\); ∆H<0
-Đây là một phản ứng tỏa nhiệt (∆H<0).
-Có sự chênh lệch số mol trước và sau phản ứng.
Vì vậy các yếu tố làm cân bằng chuyển dịch theo chiều thuận là:
+Hạ nhiệt độ (2)
+Tăng áp suất (3)
+Tăng nồng độ SO 2 (5)
Một bình phản ứng có dung tích không đổi, chứa hỗn hợp khí N 2 và H 2 với nồng độ tương ứng là 0,3M và 0,7M. Sau khi phản ứng tổng hợp NH 3 đạt trạng thái cân bằng ở t o C, H 2 chiếm 50% thể tích hỗn hợp thu được. Hằng số cân bằng K C ở t o C của phản ứng có giá trị là:
-
A.
2,500.
-
B.
3,125.
-
C.
0,609.
-
D.
0,500.
Đáp án : B
Dựa vào kiến thức về hằng số cân bằng.
aA + bB → cC + dD
Ở trạng thái cân bằng, hằng số cân bằng K C của phản ứng được xác định theo biểu thức:
\({K_C} = \frac{{{{{\rm{(}}C{\rm{)}}}^{\rm{c}}}{{{\rm{(}}D{\rm{)}}}^d}}}{{{{{\rm{(}}A)}^a}{{(B{\rm{)}}}^b}}}\)
Ta có: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)(1)
Gọi (N 2 ) phản ứng là a => theo phản ứng (1): (H 2 ) phản ứng là 3a; (NH 3 ) phản ứng là 2a.
Ở trạng thái cân bằng: (N 2 ) = 0,3-a; (H 2 ) = 0,7-a
Để đơn giản ta xét 1 lít hỗn hợp.
Sau khi phản ứng cân bằng: 0,3 – a + 0,7 – 3a + 2a= 1 – 2a
Mặt khác % thể tích H2 = 50% = \(\frac{{0,7 - 3a}}{{1 - 2a}}\).100 => a = 0,1.
Khi đạt cân bằng (N 2 ) = 0,3 – 0,1 = 0,2 (M)
(H 2 ) = 0,7 – 0,3 = 0,4 (M)
(NH 3 ) = 0,2 (M).
Vậy \({K_C} = \frac{{{{{\rm{(0,2)}}}^2}}}{{{\rm{(0,2}}){{{\rm{(}}0,4)}^3}}} = \)= 3,125
Cho cân bằng hóa học:
\({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)
Phản ứng thuận là phản ứng tỏa nhiệt. Cân bằng hóa học không bị chuyển dịch khi:
-
A.
Thay đổi áp suất của hệ
-
B.
Thay đổi nồng độ N 2
-
C.
Thay đổi nhiệt độ
-
D.
Thêm chất xúc tác Fe.
Đáp án : D
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Ta có: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) (∆H<0)
Chất xúc tác chỉ làm tăng tốc độ phản ứng chứ không làm thay đổi cân bằng.
Cho cân bằng: \(2S{O_{2(k)}} + {O_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_{3(k)}}\)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này
-
A.
Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
-
B.
Phản ứng nghịch tỏa nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
-
C.
Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
-
D.
Phản ứng thuận tỏa nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Đáp án : D
Phương pháp: Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Khi tăng nhiệt độ tỉ khối của hỗn hợp khí so với H 2 giảm đi chứng tỏ phản ứng dịch theo chiều nghịch. Vì vậy, đây là phản ứng tỏa nhiệt.
Dãy chất nào sau đây, trong nước đều là chất điện li mạnh?
-
A.
H 2 SO 4 , Cu(NO 3 ) 2 , CaCl 2 , H 2 S
-
B.
HCl, H 3 PO 4 , Fe(NO 3 ) 3 , NaOH
-
C.
HNO 3 , CH 3 COOH, BaCl 2 , KOH
-
D.
H 2 SO 4 , MgCl 2 , Al 2 (SO 4 ) 3 , Ba(OH) 2
Đáp án : D
Dựa vào kiến thức về chất điện li mạnh
Đáp án D
A sai vì H 2 S là chất điện li yếu
B sai vì H 3 PO 4 là chất điện li yếu
C sai vì CH 3 COOH là chất điện li yếu
Chất nào dưới đây không phân li ra ion khi hòa tan trong nước?
-
A.
MgCl 2
-
B.
Ba(OH) 2
-
C.
HClO 3
-
D.
C 6 H 12 O 6 (glucose)
Đáp án : D
Dựa vào kiến thức về phân loại chất điện li
Đáp án D đúng