Trắc nghiệm Bài 4: Amomnia và một số hợp chất ammonium Hóa 11 Chân trời sáng tạo
Đề bài
Cho các phát biểu sau:
- Ammonia lỏng được dùng làm chất làm lạnh trong thiết bị.
- Để làm khô khí NH 3 có lẫn hơi nước, cho khí NH 3 đi qua bình đựng dung dịch H 2 SO 4 đậm đặc.
- Khi cho quỳ tím ẩm vào lọ đựng khí NH 3 , quỳ tím chuyển thành màu đỏ.
- Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học.
-
A.
2.
-
B.
1.
-
C.
4.
-
D.
3.
Bình cầu chứa đầy khí ammonia khô, được úp ngược lên một chậu chứa dung dịch HCl loãng pha dung dịch quỳ có màu hồng. Nước phun lên trong bình cầu và dung dịch trong bình cầu chuyển thành màu xanh. Hiện tượng này xảy ra vì?
-
A.
Acid đã phản ứng với ammonia, làm quỳ đổi màu từ hồng sang xanh.
-
B.
Ammonia là acid yếu, làm quỳ chuyển màu xanh.
-
C.
Ammonia có tính base, tan trong nước nên áp suất giảm, nhờ đó nước có thể phun lên.
-
D.
Acid đã phản ứng khí ammonia trong bình nên áp suất giảm, nhờ đó nước có thể phun lên.
Cho hỗn hợp N 2 và H 2 vào bình phản ứng có nhiệt độ không đổi. Sau thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết ti lệ số mol của nitrogen đã phản ứng là 15%. Thành phần phần trăm về số mol của N 2 và H 2 trong hỗn hợp đầu?
-
A.
20% và 80%.
-
B.
16,67 và 83,33%.
-
C.
25% và 75%.
-
D.
40% và 60%.
Trong phân tử NH 3 chứa liên kết?
-
A.
Liên kết cho nhận.
-
B.
Liên kết cộng hóa trị không phân cực.
-
C.
Liên kết cộng hóa trị phân cực.
-
D.
Liên kết Ion.
Phải dùng bao nhiêu lít khí Nitrogen và bao nhiêu lít khí Hydrogen để điều chế 17,0 gam NH 3 ? Biết răng hiệu suất phản ứng tổng hợp NH 3 là 20%. Các thể tích khí được đo ở đktc.
-
A.
11,2 lít N 2 và 33,6 lít H 2 .
-
B.
11,2 lít N 2 và 168 lít H 2 .
-
C.
56 lít N 2 và 168 lít H 2 .
-
D.
33,6 lít N 2 và 11,2 lít H 2 .
Cho cân bằng hóa học: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) ∆H = -92 kJ. Khi giảm thể tích của hỗn hợp ở trạng thái cân bằng khi nhiệt độ không đổi thì cân bằng sẽ chuyển dịch:
-
A.
Theo chiều phản ứng nghịch.
-
B.
Theo chiều phản ứng thuận.
-
C.
Không làm chuyển dịch cân bằng.
-
D.
Tùy theo mức độ giảm thể tích mà cân bằng chuyển dịch theo chiều thuận hay chiều nghịch.
NH3 thể hiện tính khử trong phản ứng hóa học nào trong các phản ứng hóa học sau?
-
A.
2NH 3 + H 2 O--> NH 4 + + OH - .
-
B.
3NH 3 + AlCl 3 + 3H 2 O → Al(OH) 3 + 3NH 4 Cl.
-
C.
2NH 3 + 3CuO → N 2 + 3Cu + 3H 2 O.
-
D.
NH 3 + HCl → NH 4 Cl.
Nhận xét nào sau đây về NH 3 là đủ nhất?
-
A.
NH 3 là một base.
-
B.
NH 3 là một chất khử.
-
C.
NH 3 vừa có tính khử của một chất khử vừa có tính chất của một base.
-
D.
NH 3 chỉ có tính base và tính khử mà không thể hiện tính oxi hóa.
Để tách riêng NH 3 ra khỏi hỗn hợp gồm N 2 , H 2 , NH 3 trong công nghiệp, người ta đã:
-
A.
Cho hỗn hợp qua nước vôi trong dư.
-
B.
Cho hỗn hợp qua bột CuO nung nóng.
-
C.
Nén và làm lạnh hỗn hợp để hóa lỏng NH 3 .
-
D.
Cho hỗn hợp qua dung dịch H 2 SO 4 đặc.
Trong các phản ứng sau, phản ứng nào NH 3 đóng vai trò là một chất oxi hóa?
-
A.
2NH 3 + H 2 O 2 + MnSO 4 → MnO 2 + (NH 4 ) 2 SO 4 .
-
B.
2NH 3 + 3Cl 2 → N 2 + 6HCl.
-
C.
4NH 3 + 5O 2 → 4NO+ 6H 2 O.
-
D.
2NH 3 + 2Na → 2NaNO 3 + H 2 .
Hợp chất X tan trong nước tạo dung dịch không màu. Dung dịch này không tạo kết tủa với dung dịch BaCl 2 , khi phản ứng với NaOH tạo ra khí có mùi khai, khi phản ứng với dung dịch HCl tạo ra khí làm đục nước vôi trong và làm mất màu dung dịch thuốc tím. Chất này là
-
A.
NH 4 HSO 3 .
-
B.
Na 2 SO 3 .
-
C.
NH 4 HCO 3 .
-
D.
(NH 4 ) 2 CO 3 .
Phản ứng giữa NH 3 với chất nào sau đây chứng minh NH 3 thể hiện tính base
-
A.
Cl 2 .
-
B.
O 2 .
-
C.
HCl.
-
D.
CuO.
Chất nào sau đây có thể làm khô khí NH 3 có lẫn hơi nước?
-
A.
P 2 O 5 .
-
B.
H 2 SO 4 đặc .
-
C.
CuO bột.
-
D.
NaOH rắn.
Nhận xét nào sau đây không đúng về muối ammonium?
-
A.
Muối ammonium bền với nhiệt.
-
B.
Các muối ammonium đều là chất điện li mạnh.
-
C.
Tất cả các muối ammonium đều tan trong nước.
-
D.
Các muối ammonium đều bị thủy phân trong nước.
Dãy các chất đều phản ứng với NH 3 trong điều kiện thích hợp là :
-
A.
HCl, O 2 , Cl 2 , FeCl 3 .
-
B.
H 2 SO 4 , Ba(OH) 2 , FeO, NaOH.
-
C.
HCl, HNO 3 , AlCl 3 , CaO.
-
D.
KOH, HNO 3 , CuO, CuCl 2 .
Muối được làm bột nở trong thực phẩm là:
-
A.
(NH 4 ) 2 CO 3 .
-
B.
Na 2 CO 3 .
-
C.
NH 4 HCO 3 .
-
D.
NH 4 Cl.
Trong quá trình tổng hợp ammonia theo quy trình Haber (Haber – Bosch), sau khi đã hóa lỏng NH3, hydrogen và nitrogen sẽ:
-
A.
Qua ống dẫn khí thải được loại bổ
-
B.
Đưa trở lại buồng phản ứng để tái sử dụng
-
C.
Tiếp tục qua lò phản ứng số 2 để tăng hiệu suất tổng hợp
-
D.
Hygrogen được tái sử dụng, còn nitrogen loại bỏ dựa vào tỉ trọng
Phương trình phân ly của NH3 trong nước nào sau đây đúng:
-
A.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_3}O{H^ - }(aq) + {H^ + }(aq)\)
-
B.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_2}^ - (aq) + {H_3}{O^ + }(aq)\)
-
C.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_4}^ + (aq) + O{H^ - }(aq)\)
-
D.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_4}OH(l)\)
Tính base của NH 3 do:
-
A.
Trên N còn cặp electron tự do
-
B.
Phân tử có 3 liên kết cộng hóa trị phân cực
-
C.
NH 3 tan được nhiều trong nước
-
D.
NH 3 tác dụng với nước tạo NH 4 OH
Phát biểu nào sau đây không đúng khi nói về ammonia?
-
A.
Trong công nghiệp, ammoina thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn)
-
B.
Do có hàm lượng nitrogen cao (82,35% theo khối lượng) nên ammonia được sử dụng làm phân đạm rất hiệu quả
-
C.
Phần lớn ammonia được dùng phản ứng với acid để sản xuất các loại phân đạm
-
D.
Qúa trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%
Lời giải và đáp án
Cho các phát biểu sau:
- Ammonia lỏng được dùng làm chất làm lạnh trong thiết bị.
- Để làm khô khí NH 3 có lẫn hơi nước, cho khí NH 3 đi qua bình đựng dung dịch H 2 SO 4 đậm đặc.
- Khi cho quỳ tím ẩm vào lọ đựng khí NH 3 , quỳ tím chuyển thành màu đỏ.
- Nitrogen lỏng được dùng để bảo quản máu và các mẫu vật sinh học.
-
A.
2.
-
B.
1.
-
C.
4.
-
D.
3.
Đáp án : A
Dựa vào kiến thức về Ammonia và Nitrogen.
Ammonia có tính base => làm quỳ chuyển màu xanh và không thể làm khô bằng dung dịch H 2 SO 4 đậm đặc.
H 2 SO 4 + 2NH 3 -> (NH 4 ) 2 SO 4
Bình cầu chứa đầy khí ammonia khô, được úp ngược lên một chậu chứa dung dịch HCl loãng pha dung dịch quỳ có màu hồng. Nước phun lên trong bình cầu và dung dịch trong bình cầu chuyển thành màu xanh. Hiện tượng này xảy ra vì?
-
A.
Acid đã phản ứng với ammonia, làm quỳ đổi màu từ hồng sang xanh.
-
B.
Ammonia là acid yếu, làm quỳ chuyển màu xanh.
-
C.
Ammonia có tính base, tan trong nước nên áp suất giảm, nhờ đó nước có thể phun lên.
-
D.
Acid đã phản ứng khí ammonia trong bình nên áp suất giảm, nhờ đó nước có thể phun lên.
Đáp án : D
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Ban đầu trong bình chứa đầy khí NH3 khô nên không có sự chênh lệch áp suất nên nước không phun được vào bình
Ammonia có tính base vì vậy phản ứng được với acid tạo muối dạng dung dịch nên làm giảm khí -> giảm áp suất trong bình
PTHH: HCl + NH 3 -> NH 4 Cl
Do vậy áp suất trong bình giảm, nhờ đó nước có thể phun lên
Cho hỗn hợp N 2 và H 2 vào bình phản ứng có nhiệt độ không đổi. Sau thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết ti lệ số mol của nitrogen đã phản ứng là 15%. Thành phần phần trăm về số mol của N 2 và H 2 trong hỗn hợp đầu?
-
A.
20% và 80%.
-
B.
16,67 và 83,33%.
-
C.
25% và 75%.
-
D.
40% và 60%.
Đáp án : B
Dựa vào kiến thức về Sản xuất Ammonia.
Gọi số mol ban đầu của N 2 và H 2 lần lượt là x; y.
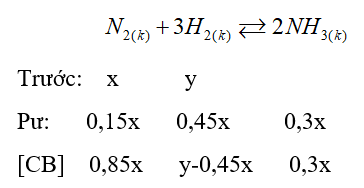
\(\frac{{{P_t}}}{{{P_s}}} = \frac{{{n_t}}}{{{n_s}}}\)=> \(\frac{{{P_t}}}{{0,95{P_t}}} = \frac{{x + y}}{{0,7x + y}}\) => 0,7x + y = 0,95(x + y)
=>y = 5x
%n N2 = \(\frac{x}{{x + y}}.100\% = \frac{x}{{x + 5x}}.100\% \)= 16,67%
%n H2 = 100% - 16,67% = 83,33%
Trong phân tử NH 3 chứa liên kết?
-
A.
Liên kết cho nhận.
-
B.
Liên kết cộng hóa trị không phân cực.
-
C.
Liên kết cộng hóa trị phân cực.
-
D.
Liên kết Ion.
Đáp án : C
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Trong phân tử ammonia, liên kết N-H phân cực, cặp electron dùng chung lệch về nguyên tử nitrogen làm cho nguyên tử hydrogen mang một phần điện tích dương.
Phải dùng bao nhiêu lít khí Nitrogen và bao nhiêu lít khí Hydrogen để điều chế 17,0 gam NH 3 ? Biết răng hiệu suất phản ứng tổng hợp NH 3 là 20%. Các thể tích khí được đo ở đktc.
-
A.
11,2 lít N 2 và 33,6 lít H 2 .
-
B.
11,2 lít N 2 và 168 lít H 2 .
-
C.
56 lít N 2 và 168 lít H 2 .
-
D.
33,6 lít N 2 và 11,2 lít H 2 .
Đáp án : C
Dựa vào kiến thức về Sản xuất Ammonia.
n NH3 = \(\frac{{17}}{{17}}\) = 1 mol
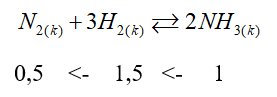
H = 20% => V H2 = \(\frac{{1,5.22,4.100}}{{20}}\) = 168 (lít)
V N2 = \(\frac{{0,5.22,4.100}}{{20}}\)= 56 (lít)
Cho cân bằng hóa học: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) ∆H = -92 kJ. Khi giảm thể tích của hỗn hợp ở trạng thái cân bằng khi nhiệt độ không đổi thì cân bằng sẽ chuyển dịch:
-
A.
Theo chiều phản ứng nghịch.
-
B.
Theo chiều phản ứng thuận.
-
C.
Không làm chuyển dịch cân bằng.
-
D.
Tùy theo mức độ giảm thể tích mà cân bằng chuyển dịch theo chiều thuận hay chiều nghịch.
Đáp án : B
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Khi giảm thể tích hỗn hợp => áp suất hỗn hợp tăng => cân bằng chuyển dịch theo chiều giảm số mol khí (chiều thuận).
NH3 thể hiện tính khử trong phản ứng hóa học nào trong các phản ứng hóa học sau?
-
A.
2NH 3 + H 2 O--> NH 4 + + OH - .
-
B.
3NH 3 + AlCl 3 + 3H 2 O → Al(OH) 3 + 3NH 4 Cl.
-
C.
2NH 3 + 3CuO → N 2 + 3Cu + 3H 2 O.
-
D.
NH 3 + HCl → NH 4 Cl.
Đáp án : C
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
NH 3 thể hiện tính khử trong phản ứng:
\(2\mathop N\limits^{ - 3} {H_3}\; + {\rm{ }}3CuO\;{\rm{ }}\; \to \;{\rm{ }}\;{\mathop N\limits^0 _2} + {\rm{ }}3Cu{\rm{ }} + {\rm{ }}3{H_2}O\)
Nhận xét nào sau đây về NH 3 là đủ nhất?
-
A.
NH 3 là một base.
-
B.
NH 3 là một chất khử.
-
C.
NH 3 vừa có tính khử của một chất khử vừa có tính chất của một base.
-
D.
NH 3 chỉ có tính base và tính khử mà không thể hiện tính oxi hóa.
Đáp án : D
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Trong phân tử ammonia, nguyên tử nitrogen có số oxi là -3 (số oxi hóa thấp nhất của nitrogen) nên ammonia chỉ thể hiện tính khử.
Để tách riêng NH 3 ra khỏi hỗn hợp gồm N 2 , H 2 , NH 3 trong công nghiệp, người ta đã:
-
A.
Cho hỗn hợp qua nước vôi trong dư.
-
B.
Cho hỗn hợp qua bột CuO nung nóng.
-
C.
Nén và làm lạnh hỗn hợp để hóa lỏng NH 3 .
-
D.
Cho hỗn hợp qua dung dịch H 2 SO 4 đặc.
Đáp án : C
Dựa vào kiến thức về Tính chất vật lý của Ammonia.
Ammonia dễ hóa lỏng, hóa lỏng ở -33,3℃.
Trong các phản ứng sau, phản ứng nào NH 3 đóng vai trò là một chất oxi hóa?
-
A.
2NH 3 + H 2 O 2 + MnSO 4 → MnO 2 + (NH 4 ) 2 SO 4 .
-
B.
2NH 3 + 3Cl 2 → N 2 + 6HCl.
-
C.
4NH 3 + 5O 2 → 4NO+ 6H 2 O.
-
D.
2NH 3 + 2Na → 2NaNO 3 + H 2 .
Đáp án : D
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Hợp chất X tan trong nước tạo dung dịch không màu. Dung dịch này không tạo kết tủa với dung dịch BaCl 2 , khi phản ứng với NaOH tạo ra khí có mùi khai, khi phản ứng với dung dịch HCl tạo ra khí làm đục nước vôi trong và làm mất màu dung dịch thuốc tím. Chất này là
-
A.
NH 4 HSO 3 .
-
B.
Na 2 SO 3 .
-
C.
NH 4 HCO 3 .
-
D.
(NH 4 ) 2 CO 3 .
Đáp án : A
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
- X+ NaOH sinh ra khí có mùi khai → cation là NH 4 +
- Dung dịch X không tạo kết tủa với dung dịch BaCl 2 → gốc axit không thể là SO 4 2− ,CO 3 2− ,SO 3 2−
- Dung dịch X + HCl sinh ra khí làm đục nước vôi trong và làm mất màu dung dịch thuốc tím → anion là HSO 3 − .
→ X là NH 4 HSO 3 .
Phản ứng giữa NH 3 với chất nào sau đây chứng minh NH 3 thể hiện tính base
-
A.
Cl 2 .
-
B.
O 2 .
-
C.
HCl.
-
D.
CuO.
Đáp án : C
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
HCl + NH 3 -> NH 4 Cl => Chọn C
Chất nào sau đây có thể làm khô khí NH 3 có lẫn hơi nước?
-
A.
P 2 O 5 .
-
B.
H 2 SO 4 đặc .
-
C.
CuO bột.
-
D.
NaOH rắn.
Đáp án : D
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
Chất dùng làm khô khí NH 3 có lẫn hơi nước phải là chất có đặc tính hút nước và không phản ứng với NH 3 .
→ Dùng NaOH rắn để làm khô khí
Nhận xét nào sau đây không đúng về muối ammonium?
-
A.
Muối ammonium bền với nhiệt.
-
B.
Các muối ammonium đều là chất điện li mạnh.
-
C.
Tất cả các muối ammonium đều tan trong nước.
-
D.
Các muối ammonium đều bị thủy phân trong nước.
Đáp án : A
Dựa vào kiến thức về Muối ammonium.
Các muối ammonium đều kém bền nhiệt và dễ bị phân hủy khi nung nóng
Dãy các chất đều phản ứng với NH 3 trong điều kiện thích hợp là :
-
A.
HCl, O 2 , Cl 2 , FeCl 3 .
-
B.
H 2 SO 4 , Ba(OH) 2 , FeO, NaOH.
-
C.
HCl, HNO 3 , AlCl 3 , CaO.
-
D.
KOH, HNO 3 , CuO, CuCl 2 .
Đáp án : A
Dựa vào kiến thức về Tính chất hóa học của Ammonia.
HCl + NH 3 -> NH 4 Cl
Cl 2 + NH 3 -> NH 4 Cl + N 2
FeCl 3 + NH 3 + H 2 O -> Fe(OH) 3 + 3NH 4 Cl
Muối được làm bột nở trong thực phẩm là:
-
A.
(NH 4 ) 2 CO 3 .
-
B.
Na 2 CO 3 .
-
C.
NH 4 HCO 3 .
-
D.
NH 4 Cl.
Đáp án : C
Dựa vào kiến thức về Ứng dụng của muối Ammonium.
Trong quá trình tổng hợp ammonia theo quy trình Haber (Haber – Bosch), sau khi đã hóa lỏng NH3, hydrogen và nitrogen sẽ:
-
A.
Qua ống dẫn khí thải được loại bổ
-
B.
Đưa trở lại buồng phản ứng để tái sử dụng
-
C.
Tiếp tục qua lò phản ứng số 2 để tăng hiệu suất tổng hợp
-
D.
Hygrogen được tái sử dụng, còn nitrogen loại bỏ dựa vào tỉ trọng
Đáp án : B
Dựa vào kiến thức về quy trình Haber để tổng hợp ammonia
Tại thời điểm cân bằng nồng độ ammonia, nitrigen, hydrogen trong buồng phản ứng không đổi. Hỗn hợp khí này được dẫn qua hệ thống làm lạnh để hóa lỏng ammonia, còn hỗn hợp nitrogen và hydrogen được tái sử dụng bằng cách đưa trở lại buồng phản ứng.
Phương trình phân ly của NH3 trong nước nào sau đây đúng:
-
A.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_3}O{H^ - }(aq) + {H^ + }(aq)\)
-
B.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_2}^ - (aq) + {H_3}{O^ + }(aq)\)
-
C.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_4}^ + (aq) + O{H^ - }(aq)\)
-
D.
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_4}OH(l)\)
Đáp án : C
Dựa vào phương trình phân li của NH3 trong nước
\(N{H_3}(aq) + {H_2}O(l) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{H_4}^ + (aq) + O{H^ - }(aq)\)
Tính base của NH 3 do:
-
A.
Trên N còn cặp electron tự do
-
B.
Phân tử có 3 liên kết cộng hóa trị phân cực
-
C.
NH 3 tan được nhiều trong nước
-
D.
NH 3 tác dụng với nước tạo NH 4 OH
Đáp án : A
Dựa vào kiến thức thuyết Bronsted – Lowy về acid và base
Theo thuyết Bronsted – Lowy về base là chất có khả năng nhận proton H + , tức là phân tử NH 3 còn cặp electron tự do để nhận proton H + thể hiện tính base.
Phát biểu nào sau đây không đúng khi nói về ammonia?
-
A.
Trong công nghiệp, ammoina thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn)
-
B.
Do có hàm lượng nitrogen cao (82,35% theo khối lượng) nên ammonia được sử dụng làm phân đạm rất hiệu quả
-
C.
Phần lớn ammonia được dùng phản ứng với acid để sản xuất các loại phân đạm
-
D.
Qúa trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100%
Đáp án : B
Dựa vào kiến thức về ammonia
B sai do ammonia là nguyên liệu để sản xuất phân đạm.