Đề thi học kì 1 Hóa 11 Cánh diều - Đề số 6
Chất nào dưới đây là chất điện li?
Đề bài
Chất nào dưới đây là chất điện li?
-
A.
C 12 H 22 O 11 .
-
B.
C 2 H 6 .
-
C.
BaSO 4 .
-
D.
HCN.
Cho cân bằng hóa học: CO(g) + H 2 O (g) ⇌ CO 2 (g) + H 2 (g). Nếu lúc đầu chỉ có CO và hơi nước với nồng độ C CO = 0,1M, C H2O = 0,4M, K C = 1 thì nồng độ cân bằng của CO 2 là
-
A.
0,08.
-
B.
0,06.
-
C.
0,05.
-
D.
0,1.
Cho cân bằng hóa học:
2NO 2 (g) ⇌ N 2 O 4 ∆ r H < 0
Nâu đỏ không màu
Khi ngâm bình cầu có chứa khí NO 2 vào cốc nước nóng thì màu của bình cầu sẽ thay đổi như thế nào?
-
A.
Màu nâu đỏ đâm lên.
-
B.
Màu nâu đỏ nhạt dần.
-
C.
Màu sắc không đổi.
-
D.
Màu chuyển sang đen.
Xét phản ứng thuận nghịch: 2SO 2 (g) + O 2 (g) ⇌ 2SO 3 (g). Cho các phát biểu sau:
(a) Biểu thức hằng số cân bằng của phản ứng trên là: \({K_C} = \frac{{{{\left[ {S{O_3}} \right]}^2}}}{{{{\left[ {S{O_2}} \right]}^2}.\left[ {{O_2}} \right]}}\)
(b) Tại thời điểm cân bằng, hỗn hợp có chứa SO 2 , O 2 , SO 3 .
(c) Theo thời gian, nồng độ SO 2 , O 2 tăng dần, nồng độ SO 3 giảm dần để đạt được trạng thái cân bằng.
(d) Khi tăng áp suất, cân bằng chuyển dịch theo chiều thuận.
Số phát biểu đúng là
-
A.
2.
-
B.
3.
-
C.
4.
-
D.
1.
Dung dịch X có chứa: 0,07 mol Na + ; 0,02 mol SO 4 2- ; 0,02 mol SO 4 2- và x mol OH - . Dung dịch Y chứa 0,03 mol Cl - ; 0,01 mol NO 3 - và y mol H + . Trộn X với Y thu được 100 mL dung dịch Z. Giá trị pH của dung dịch Z là (bỏ qua sự điện li của H 2 O)
-
A.
1.
-
B.
2.
-
C.
13.
-
D.
12.
Thêm 20,00 mL dung dịch HCl 1,00.10 -2 M vào 100,00 mL dung dịch Ba(OH) 2 , thu được hỗn hợp X. Chuẩn độ toàn bộ X bằng dung dịch NaOH 2,00.10 -2 M dùng phenolphthalein làm chỉ thị thì phải dùng hết 8,00 mL dung dịch NaOH. Nồng độ dung dịch Ba(OH) 2 là
-
A.
1,00.10 -4 M.
-
B.
3,00.10 -4 M.
-
C.
2,00.10 -4 M.
-
D.
2,50.10 -4 M.
Trong đơn chất nitrogen, hai nguyên tử N liên kết với nhau bằng 1……
-
A.
liên kết đơn.
-
B.
liên kết đôi.
-
C.
liên kết ba.
-
D.
liên kết ion.
Cho một lượng Cu 2 S tác dụng hoàn toàn với dung dịch HNO 3 đun nóng. Phản ứng tạo thành dung dịch A 1 và làm giải phóng ra khí A 2 không màu, bị hoá nâu trong không khí. Chia A 1 thành hai phần. Thêm dung dịch BaCl 2 vào phần 1, thấy tạo thành kết tủa trắng A 3 không tan trong axit dư. Thêm lượng dư dung dịch NH 3 vào phần hai đồng thời khuấy đều hỗn hợp, thu được dung dịch A 4 có màu xanh đậm.
Nhận định nào dưới đây đúng?
-
A.
Khi A 2 là NO 2 .
-
B.
Kết tủa trắng A 3 là BaSO 4 .
-
C.
Dung dịch A 4 là muối của Cu.
-
D.
Dung dịch A 1 chắc chắn có muối nitrate.
Liên kết hoá học trong phần tử NH 3 là liên kết
-
A.
cộng hoá trị có cực.
-
B.
ion.
-
C.
cộng hoá trị không cực.
-
D.
kim loại.
Khi sục khí SO 2 vào dung dịch H 2 S thì
-
A.
dung dịch bị vẩn đục vàng.
-
B.
dung dịch bị vẩn đục đỏ.
-
C.
không có hiện tượng gì.
-
D.
dung dịch xuất hiện chất rắn màu đen.
Cho phản ứng sau:
2H 2 S(g) + 3O 2 (g) \( \to \)2SO 2 (g) + 2H 2 O(g)
Biết nhiệt tạo thành chuẩn của H 2 S(g), SO 2 (g) và H 2 O(g) lần lượt là -20,3 kJ/mol; -296,8 kJ/mol và -258,8 kJ/mol.
Giá trị biến thiên enthalpy của phản ứng trên là
-
A.
1124,6
-
B.
-1124,6.
-
C.
-535,3.
-
D.
+1124,6.
Sulfur dioxide và các oxide của nitrogen trong khí quyển hòa tan trong nước tạo thành mưa acid. Khẳng định nào sau đây là đúng?
-
A.
Nước mưa có pH > 5,6 được xem là mưa acid.
-
B.
Thành phần chính của mưa acid là H 2 SO 3 và HNO 3.
-
C.
Công thức hóa học của NO x trong khí thải ô tô luôn là là NO 2 .
-
D.
Thu hồi sulfur từ các khí thải như H 2 S, SO 2 ….có thể làm giảm sự hình thành mưa acid.
Cho các phát biểu sau:
(a) Hợp chất có chứa carbon là hợp chất hữu cơ.
(b) Dẫn xuất hydrocarbon trong thành phần phân tử chỉ chứa hai nguyên tố là C và H.
(c) Chưng cất là phương pháp tách chất dựa vào sự khác nhau về nhiệt độ sôi của các chất.
(d) Có thể tách dầu ăn và nước ra khỏi nhau bằng cách sử dụng phương pháp kết tinh.
(đ) Ngâm rượu thuốc là phương pháp chiết lỏng – rắn.
Số phát biểu đúng là
-
A.
4.
-
B.
3.
-
C.
2.
-
D.
1.
Ethyl iodine có khối lượng riêng là 1,94 g.mL -1 và có nhiệt độ sôi là 72,0 o C. Ethanol có khối lượng riêng là 0,789 g.mL -1 và có nhiệt độ sôi là 78,3 o C. Ethanol tan trong nước còn ethyl iodide kém tan trong nước nhưng tan được trong ethanol. Ethyl iodide thường được điều chế từ ethanol và sản phẩm thu được thường lẫn ethanol. Để tinh chế ethyl iodide từ hỗn hợp chất này với ethanol, phương pháp nên được sử dụng là
-
A.
phương pháp sắc kí.
-
B.
phương pháp chiết và sử dụng thêm nước cất để tách ethyl iodide với ethanol.
-
C.
phương pháp chưng cất phân đoạn.
-
D.
phương pháp chưng cất lôi cuốn hơi nước.
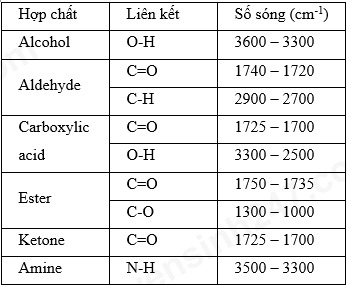
Phổ hồng ngoại của hợp chất hữu cơ nào dưới đây không hấp thụ ở vùng 2800 – 3600 cm -1 ?
-
A.
Alcohol.
-
B.
Amine.
-
C.
Ester.
-
D.
Aldehyde
Cho các nhận định sau:
(a) Tất cả các hợp chất hữu cơ đều có đồng phân cấu tạo.
(b) Hợp chất hữu cơ có thể có: đồng phân cấu tạo, đồng phân hình học, đồng phân quang học.
(c) Đồng phân hình học và đồng phân quang học là một loại đồng phân.
(d) Đồng phân hình học và đồng phân quang học đều có cấu tạo giống nhau.
(đ) Đồng phân hình học chỉ xuất hiện khi trong phân tử có liên kết đôi.
Số nhận định đúng là
-
A.
4.
-
B.
3.
-
C.
2.
-
D.
1.
Aspirin là một trong những loại thuốc được sử dụng khá nhiều trong các quá trình điều trị bệnh. Đây là loại thuốc giảm đau, hạ nhiệt đồng thời có khả năng chống viêm. Một mẫu aspirin được xác định có chứa 60,00% carbon; 4,44% hydrogen và 35,56% oxygen về khối lượng. Công thức đơn giản nhất của aspirin là
-
A.
C 9 H 8 O 4 .
-
B.
C 3 H 2 O.
-
C.
C 5 H 4 O 2 .
-
D.
C 2 H 2 O.
Hợp chất A có công thức phân tử C 3 H 6 O. Khi đo phổ hồng ngoại cho kết quả như hình dưới. Công thức cấu tạo của A là
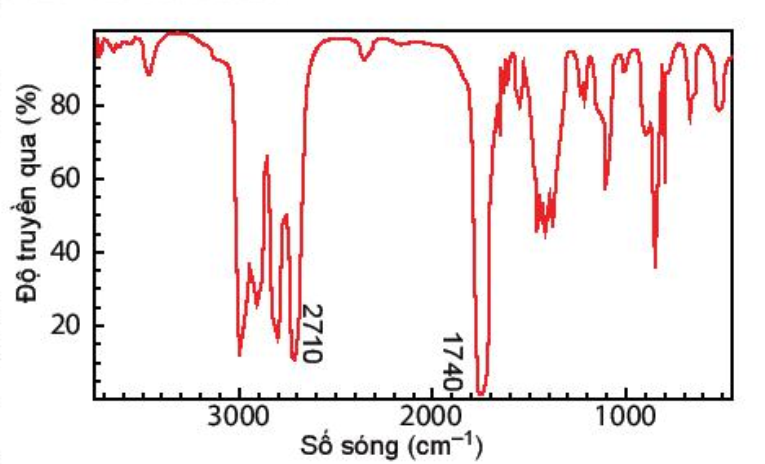
-
A.
CH 3 -C(=O)-CH 3 .
-
B.
CH 2 =CH-CH 2 -OH.
-
C.
CH 3 -O-CH=CH 2
-
D.
CH 3 -CH 2 -CH=O
Khi tiến hành phân tích định lượng vitamin C, người ta xác định được hàm lượng phần trăm (về khối lượng) các nguyên tố như sau: %C = 40,91%; %H = 4,545%; %O = 54,545%. Kết quả phân tích phổ khối lượng cho thấy phân tử khối của vitamin C là 176. Công thức phân tử của vitamin C là
-
A.
C 6 H 8 O 6 .
-
B.
C 8 H 8 O 2 .
-
C.
C 7 H 6 O 3 .
-
D.
C 4 H 6 O 2 .
Đốt cháy hoàn toàn 5,75 gam hợp chất hữu cơ X thu được 11,00 gam CO 2 và 6,75 gam H 2 O. Biết tỉ khối hơi của X so với hydrogen bằng 23. Công thức phân tử của X là
-
A.
CH 3 .
-
B.
C 2 H 6 O.
-
C.
CH 3 O.
-
D.
C 2 H 4 O 2 .
Lời giải và đáp án
Chất nào dưới đây là chất điện li?
-
A.
C 12 H 22 O 11 .
-
B.
C 2 H 6 .
-
C.
BaSO 4 .
-
D.
HCN.
Đáp án : D
Nhận biết chất điện li.
Chất điện li: HCN.
Cho cân bằng hóa học: CO(g) + H 2 O (g) ⇌ CO 2 (g) + H 2 (g). Nếu lúc đầu chỉ có CO và hơi nước với nồng độ C CO = 0,1M, C H2O = 0,4M, K C = 1 thì nồng độ cân bằng của CO 2 là
-
A.
0,08.
-
B.
0,06.
-
C.
0,05.
-
D.
0,1.
Đáp án : A
Dựa vào lý thuyết về cân bằng hoá học.
CO(g) + H 2 O (g) ⇌ CO 2 (g) + H 2 (g)
BĐ 0,1 0,4
PƯ x x x x
CB 0,1 - x 0,4 - x x x
K c = [CO 2 ].[H 2 ]/[CO].[H 2 ] = x 2 /[(0,1 – x).(0,4 – x)] = 1
⟹ x = 0,08 M
Cho cân bằng hóa học:
2NO 2 (g) ⇌ N 2 O 4 ∆ r H < 0
Nâu đỏ không màu
Khi ngâm bình cầu có chứa khí NO 2 vào cốc nước nóng thì màu của bình cầu sẽ thay đổi như thế nào?
-
A.
Màu nâu đỏ đâm lên.
-
B.
Màu nâu đỏ nhạt dần.
-
C.
Màu sắc không đổi.
-
D.
Màu chuyển sang đen.
Đáp án : A
Chuyển dịch cân bằng theo nguyên lí Le Chaterlier.
∆ r H < 0 ⟹ Chiều thuận phản ứng tỏa nhiệt ⟹ Khi ngâm bình cầu vào nước, cân bằng sẽ chuyển dịch theo chiều nghịch.
Xét phản ứng thuận nghịch: 2SO 2 (g) + O 2 (g) ⇌ 2SO 3 (g). Cho các phát biểu sau:
(a) Biểu thức hằng số cân bằng của phản ứng trên là: \({K_C} = \frac{{{{\left[ {S{O_3}} \right]}^2}}}{{{{\left[ {S{O_2}} \right]}^2}.\left[ {{O_2}} \right]}}\)
(b) Tại thời điểm cân bằng, hỗn hợp có chứa SO 2 , O 2 , SO 3 .
(c) Theo thời gian, nồng độ SO 2 , O 2 tăng dần, nồng độ SO 3 giảm dần để đạt được trạng thái cân bằng.
(d) Khi tăng áp suất, cân bằng chuyển dịch theo chiều thuận.
Số phát biểu đúng là
-
A.
2.
-
B.
3.
-
C.
4.
-
D.
1.
Đáp án : B
Dựa vào lý thuyết về cân bằng hoá học.
(a), (b), (c) đúng.
(c) sai, vì theo thời gian, nồng độ SO 2 , O 2 giảm dần, nồng độ SO 3 tăng dần để đạt được trạng thái cân bằng.
Dung dịch X có chứa: 0,07 mol Na + ; 0,02 mol SO 4 2- ; 0,02 mol SO 4 2- và x mol OH - . Dung dịch Y chứa 0,03 mol Cl - ; 0,01 mol NO 3 - và y mol H + . Trộn X với Y thu được 100 mL dung dịch Z. Giá trị pH của dung dịch Z là (bỏ qua sự điện li của H 2 O)
-
A.
1.
-
B.
2.
-
C.
13.
-
D.
12.
Đáp án : C
Định luật bảo toàn điện tích, cách tính pH của dung dịch.
Sơ đồ:
\({\rm{dd}}X\left\{ {\begin{array}{*{20}{l}}{N{a^ + }:0,07}\\{S{O_4}^{2 - }:0,02}\\{O{H^ - }:x}\end{array}} \right. + {\rm{dd}}Y\left\{ {\begin{array}{*{20}{l}}{C{l^ - }:0,03}\\{N{O_3}^ - :0,01}\\{{H^ + }:y}\end{array}} \right. \to {\rm{dd}}Z\)
BTĐT(ddX): 0,07 = 0,02.2+x ⟹ x = 0,03 (mol)
BTĐT(ddY): 0,03 + 0,01 = y ⟹ y = 0,04 (mol)
Dd X + ddY ⟶ Xảy ra phản ứng trung hòa.
H + + OH - ⟶ H 2 O
Ban đầu: 0,03 0,04
Phản ứng: 0,03 ⟶ 0,03
Sau: 0 0,01
⟹ [OH - ] = 0,01/0,1 = 0,1
pH = 14 + log([OH - ]) = 13.
Thêm 20,00 mL dung dịch HCl 1,00.10 -2 M vào 100,00 mL dung dịch Ba(OH) 2 , thu được hỗn hợp X. Chuẩn độ toàn bộ X bằng dung dịch NaOH 2,00.10 -2 M dùng phenolphthalein làm chỉ thị thì phải dùng hết 8,00 mL dung dịch NaOH. Nồng độ dung dịch Ba(OH) 2 là
-
A.
1,00.10 -4 M.
-
B.
3,00.10 -4 M.
-
C.
2,00.10 -4 M.
-
D.
2,50.10 -4 M.
Đáp án : C
Dựa vào lý thuyết về chuẩn độ acid – base.
n OH- = n H+
⟹ n NaOH + 2n Ba(OH)2 = n HCl
⟹ 8.2,00.10 -2 + 2.100.C M Ba(OH)2 = 20.1,00.10 -2
⟹ C M Ba(OH)2 = 2,00.10 -4 (M)
Trong đơn chất nitrogen, hai nguyên tử N liên kết với nhau bằng 1……
-
A.
liên kết đơn.
-
B.
liên kết đôi.
-
C.
liên kết ba.
-
D.
liên kết ion.
Đáp án : C
Kiến thức về đơn chất nitrogen.
Trong đơn chất nitrogen, hai nguyên tử N liên kết với nhau bằng 1 liên kết ba.
Cho một lượng Cu 2 S tác dụng hoàn toàn với dung dịch HNO 3 đun nóng. Phản ứng tạo thành dung dịch A 1 và làm giải phóng ra khí A 2 không màu, bị hoá nâu trong không khí. Chia A 1 thành hai phần. Thêm dung dịch BaCl 2 vào phần 1, thấy tạo thành kết tủa trắng A 3 không tan trong axit dư. Thêm lượng dư dung dịch NH 3 vào phần hai đồng thời khuấy đều hỗn hợp, thu được dung dịch A 4 có màu xanh đậm.
Nhận định nào dưới đây đúng?
-
A.
Khi A 2 là NO 2 .
-
B.
Kết tủa trắng A 3 là BaSO 4 .
-
C.
Dung dịch A 4 là muối của Cu.
-
D.
Dung dịch A 1 chắc chắn có muối nitrate.
Đáp án : B
Kiến thức về tính chất các hợp chất của nitrogen.

A sai, vì A 2 là NO.
B đúng.
C sai, vì A 4 là phức của Cu.
D sai, vì A 1 có thể có muối nitrate.
Liên kết hoá học trong phần tử NH 3 là liên kết
-
A.
cộng hoá trị có cực.
-
B.
ion.
-
C.
cộng hoá trị không cực.
-
D.
kim loại.
Đáp án : A
Dựa vào lý thuyết về NH 3 .
Liên kết hoá học trong phần tử NH 3 là liên kết cộng hoá trị có cực.
Khi sục khí SO 2 vào dung dịch H 2 S thì
-
A.
dung dịch bị vẩn đục vàng.
-
B.
dung dịch bị vẩn đục đỏ.
-
C.
không có hiện tượng gì.
-
D.
dung dịch xuất hiện chất rắn màu đen.
Đáp án : A
Lý thuyết về tính chất hóa học của H 2 S.
2H 2 S + SO 2 ⟶ 3S kết tủa vàng + 2H 2 O
Cho phản ứng sau:
2H 2 S(g) + 3O 2 (g) \( \to \)2SO 2 (g) + 2H 2 O(g)
Biết nhiệt tạo thành chuẩn của H 2 S(g), SO 2 (g) và H 2 O(g) lần lượt là -20,3 kJ/mol; -296,8 kJ/mol và -258,8 kJ/mol.
Giá trị biến thiên enthalpy của phản ứng trên là
-
A.
1124,6
-
B.
-1124,6.
-
C.
-535,3.
-
D.
+1124,6.
Đáp án : B
Tính biến thiên enthalpy của phản ứng: ∆ r H 0 298 = Σ∆ f H 0 298 (sp) - Σ∆ f H 0 298 (cđ).
∆ r H 0 298 (2) = 2∆ f H 0 298 (H 2 O) + 2∆ f H 0 298 (SO 2 ) - 2∆ f H 0 298 (H 2 S) = -1124,6 (kJ)
Sulfur dioxide và các oxide của nitrogen trong khí quyển hòa tan trong nước tạo thành mưa acid. Khẳng định nào sau đây là đúng?
-
A.
Nước mưa có pH > 5,6 được xem là mưa acid.
-
B.
Thành phần chính của mưa acid là H 2 SO 3 và HNO 3.
-
C.
Công thức hóa học của NO x trong khí thải ô tô luôn là là NO 2 .
-
D.
Thu hồi sulfur từ các khí thải như H 2 S, SO 2 ….có thể làm giảm sự hình thành mưa acid.
Đáp án : D
Dựa vào lý thuyết về mưa acid.
A sai, vì nước mưa có pH < 5,6 được xem là mưa acid.
B sai, vì thành phần chính của mưa acid là H 2 SO 4 và HNO 3.
C sai, có thể là NO hoặc NO 2 .
D đúng.
Cho các phát biểu sau:
(a) Hợp chất có chứa carbon là hợp chất hữu cơ.
(b) Dẫn xuất hydrocarbon trong thành phần phân tử chỉ chứa hai nguyên tố là C và H.
(c) Chưng cất là phương pháp tách chất dựa vào sự khác nhau về nhiệt độ sôi của các chất.
(d) Có thể tách dầu ăn và nước ra khỏi nhau bằng cách sử dụng phương pháp kết tinh.
(đ) Ngâm rượu thuốc là phương pháp chiết lỏng – rắn.
Số phát biểu đúng là
-
A.
4.
-
B.
3.
-
C.
2.
-
D.
1.
Đáp án : C
Lý thuyết về phương pháp tách và chiết chất hữu cơ.
(a) sai, vì hợp chất hữu cơ có chứa carbon nhưng trừ CO, CO 2 , …..
(b) sai, vì dẫn xuất hydrocarbon là hợp chất trong phân tử ngoài C, H còn có thêm các nguyên tố khác.
(c) đúng.
(d) sai, vì có thể tách dầu ăn và nước ra khỏi nhau bằng cách sử dụng phương pháp chiết.
(đ) đúng.
⟹ Có 2 phương án đúng.
Ethyl iodine có khối lượng riêng là 1,94 g.mL -1 và có nhiệt độ sôi là 72,0 o C. Ethanol có khối lượng riêng là 0,789 g.mL -1 và có nhiệt độ sôi là 78,3 o C. Ethanol tan trong nước còn ethyl iodide kém tan trong nước nhưng tan được trong ethanol. Ethyl iodide thường được điều chế từ ethanol và sản phẩm thu được thường lẫn ethanol. Để tinh chế ethyl iodide từ hỗn hợp chất này với ethanol, phương pháp nên được sử dụng là
-
A.
phương pháp sắc kí.
-
B.
phương pháp chiết và sử dụng thêm nước cất để tách ethyl iodide với ethanol.
-
C.
phương pháp chưng cất phân đoạn.
-
D.
phương pháp chưng cất lôi cuốn hơi nước.
Đáp án : B
Ứng dụng phương pháp chiết vào thực tế.
Các bước tách ethyl iodide ra khỏi ethanol.
Bước 1: Thêm nước cất vào hỗn hợp cần tách, khuấy đều.
Bước 2: Để yên hỗn hợp một thời gian.
Hỗn hợp tách 2 lớp, lớp trên gồm nước + ethanol, lớp dưới là ethyl iodide.
Bước 3: Chiết và lấy lớp dưới.
Phổ hồng ngoại của hợp chất hữu cơ nào dưới đây không hấp thụ ở vùng 2800 – 3600 cm -1 ?
-
A.
Alcohol.
-
B.
Amine.
-
C.
Ester.
-
D.
Aldehyde
Đáp án : C
Xác định được sóng hấp thụ của một số nhóm chức.
Phổ hồng ngoại của ester không hấp thụ ở vùng 2800 – 3600 cm -1 .
Cho các nhận định sau:
(a) Tất cả các hợp chất hữu cơ đều có đồng phân cấu tạo.
(b) Hợp chất hữu cơ có thể có: đồng phân cấu tạo, đồng phân hình học, đồng phân quang học.
(c) Đồng phân hình học và đồng phân quang học là một loại đồng phân.
(d) Đồng phân hình học và đồng phân quang học đều có cấu tạo giống nhau.
(đ) Đồng phân hình học chỉ xuất hiện khi trong phân tử có liên kết đôi.
Số nhận định đúng là
-
A.
4.
-
B.
3.
-
C.
2.
-
D.
1.
Đáp án : C
Lý thuyết về các loai đồng phân trong phân tử hữu cơ.
(a) sai, vì methane, ethane,… không có đồng phân cấu tạo.
(b) đúng.
(c) sai, vì đồng phân hình học và đồng phân quang học là hai loại đồng phân khác nhau.
(d) đúng.
(đ) sai, vì đồng phân hình học chỉ xuất hiện khi trong phân tử có liên kết đôi và hay nguyên tử hay nhóm nguyên tử cùng gắn với nguyên tử carbon có nối đôi phải khác nhau.
⟹ Có 2 nhận định đúng.
Aspirin là một trong những loại thuốc được sử dụng khá nhiều trong các quá trình điều trị bệnh. Đây là loại thuốc giảm đau, hạ nhiệt đồng thời có khả năng chống viêm. Một mẫu aspirin được xác định có chứa 60,00% carbon; 4,44% hydrogen và 35,56% oxygen về khối lượng. Công thức đơn giản nhất của aspirin là
-
A.
C 9 H 8 O 4 .
-
B.
C 3 H 2 O.
-
C.
C 5 H 4 O 2 .
-
D.
C 2 H 2 O.
Đáp án : A
C : H : O = \(\frac{{\% {\rm{C}}}}{{{\rm{12}}}}:\frac{{\% {\rm{H}}}}{{\rm{1}}}:\frac{{\% {\rm{O}}}}{{{\rm{16}}}}\)
C : H : O = \(\frac{{\% {\rm{C}}}}{{{\rm{12}}}}:\frac{{\% {\rm{H}}}}{{\rm{1}}}:\frac{{\% {\rm{O}}}}{{{\rm{16}}}} = \frac{{{\rm{60}}}}{{{\rm{12}}}}:\frac{{{\rm{4}},{\rm{44}}}}{{\rm{1}}}:\frac{{{\rm{35}},{\rm{56}}}}{{{\rm{16}}}} = 5:4,44:2,2225 = 9:8:4\)
CTĐGN: C 9 H 8 O 4.
Hợp chất A có công thức phân tử C 3 H 6 O. Khi đo phổ hồng ngoại cho kết quả như hình dưới. Công thức cấu tạo của A là

-
A.
CH 3 -C(=O)-CH 3 .
-
B.
CH 2 =CH-CH 2 -OH.
-
C.
CH 3 -O-CH=CH 2
-
D.
CH 3 -CH 2 -CH=O
Đáp án : D
Quan sát phổ hồng ngoại của A thấy A có thể là hợp chất chứa nhóm chức aldehyde.
Công thức cấu tạo của A là: CH 3 –CH 2 –CHO.
Khi tiến hành phân tích định lượng vitamin C, người ta xác định được hàm lượng phần trăm (về khối lượng) các nguyên tố như sau: %C = 40,91%; %H = 4,545%; %O = 54,545%. Kết quả phân tích phổ khối lượng cho thấy phân tử khối của vitamin C là 176. Công thức phân tử của vitamin C là
-
A.
C 6 H 8 O 6 .
-
B.
C 8 H 8 O 2 .
-
C.
C 7 H 6 O 3 .
-
D.
C 4 H 6 O 2 .
Đáp án : A
Dựa vào lý thuyết về lập công thức phân tử hợp chất hữu cơ.
Đặt công thức phân tử tổng quát là C x H y O z , ta có:
\(\frac{{\% C}}{{12}}:\frac{{\% H}}{1}:\frac{{\% O}}{{16}} = \frac{{40,9}}{{12}}:\frac{{4,55}}{1}:\frac{{54,55}}{{16}} = 3,408:4,55:3,409 = 1:1,33:1 = 3:4:3.\)
Vậy công thức đơn giản nhất của vitamin C là: C 3 H 4 O 3 .
\( \Rightarrow \) C x H y O z = (C 3 H 4 O 3 ) n .
⟹ (12.3 + 4 + 16.3).n = 176 \( \Rightarrow \) n = 2.
Vậy công thức phân tử của vitamin C là: C 6 H 8 O 6
Đốt cháy hoàn toàn 5,75 gam hợp chất hữu cơ X thu được 11,00 gam CO 2 và 6,75 gam H 2 O. Biết tỉ khối hơi của X so với hydrogen bằng 23. Công thức phân tử của X là
-
A.
CH 3 .
-
B.
C 2 H 6 O.
-
C.
CH 3 O.
-
D.
C 2 H 4 O 2 .
Đáp án : B
Xác định công thức phân tử từ phản ứng đốt cháy.
n CO2 = 0,25 (mol) ⟶ n C = 0,25 (mol) ⟶ m C = 3 (g)
n H2O = 0,375 (mol) ⟶ n H = 0,75 (mol) ⟶ m H = 0,75 (g)
⟹ m O = 2 (g) ⟶ n O = 0,125 (mol)
M X = 23.2 = 46 ⟶ n X = 0,125 (mol)
C = n C /n X = 2.
H = n H /n X = 6.
O = n O /n X = 1
⟶ CTPT: C 2 H 6 O.